диастаз прямой мышцы живота код по мкб 10
Диастаз прямых мышц живота — диагностика, симптомы, лечение, пластика и салонные процедуры по уходу
Развитие диастаза напрямую связано с особенностями анатомии мышечно-связочного аппарата в области живота. Передняя брюшная стенка сформирована пучками мышечных волокон, которые образуют брюшной пресс. Посередине, с правой и левой стороны по отношению к пупку проходят 2 вертикальные мышцы, соединенные между собой полоской сухожильной ткани, называемой апоневрозом или белой линией живота.
Несмотря на прочное переплетение, волокна соединительной ткани между прямыми мышцами обладают хорошей растяжимостью. Под воздействием провоцирующих факторов межмышечный апоневроз растягивается и истончается. В результате расстояние между мышцами увеличивается, а деформированная сухожильная полоска не в состоянии удержать их в правильном положении, вследствие чего они расходятся в стороны.
Основная масса больных, обращающихся с жалобами на деформацию по срединной линии живота – рожавшие женщины. Причиной большой распространенности диастаза передних мышц среди пациентов женского пола являются особенности перестройки организма во время беременности:
На практике диастаз прямых мышц живота встречается у 60 % беременных. Процесс расхождения мышечных пучков начинается с 14 недели и продолжается до родов. Чаще всего изменения считают физиологическими и не требуют специфического лечения. По статистике, белая линия живота восстанавливается в течение года. Если послеродовый диастаз в течение этого срока сохраняется, без помощи медицинского специалиста уже не обойтись.
Помимо беременных женщин, заболевание встречается у новорожденных детей. Основной причиной детского диастаза становится недоразвитие брюшной стенки. У мужчин патологию провоцируют:
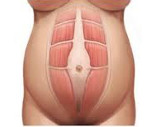
Диастаз прямых мышц живота
Диастаз прямых мышц живота — это растяжение межмышечного апоневроза, соединяющего продольные поверхностные пучки мускулатуры брюшного пресса. Проявляется выпячиванием по срединной линии живота, болями в эпигастральной и околопупочной области, диспепсическими расстройствами, метеоризмом, запорами, недержанием мочи при нагрузках. Диагностируется при помощи пальпации, эхографии брюшной стенки, рентгенографии полости живота. Для лечения применяется коррекция нагрузок и двигательной активности, диеты, ЛФК, массаж, кинезиологическое тейпирование, эндоскопическая и классическая абдоминопластика.
МКБ-10
Общие сведения
Растяжение сухожильного апоневроза прямых мышц, расположенного по средней линии живота, отмечается у 1% населения. Физиологический диастаз брюшной мускулатуры наблюдается у младенцев и у 66-100% беременных в 3 триместре гестационного периода. Стойкому выраженному расхождению мышц более подвержены женщины субтильного телосложения, выносившие больше одного ребенка, мужчины среднего и старшего возраста, страдающие абдоминальным ожирением. В связи с эпидемическим характером распространения ВИЧ-инфекции в последние годы увеличивается количество случаев заболевания, обусловленных вторичной дистрофией мускульных и соединительнотканных волокон.
Причины диастаза
Возникновению заболевания способствует длительное повышение внутрибрюшного давления в сочетании с нарушением структуры волокон, формирующих срединную сухожильную мембрану передней брюшной стенки. По мнению специалистов в сфере пластической и абдоминальной хирургии, наиболее распространенными причинами расхождения прямых мышц являются:
Факторы риска
К числу факторов, потенцирующих расхождение брюшной мускулатуры, принадлежат ожирение, стремительное похудение, значительные физические нагрузки, запоры, хронические заболевания органов дыхания с надсадным кашлем, которые играют ведущую роль в развитии патологии у пациентов мужского пола. В группу риска также входят больные с врожденной дисплазией соединительной ткани, диастаз часто ассоциирован с наследственными коллагенопатиями — грыжами разной локализациями, варикозной болезнью, миопией, сколиозом, плоскостопием с вальгусной деформацией, частыми подвывихами лодыжек, геморроем.
Патогенез
Пусковым моментом формирования диастаза прямых мышц живота становится длительное растяжение брюшной стенки, обусловленное ростом матки, большим объемом висцерального жира, нарушениями пищеварения при употреблении новорожденным продуктов, вызывающих метеоризм. Под действием распирающих нагрузок прямые мышцы расходятся, а соединяющая их белая линия растягивается.
Усугубляющим фактором становится ослабление межмышечного апоневроза вследствие несостоятельности волокон при коллагенопатиях, разрыхлении соединительной ткани под влиянием релаксина, незрелости сухожильно-мышечных структур живота у недоношенных или их дистрофии в терминальных стадиях различных патологических процессов. В физиологических условиях апоневротическая мембрана самостоятельно сокращается по мере укрепления соединительной ткани и мышц у младенцев, постепенного уменьшения объема брюшной полости в послеродовом периоде и при плавном похудении.
Расхождение прямых поверхностных мышц в младенчестве обычно исчезает к 6-12 месячному возрасту, однако восстановительный процесс может несколько затягиваться у ослабленных детей и не полностью завершаться при синдроме Дауна. У родившей женщины диастаз в норме самопроизвольно закрывается в течение 2-12 месяцев после естественных родов.
Восстановление размеров межмышечного апоневроза может нарушаться при ранних интенсивных тренировках для восстановления физической формы, поскольку сокращение прямых мышц пресса с одновременным повышением внутрибрюшного давления фиксирует белую линию в растянутом состоянии. Аналогичный эффект оказывает тяжелая физическая работа, расстройства, при которых кратковременно интенсивно напрягается брюшной пресс (запор, кашель). Сохранение диастаза при резком похудении обусловлено более медленным сокращением сухожильных волокон, которые не успевают подтянуться за уменьшающимся в объеме животом.
Классификация
Систематизация форм абдоминального диастаза проводится с учетом локализации участка растяжения и расстояния между внутренними краями прямых мышц. Такой подход позволяет определиться с тактикой ведения пациента и объемом хирургического вмешательства (при его необходимости). Пластические и абдоминальные хирурги различают следующие виды и степени растяжения белой линии:
Классификация вариантов болезни, используемая в пластической хирургии, учитывает состояние как прямых, так и других групп мышц живота. Соответственно выделяют диастазы типа А — классический послеродовый, B — с расслаблением нижней части и боковых отделов живота, C —распространяющийся до реберных дуг и мечевидного отростка, D — сочетающийся с отсутствием талии.
Симптомы диастаза
Клиническая картина болезни напрямую зависит от степени растяжения сухожильного апоневроза. На начальном этапе единственным проявлением диастаза является косметический дефект в виде выпячивания живота по белой линии. При напряжении пресса можно увидеть «желобок», разделяющий края прямых мышц. Расхождение может сопровождаться дискомфортом, умеренной болезненностью в эпигастрии, околопупочной области во время физических нагрузок, болью в пояснице, затруднениями при ходьбе.
При прогрессировании заболевания отмечаются нарушения моторики кишечника (метеоризм, запоры), тошнота. У 66% женщин с послеродовым растяжением апоневроза наблюдается дисфункция мышц диафрагмы таза, которая клинически проявляется недержанием мочи в момент кашля, чихания. При выраженном диастазе могут выявляться признаки атрофии мускулатуры живота, венозного застоя в сосудах нижних конечностей.
Осложнения
При значительном расхождении краев прямых мышц (7 см и более) у пациентов нередко формируются грыжи пупочного кольца и белой линии живота, которые обусловлены наличием дефектов апоневроза и выходом органов брюшной полости вместе с брюшиной под кожу. Частым осложнением заболевания является спланхноптоз — опущение внутренних органов вследствие ослабления мускулатуры живота, что клинически проявляется хроническими запорами вплоть до развития кишечной непроходимости, тошнотой, тахикардией, головокружениями. При дискоординации работы мышц возникает чрезмерная нагрузка на позвоночник, которая может привести к постоянным болям в спине, нарушению осанки.
Диагностика
Постановка диагноза не представляет затруднений, поскольку диастаз прямых мышц живота всегда сопровождается характерной клинической картиной. Диагностический поиск при тяжелой стадии заболевания направлен на выявление возможных осложнений и нарушений в работе внутренних органов. План обследования пациента включает следующие физикальные и инструментальные методы:
В стандартных лабораторных исследованиях (клиническом анализе крови, мочи, копрограмме) при неосложненном расхождении прямых мышц отклонения от нормы не обнаруживаются. Для комплексной оценки состояния внутренних органов пациентам, у которых возникли осложнения заболевания, могут рекомендоваться КТ, МСКТ брюшной полости, измерение кислотности желудочного сока, УЗИ органов малого таза.
Дифференциальная диагностика
Дифференциальная диагностика диастаза выполняется с врожденными аномалиями развития соединительной ткани, грыжами белой линии и пупочного кольца, хроническими заболеваниями пищеварительного тракта (гастритами, энтероколитами), болезнями мочеполовой системы. Кроме осмотра абдоминального и пластического хирурга пациенту рекомендованы консультации гастроэнтеролога, уролога, гинеколога, младенцам — неонатолога или педиатра.
Лечение диастаза мышц живота
Консервативная терапия
Тактика ведения пациента определяется длительностью существования апоневротического растяжения, его степенью и типом. При развитии диастаза на фоне желудочно-кишечных, бронхолегочных и других заболеваний обязательно назначается лечение основной патологии. В младенческом возрасте используется выжидательный подход с принятием решения об оперативном укреплении брюшной стенки после 6 месяцев при наличии сопутствующих грыж и после 12 месяцев при сохранении диастаза и выраженной клинической симптоматике.
Период наблюдения за женщиной после родов обычно составляет не менее года, при этом физиологическим считается растяжение апоневроза мышц живота до 2,0-2,5 см, сохраняющееся в течение первых 6-8 послеродовых недель. Женщинам с расхождением абдоминальных мышц показано ношение бандажа на протяжении 2-4 месяцев после родов, отказ от использования слингов, коррекция питания для обеспечения нормальной дефекации, поддерживание живота при кашле и чихании. В качестве вспомогательного метода может применяться кинезиологическое тейпирование.
Консервативный подход с использованием специального комплекса ЛФК и массажа допустим при диастазе I степени. Пациенту рекомендуется соблюдать диету для поддержания нормальной массы тела, исключить поднятие тяжестей более 5-6 кг, упражнения в упоре и коленно-локтевой позиции, в том числе планку и отжимание, прогибы, скручивание, обратное скручивание.
Хирургическое лечение
Оперативное лечение диастаза проводится при расхождении мышц живота 2-3 степени, наличии сопутствующей пупочной грыжи. У женщин хирургическое вмешательство выполняется не ранее, чем спустя год после родов при отсутствии планов на новую беременность и хорошем состоянии брюшной мускулатуры. С учетом степени и характера растяжения, состояния окружающих тканей применяются различные виды операций:
Прогноз и профилактика
При диагностике и лечении диастаза на ранних стадиях у большинства пациентов наблюдается полное выздоровление без проведения хирургических вмешательств. Прогноз заболевания благоприятный. В запущенных случаях могут развиваться опасные осложнения (ущемление грыжи), требующие ургентной операции.
Для профилактики растяжения апоневроза необходимо систематически выполнять упражнения для укрепления мышц живота, избегать подъема тяжестей, нормализовать работу кишечника, увеличить содержание клетчатки в рационе, контролировать массу тела. По данным исследований, выполнение беременными специального комплекса упражнений для мышц живота на 35% сокращает риск развития послеродового диастаза.
Диастаз прямой мышцы живота код по мкб 10
НУЗ «Научный клинический центр ОАО «Российские железные дороги», Москва, Россия; ФГБОУ ВО «Московский государственный университет им. М.В. Ломоносова», Москва, Россия
ФГБОУ ВО «Московский государственный университет им. М.В. Ломоносова», Москва, Россия
Кафедра эндоскопической хирургии ФПДО МГМСУ
ГАУЗ МО «Воскресенская районная больница №2», Воскресенск, Московская область, Россия; РНИМУ им. Н.И. Пирогова, кафедра экспериментальной и клинической хирургии медико-биологического факультета, Москва, Россия
Кафедра факультетской хирургии СПб ГМУ им. акад. И.П. Павлова МЗСР РФ; Городской Центр современных хирургических технологий 31-й клинической больницы, Санкт-Петербург
Московский медицинский университет «Реавиз», Москва, Россия
Диастаз прямых мышц живота в хирургическом аспекте: определение, эпидемиология, этиология и патогенез, клинические проявления, диагностика
Журнал: Эндоскопическая хирургия. 2019;25(6): 41-48
Юрасов А. В., Ракинцев В. С., Матвеев Н. Л., Бурдаков В. А., Макаров С. А., Куприянова А. С. Диастаз прямых мышц живота в хирургическом аспекте: определение, эпидемиология, этиология и патогенез, клинические проявления, диагностика. Эндоскопическая хирургия. 2019;25(6):41-48. https://doi.org/10.17116/endoskop20192506141
НУЗ «Научный клинический центр ОАО «Российские железные дороги», Москва, Россия; ФГБОУ ВО «Московский государственный университет им. М.В. Ломоносова», Москва, Россия
Работа посвящена анализу современных данных литературы по вопросам эпидемиологии, этиологии и патогенеза, клинических проявлений и диагностики диастаза прямых мышц живота (ДПМЖ). Приведены основные классификации ДПМЖ. Обсуждается место ДПМЖ в современной герниологии и эстетической хирургии брюшной стенки.
НУЗ «Научный клинический центр ОАО «Российские железные дороги», Москва, Россия; ФГБОУ ВО «Московский государственный университет им. М.В. Ломоносова», Москва, Россия
ФГБОУ ВО «Московский государственный университет им. М.В. Ломоносова», Москва, Россия
Кафедра эндоскопической хирургии ФПДО МГМСУ
ГАУЗ МО «Воскресенская районная больница №2», Воскресенск, Московская область, Россия; РНИМУ им. Н.И. Пирогова, кафедра экспериментальной и клинической хирургии медико-биологического факультета, Москва, Россия
Кафедра факультетской хирургии СПб ГМУ им. акад. И.П. Павлова МЗСР РФ; Городской Центр современных хирургических технологий 31-й клинической больницы, Санкт-Петербург
Московский медицинский университет «Реавиз», Москва, Россия
Диастаз прямых мышц живота (ДПМЖ) – патологическое состояние, характеризующееся истончением и расширением белой линии живота, а в тяжелых формах – всего мышечно-апоневротического комплекса передней брюшной стенки, вплоть до спигелиевой линии.
О реальной распространенности диастаза прямых мышц живота (ДПМЖ) судить сложно, так как отсутствуют единые критерии диагностики, нет соответствующей рубрикации в МКБ-10, не проводились крупные исследования в этой сфере. Однако, опираясь на этиологию и патогенез ДПМЖ, можно сделать некоторые выводы.
Этиология и патогенез ДПМЖ многогранны, сочетают хроническое повышение внутрибрюшного давления и врожденные анатомо-морфологические особенности строения (иногда трактуемые как «слабость») передней брюшной стенки. Разрешающим фактором развития ДПМЖ является повышение внутрибрюшного давления, в этом состоит его общность с грыжеобразованием. Однако при формировании ДПМЖ на первый план выходит длительность воздействия фактора, а не одномоментное производящее чрезмерное воздействие, что нередко наблюдается при истинных грыжах. Кроме того, при ДПМЖ отсутствует патоморфологический субстрат в виде грыжевых ворот и грыжевого мешка. Наиболее значимыми факторами риска ДПМЖ являются беременность, патологическое ожирение, хронические обструктивные болезни легких (ХОБЛ), склонность к запорам, ишурия, длительный прием кортикостероидов, антиагрегантов, иммуносупрессоров, тяжелый физический труд. Усугубляют воздействие чрезмерного внутрибрюшного давления различные виды дисплазии соединительной ткани, детренированность мышц брюшного пресса, нарушения иннервации.
ДПМЖ встречается как у мужчин (27,9%), так и у женщин (72,1%), преимущественно в возрасте 25—55 лет [1]. Однако в связи с большей заинтересованностью в форме передней брюшной стенки женщин после беременности развитие ДПМЖ наиболее изучено в этой группе пациентов. ДПМЖ в различные сроки после беременности диагностируют в 24—70% случаев. J. Sperstad и соавт. [2] обнаружили диастаз у 1/3 женщин через 1 год после родов. Многоплодные, многоводные, повторные беременности увеличивают риск развития диастаза. Кроме повышения внутрибрюшного давления, во время беременности происходит следующее:
— изменение гормонального и ферментативного статусов, призванное увеличить способность тканей к растяжению;
— увеличение наклона таза вперед;
Эти изменения усугубляют состояние передней брюшной стенки и провоцируют развитие ДПМЖ [3—6]. В Российской Федерации многоплодные беременности встречаются в 1,5—2,5% наблюдений. В последние 15—20 лет наблюдается тенденция к увеличению их распространенности, что связано в первую очередь с внедрением вспомогательных репродуктивных технологий [7]. Доля беременностей, сопровождаемых многоводием, составляет от 6 до 9,8%, и также имеется тенденция к ее увеличению [8].
По данным Глобальной инициативы по ХОБЛ (GOLD) и ВОЗ, глобальная распространенность ХОБЛ составляет 8,4—15%. Аналогична ситуация с бронхиальной астмой: по данным Глобальной инициативы по лечению и профилактике бронхиальной астмы (GINA), число страдающих бронхиальной астмой людей, сохраняется на уровне около 300 млн уже в течение более 10 лет.
Синдром раздраженной толстой кишки встречается в среднем у 20% популяции, а его распространенность варьирует от 9 до 48%. Синдром раздраженной толстой кишки с преобладанием обстипации встречается в 40% случаев [9].
Распространенность патологического ожирения выросла на 55,6% у мужчин и 45,3% у женщин с 1992 по 2002 г., по данным Всемирной федерации сахарного диабета. У больных патологическим ожирением, помимо повышения внутрибрюшного давления (увеличение объема висцерального жира, гепато-, гастромегалия), гипертрофированный кожно-жировой «фартук» постоянно тянет переднюю брюшную стенку вниз. Все это служит значительным фактором риска развития ДПМЖ [10].
Хроническая ишурия, связанная с механическим препятствием или нейрогенного характера, также является фактором, способствующим развитию ДПМЖ. Наиболее часто ишурия встречается при аденоме простаты, и ее распространенность, по данным национальных и международных урологических ассоциаций, составляет 60% в возрасте 60 лет [11].
Тяжелый, неадекватно организованный физический труд также считается некоторыми авторами причиной патологической деформации передней брюшной стенки. Особое место занимают тяжелые физические нагрузки в детском и юношеском возрасте, приходящиеся на недостаточно окрепшую переднюю брюшную стенку [12, 13].
В то же время D. Brauman [14] полагает, что ДПМЖ нельзя считать проявлением хронически повышенного внутрибрюшного давления. В своей значительно более современной работе он выяснил, что ширина ДПМЖ у большинства пациентов колеблется в пределах 2,5—5,0 см и лишь у 2% превышает 6 см. Причем выраженность диастаза не была связана с количеством внутрибрюшного жира и не определяла общую растянутость брюшной стенки.
Дисплазия соединительной ткани — врожденное или приобретенное изменение ее структуры, связанное с уменьшением содержания отдельных фракций коллагена или изменением их соотношения, что проявляется понижением прочности и повышением растяжимости ткани. Генетически и клинически наиболее обоснованно разделять врожденные дисплазии на две группы: дифференцированные (ДДСТ) и недифференцированные (НДСТ). Самыми распространенными представителями первой группы являются синдромы Марфана и Элерса—Данло. Эти заболевания проявляются довольно четко очерченным, постоянным симптомокомплексом и имеют прослеживаемый тип наследования. ДДСТ встречаются редко — от 1:5000 до 1:560 000 — и не имеют большого клинического значения как причина ДПМЖ [15, 16].
Существуют различные критерии диагностики НДСТ, но фенотип данных пациентов сходен. Основными признаками НДСТ являются гипермобильность суставов, кифосколиоз, плоскостопие, гиперэластичность кожи, пролапс митрального клапана, варикозная болезнь вен нижних конечностей, геморрой, грыжи. Данные о распространенности НДСТ противоречивы. Исследователи, основывающиеся на выделении отдельных симптомов, сообщают о распространенности от 8—9 до 26—86% [17, 18]. При диагностике НДСТ по комплексу симптомов распространенность оказывается равной 20—25%, но при этом возрастает клиническая значимость выявленных аномалий [19]. Этот синдром имеет бесспорную наследственную природу, но полигенную основу. При НДСТ определяются изменения в генах, кодирующих пространственную организацию коллагена, соотношение его фракций, структурных белково-углеводных комплексов, ферментов [20, 21]. Проявления НДСТ полисистемны, соответственно патологические изменения происходят и в миофасциальных структурах, что проявляется гипотрофией мышц и ДПМЖ. А.В. Федосеев и А.А. Чекушин [22] продемонстрировали прямую связь между склонностью к грыжеобразованию и НДСТ. С учетом практически аналогичных этиологии и патогенеза грыж и ДПМЖ данные можно смело экстраполировать.
Фактором риска развития приобретенной дисплазии соединительной ткани является курение, в которое в Российской Федерации, по данным ВОЗ, вовлечены 22,8% женского и 59% мужского населения. Продукты горения табачных изделий активируют металлопротеиназы соединительной ткани, действие которых приводит к изменению соотношений в ней фракций коллагена в пользу более растяжимых [23].
В патогенезе ДПМЖ необходимо отметить следующие основные звенья. Первым этапом развивается дисбаланс между факторами агрессии (повышение внутрибрюшного давления) и защиты (тонус, эластичность передней брюшной стенки). Поскольку белая линия — не мышечная структура и не может оказывать активного сопротивления постоянно воздействующим на нее факторам растяжения, то данную функцию берут на себя прямые мышцы живота вместе с их фасциальными футлярами. Когда факторы агрессии начинают преобладать, происходит миофасциальная деформация — растяжение апоневротических структур. Это изменение анатомии вносит дисбаланс в работу мышечно-апоневротического аппарата передней брюшной стенки. Мышцы, работа которых в норме должна гармонично сочетаться, начинают противостоять друг другу. При слабости поперечной мышцы косые мышцы растягивают в стороны прямые с их влагалищами, а также белую линию. Это приводит к латеральной дислокации прямых мышц живота. Переходя в биомеханически невыгодную позицию, мышцы растягиваются по длине и ширине. Потеря функционально выгодного положения влечет за собой снижение тонуса мышц, вплоть до полной неспособности выполнения каркасной функции и атрофии. Затем в связи с дисфункцией мускулатуры нагрузка перераспределяется и в большей степени направляется на апоневротические структуры, опять же на белую линию. Растяжение белой линии увеличивается, расхождение мышц усугубляется. Таким образом, замыкается порочный круг. Следующим этапом является патологическое распределение нагрузки на мышцы спины, позвоночный столб. Развивается гипертонус разгибателя позвоночника, усугубляется поясничный лордоз. Как следствие, возможно появление болевого синдрома (люмбалгия). При значительных диастазах развиваются функциональные ограничения: невозможность поднять тяжести, ограничение подвижности в поясничном отделе позвоночника, вынужденное положение из-за болевого синдрома. Соответственно клиническая картина будет значительно варьировать в зависимости от тяжести миофасциальной деформации, начиная с незначительного косметического дискомфорта и заканчивая возможным снижением трудоспособности [24, 25].
Таким образом, реальная распространенность ДПМЖ довольно высока. Но клиническая значимость и соответственно потребность в лечении этого состояния не определены. С одной стороны, диастазы нередко сочетаются с пупочными и эпигастральными грыжами, имеющими свои риски. Выраженный диастаз значительно нарушает функции брюшной стенки и торса в целом. С другой стороны, особенно у женщин молодого возраста, доля которых среди пациентов с ДПМЖ высока, формулируются косметические показания к его коррекции. Эффективные консервативные методы исправления сформировавшихся ДПМЖ пока отсутствуют. Хирургическое же лечение должно предлагать хорошие функциональный и косметический результаты.
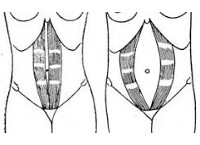
Наиболее известным признаком ДПМЖ является килевидное выпячивание в проекции белой линии живота при напряжении мышц передней брюшной стенки. Для оценки данного симптома необходимо попросить пациента в положении лежа на спине приподнять голову и верхнюю часть туловища. Для общей практики это самый простой и удобный способ, его даже можно назвать скрининговым, но он не позволяет выявить компенсированные формы ДПМЖ, т. е. при минимальной степени диастаза и/или выраженной тренированности мышц передней брюшной стенки будет получен ложноотрицательный результат. Это имеет большое значение при наличии у пациента сопутствующего грыжевого выпячивания, так как нераспознание ДПМЖ в данном случае ведет к выбору неправильной хирургической тактики. Кроме того, полезна проверка возможности втянуть выпячивание — с прогрессированием заболевания данная способность утрачивается. Другим симптомом ДПМЖ является увеличение расстояния между прямыми мышцами в расслабленном состоянии. Этот признак наиболее важен для постановки правильного диагноза, но его выявление часто затруднительно, особенно у тучных больных. Объективное измерение расстояния между прямыми мышцами живота возможно только при помощи средств инструментальной диагностики (ультразвуковое исследование — УЗИ, мультиспиральная компьютерная томография — МСКТ, магнитно-резонансная томография — МРТ). Для того чтобы определить, какую белую линию можно считать несостоятельной, «больной», необходимо перейти к вопросу классификации ДПМЖ.
Для объективизации оценки ДПМЖ существует несколько классификаций: по этиологии, локализации и степени диастаза. F. Nahas [26] описал варианты миоапоневротических деформаций брюшной стенки для целей абдоминопластики (табл. 1). 
При создании данной классификации автор преследовали цель выработать универсальную систему выбора оперативного пособия для каждого типа недостаточности брюшной стенки. Однако клиническая практика показала, что этиология и патогенез не являются определяющими факторами в выборе метода лечения.
Зарубежные пластические хирурги большее внимание уделяют локализации диастаза. Это связано с тем, что для выбора варианта абдоминопластики важна протяженность ДПМЖ. Классификация A. Rath и соавт. [27] основана на зависимости ширины белой линии от возраста и локализации (табл. 2). 
Данная классификация основана на исследовании трупного материала. В результате получены пограничные значения нормальной ширины белой линии. Следуя этой концепции, все, что превышает данные значения, является патологическим расширением белой линии.
Классификация G. Beer и соавт. [28] также основана на нормальной ширине белой линии в расслаб-ленном состоянии пациента (табл. 3). 
Авторы проводили исследование группы из 150 нерожавших женщин, и это наиболее крупное исследование нормальной клинической анатомии данной области. Эта классификация более применима на практике, чем предыдущие, но не позволяет ранжировать пациентов с ДПМЖ.
Отечественные хирурги также занимались этим вопросом. Наиболее удобной для практического применения нам представляется классификация Р. Аскерханова [29], основанная на измерении расстоя-ния между прямыми мышцами живота в расслабленном состоянии (табл. 4). 
Она позволяет объективно разделить пациентов на группы, проста и удобна в постановке диагноза у постели больного. Как и у любой строгой классификации, у нее есть недостатки в оценке индивидуальной клинической картины. В данном контексте имеет смысл упомянуть описательную классификацию ДПМЖ, предложенную Б.А. Барковым [30] (табл. 5). 
В клинической практике классификация Б.А. Баркова, вероятно, наиболее удобна, но для получения объективных данных и дальнейшего их статистического анализа сомнительна.
Таким образом, нет единого мнения и четких рекомендаций о том, что конкретно называть ДПМЖ. Ясна общая тенденция, опирающаяся на патофизио-логию и субъективные ощущения пациента: ДПМЖ — состояние, при котором растяжение и истончение белой линии живота причиняют косметический и/или функциональный дискомфорт.
Для точной диагностики ДПМЖ необходимо применение инструментальных методов, задача которых — визуализация передней брюшной стенки в аксиальной плоскости. В этом качестве можно использовать УЗИ, МСКТ, МРТ. Оптимальным в экономическом и клиническом аспектах является УЗИ. При помощи линейного датчика в В-режиме производится измерение расстояния между медиальными краями прямых мышц в расслабленном состоянии на 3 см выше пупочного кольца. Помимо этого, можно оценить состояние самой мускулатуры. Нормальная толщина прямых мышц живота 10—11,2 мм. Возможна также сопутствующая оценка других слабых мест передней брюшной стенки: пупочного кольца, спигелиевой линии, пахового промежутка. Применение МСКТ и МРТ позволяет максимально объективно оценить состояние передней брюшной стенки, исключив зависимость от специалиста, проводящего исследование, свойственную УЗИ. Однако оба метода дорогостоящие, могут сопровождаться субъективным дискомфортом у пациентов (замкнутое пространство, интенсивный шум, длительное неподвижное положение), немобильны. Поэтому их используют при сочетании ДПМЖ с первичными срединными грыжами (ПСГ), особенно больших размеров.
Взаимосвязь ДПМЖ и ПСГ передней брюшной стенки
Изучая связь ПСГ и ДПМЖ, следует обратиться к анатомическим особенностям строения белой линии живота. Уже в работах анатома начала XX века А.А. Дешина на первое место ставился вопрос о врожденных особенностях формирования белой линии. Он выделял 2 типа белой линии: 1) сухожильные волокна, образующие белую линию, плотно прилегают друг к другу и образуют гладкую структуру; 2) волокна не прилегают плотно друг к другу и образуют различной величины промежутки.
В ряде работ подробно разобрано морфологическое строение белой линии живота и выявлены предпосылки к образованию ДПМЖ и ПСГ на том или ином уровне [31—33]. Белая линия представлена соединительнотканными волокнами перитенония, которые в эпигастральной области ориентированы более в поперечном направлении, реже переплетаются между собой в продольном направлении. В этой области коллагеновые волокна значительно преобладают над эластическими. Пучки коллагеновых волокон расположены слоями и идут параллельно, разветвляясь и связывая между собой слои и аналогичные структуры с противоположной стороны. Причем глубокие пучки с одной стороны переходят в поверхностные с другой. В мезогастральной области также преобладают коллагеновые волокна, но в отличие от эпигастрального уровня они расположены вдоль белой линии. Данная область наиболее анатомически слабая, что связано с ее наименьшей толщиной и мембранозным строением, а также с наличием артерий-перфорантов, наиболее выраженных в околопупочной области. В гипогастральной области количество коллагеновых и эластических волокон уменьшается, коллагеновые волокна сокращаются в диаметре, расположены более поперечно, чем продольно, а интервалы между ними сокращаются [34].
К.Д. Тоскин [35] постулирует, что первичным в возникновении грыж белой линии живота является ее расширение. Как следствие деформации (растяжения) белой линии в ней образуются «анатомические неустройства в виде ромбовидных щелей». Дальнейший патогенез грыжеобразования многократно описан: предбрюшинная липома, hernia epirastrica occulta (скрытая эпигастральная грыжа), истинная грыжа.
Если обратиться к клиническим данным, мы увидим аналогичную картину. У 45—60% пациентов с ДПМЖ, попадающих в поле зрения хирургов, выявляются ПСГ. При подтвержденном ДПМЖ изолированная ликвидация пупочной грыжи сопровождается рецидивами в более 30% случаев [23]. Соответственно грыжи белой линии и ДПМЖ следует рассматривать только комплексно, и приемлемым принципом лечения ДПМЖ и сопутствующей ПСГ может быть только их одномоментная ликвидация.
Для определения тактики лечения важно оценить размер грыжевого выпячивания. Существуют разные подходы к классификации грыж. European Hernia Society (EHS) предлагает систематизировать больных с грыжевыми выпячиваниями, основываясь на точном измерении грыжевого дефекта [36] (табл. 6). 
Классификация не учитывает объем грыжевого выпячивания, который может быть очень разным при одном и том же диаметре ворот. Это позволяет сделать классификация К.Д. Тоскина [35] (табл. 7). 
Таким образом, ПСГ часто возникают на фоне ДПМЖ. Данный факт определяет тактику оперативного лечения, а именно одномоментную ликвидацию срединной грыжи и ДПМЖ, что будет обсуждено в следующей публикации.
Авторы заявляют об отсутствии конфликта интересов.
The authors declare no conflicts of interest.