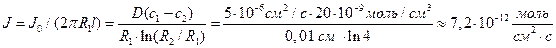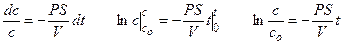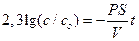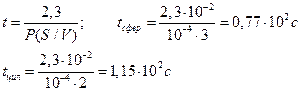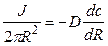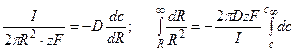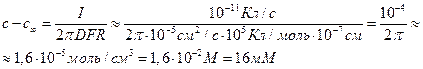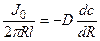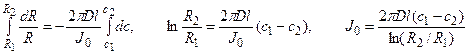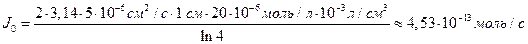концентрационный коэффициент каких ионов способствует диффузии
Концентрационный коэффициент каких ионов способствует диффузии
В разд. 69 мы упоминали, что единственной движущей силой как для диффузии, так и для миграции является градиент электрохимического потенциала компонентов. Поэтому можно ожидать, что подвижности и коэффициенты диффузии ионов связаны. Эта связь осуществляется уравнением Нернста-Эйнштейна
которое строго применимо лишь при бесконечном разбавлении, хотя его нарушение связано с приближенным характером уравнения потока (69-1). Величины 
С учетом соотношения Нернста-Эйнштейна выражение (72-6) для коэффициента диффузии бинарного электролита приобретает вид
Часто можно встретить утверждение о том, что солевой мостик, используемый для устранения потенциалов жидкостного соединения, должен содержать соль с одинаковыми числами переноса катиона и аниона (потенциалами жидкостного соединения являются диффузионные потенциалы, возникающие при соединении двух растворов электролитов разных составов, см. гл. 6). Это утверждение можно пояснить с помощью уравнения Нернста-Эйнштейна. Для раствора единственной солц числа переноса номинально не зависят от концентрации (благодаря электронейтральности) и даются уравнением (72-12). Из уравнения (75-1) имеем
Равенство чисел переноса в сочетании с уравнением Нернста—Эйнштейна предполагает, что для симметричного электролита 
изменять концентрацию, так чтобы не возникали диффузионные потенциалы [уравнение (72-8) или (70-7)] (мы по-прежнему не имеем удовлетворительного ответа на вопрос о том, что происходит в местах контактов солевого мостика с обоими растворами, которые мы пытались соединить).
С другой стороны, с помощью соотношения Нернста-Эйнштейна уравнение (70-7) теперь можно записать в виде
В табл. 75-1 даны значения коэффициентов диффузии и подвижностей ионов. В литературе обычно не удается найти непосредственно значения подвижностей ионов. Вместо них приводятся эквивалентные ионные проводимости, связанные с подвижностями ионов равенством
Отсюда с помощью соотношения Нернста-Эйнштейна можно вычислить коэффициенты диффузии ионов:
Из табл. 75-1 видно, что большинство коэффициентов диффузии ионов находится около 

Эквивалентная проводимость 
С проводимостью раствора величина 
Значение 








Число переноса иона в растворе бинарной соли равно
Это число близко к 0,5 для всех электролитов, кроме кислот и
оснований, где 
Таблица 75-1 (см. скан) Значения эквивалентных проводимостей и коэффициентов диффузии некоторых ионов в бесконечно разбавленных водных растворах при 25 °С
Эквивалентные ионные проводимости, как, например, те, что приведены в табл. 75-1, обычно определяются из измерений эквивалентной проводимости 



отдельности в растворах 
Температурная зависимость ионных коэффициентов диффузии приближенно выражается соотношением
где 
Концентрационный коэффициент каких ионов способствует диффузии
В разд. 69 мы упоминали, что единственной движущей силой как для диффузии, так и для миграции является градиент электрохимического потенциала компонентов. Поэтому можно ожидать, что подвижности и коэффициенты диффузии ионов связаны. Эта связь осуществляется уравнением Нернста—Эйнштейна
которое строго применимо лишь при бесконечном разбавлении, хотя его нарушение связано с приближенным характером уравнения потока (69-1). Величины 
С учетом соотношения Нернста—Эйнштейна выражение (72-6) для коэффициента диффузии бинарного электролита приобретает вид
Часто можно встретить утверждение о том, что солевой мостик, используемый для устранения потенциалов жидкостного соединения, должен содержать соль с одинаковыми числами переноса катиона и аниона (потенциалами жидкостного соединения являются диффузионные потенциалы, возникающие при соединении двух растворов электролитов разных составов, см. гл. 6). Это утверждение можно пояснить с помощью уравнения Нернста—Эйнштейна. Для раствора единственной соли, числа переноса номинально не зависят от концентрации (благодаря электронейтральности) и даются уравнением (72-12). Из уравнения (75-1) имеем
Равенство чисел переноса в сочетании с уравнением Нернста—Эйнштейна предполагает, что для симметричного электролита 
концентрацию, так чтобы не возникали диффузионные потенциалы [уравнение (72-8) или (70-7)] (мы по-прежнему не имеем удовлетворительного ответа на вопрос о том, что происходит в местах контактов солевого мостика с обоими растворами, которые мы пытались соединить).
С другой стороны, с помощью соотношения Нернста—Эйнштейна уравнение (70-7) теперь можно записать в виде
В табл. 75-1 даны значения коэффициентов диффузии и подвижностей ионов. В литературе обычно не удается найти непосредственно значения подвижностей ионов. Вместо них приводятся эквивалентные ионные проводимости, связанные с подвижностями ионов равенством
Отсюда с помощью соотношения Нернста—Эйнштейна можно вычислить коэффициенты диффузии ионов:
Из табл. 75-1 видно, что большинство коэффициентов диффузии ионов находится около 
Эквивалентная проводимость 
С проводимостью раствора величина 
Значение 








Число переноса иона в растворе бинарной соли равно
Это число близко к 0,5 для всех электролитов, кроме кислот и
оснований, где 
Таблица 75-1. Значения эквивалентных проводимостей и коэффициентов диффузии некоторых ионов в бесконечно разбавленных водных растворах при 25 °С (см.скан)
Эквивалентные ионные проводимости, как, например, те, что приведены в табл. 75-1, обычно определяются из измерений эквивалентной проводимости 



в растворах 
Температурная зависимость ионных коэффициентов диффузии приближенно выражается соотношением
где 
Диффузия ионов и неэлектролитов
Диффузия представляет собой спонтанное движение растворенного вещества в сторону понижения концентрации. Диффузионные законы определяют движение незаряженных веществ в объеме (на любых расстояниях при отсутствии конвекции), перенос ионов в неперемешиваемых слоях у поверхности мембран, а также движение ионов на малых расстояниях.
Формула Стокса–Эйнштейна связывает коэффициент диффузии D с температурой T, вязкостью среды η и радиусом диффундирующих частиц r (k – константа Больцмана). Например, вязкость воды при 20°С составляет ηH2O= 10 –3 Па∙с (1 Па = 1 Н/м 2 ).
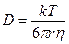
Пользуясь (4.1), можно оценить коэффициент диффузии в воде для малых молекул с радиусом
0,2 нм (10 –5 см 2 /с) или для молекул другого размера. На движение ионов в растворе влияет электрическое поле. Коэффициент диффузии иона зависит от его заряда (z):
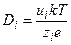
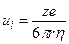
Подвижность численно равна скорости движения ионов (см/с) при напряженности поля 1 В/см.
Законы Фика описывают скорость диффузии вещества, а также пространственное распределение концентрации диффундирующего вещества в различные моменты времени.
Первый закон Фика связывает поток вещества J с коэффициентом диффузии D и градиентом концентрации (dc/dx). Размерность потока – моль∙см –2 ∙с –1 ).
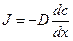
В случае диффузии через тонкую мембрану
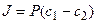
где P=Dg/h – проницаемость, h – толщина мембраны, g – коэффициент распределения вещества между водной и липидной фазами, а 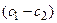
Второй закон Фика описывает направление изменений концентрации вещества во времени (dc/dt) в зависимости от знака второй производной (d 2 c/dx 2 ), определяющей вогнутость или выпуклость профиля концентрации по координате x:
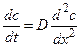
Из (4.6) в частности следует, что в случае одномерной стационарной диффузии (т.е. при dc/dt=0) профиль концентрации линеен: 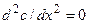
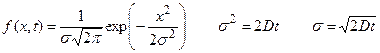
где x – координата, f(x,t) – функция распределения, σ – среднеквадратичное отклонение для нормального распределения вещества относительно исходной точки при x = 0, σ 2 – дисперсия, а t – время. Область, расположенная между координатами ±σ, содержит более 68% от общего количества диффундирующего вещества. Согласно уравнению Эйнштейна, величина σ, обозначаемая также 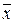
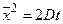
где 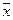
Пример 4.1. После инъекции в клетку некоторого вещества до концентрации co, клетку отмывают средой, не содержащей этого вещества. Какое время инкубации необходимо, чтобы внутренняя концентрация вещества понизилась в 10 раз, если проницаемость мембраны для этого вещества составляет 10 –4 см/с? Решить задачу для клетки сферической формы с диаметром 200 мкм и для цилиндрической клетки с диаметром 200 мкм и длиной 1 см.
Решение: При записи первого закона Фика учтем, что диффузия происходит через тонкую мембрану и, что концентрация во внешнем растворе равна нулю.
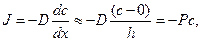
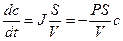
Решение этого дифференциального уравнения описывает кинетику изменения концентрации вещества внутри клетки:
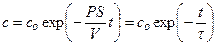
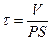
Уравнение решают методом разделения переменных и интегрирования по времени от нуля до t при соответствующем изменении концентрации от co до c.
Для ответа на вопрос задачи удобно перейти к десятичным логарифмам:
Отношение S/V определяется геометрией клетки. Для сферы и цилиндра оно составляет соответственно
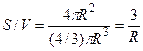
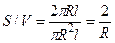
С учетом условия задачи c/co = 0,1 и R = 0,01 см, находим искомое время t:
Аналогичный подход используется для случаев, когда в момент времени t = 0 в наружный раствор добавляют проникающее вещество, которое начинает поступать внутрь клетки, причем наружная концентрация остается постоянной (co = const) из-за большого объема среды по сравнению с объемом клеток. В таком опыте моменту времени t = 0 соответствует внутренняя концентрация с = 0, а произвольному моменту времени t соответствует внутренняя концентрация с. В этом случае интегрирование дифференциального уравнения приводит к следующему решению:
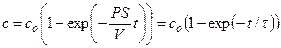
Пример 4.2. Предположим, что через калиевый канал с устьем R = 10 Å протекает ток I силой 10 пА (рис. 4.1.). При этом концентрация К + в устье повышается по сравнению с объемом раствора. Найти концентрацию в области устья канала, если концентрация К + в объеме составляет 10 мМ. При расчете принять, что коэффициент диффузии К + в воде
Решение: На выходе из канала суммарный поток переносимых ионов диффундирует во всех направлениях, ограничиваемых полусферой. Выделим элемент поверхности полусферы и запишем поток через единицу поверхности, пользуясь первым законом Фика.
Суммарный поток вещества J связан с электрическим током I соотношением 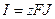
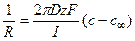
Следовательно, перепад концентрацией между устьем канала и объемом раствора составит
Соответственно, концентрация в устье канала cx составит 26 мМ.
Пример 4.3. Концентрация Са 2+ в питательном растворе на расстоянии 300 мкм от поверхности корня составляет 100 мкМ, а у поверхности корня с диаметром 200 мкм – 80 мкМ. Оценить диффузионный поток Са 2+ к поверхности корня на 1 см его длины (моль·с –1 ), а также поток Са 2+ на единицу поверхности корня (моль·см –2 ·с –1 ) в предположении, что коэффициент диффузии D = 5·10 –6 см 2 /с.
Решение: Обозначим суммарный диффузионный поток для сегмента корня длиной l символом J0. Поток Са 2+ направлен радиально из объема среды к центру корня. Поток через единичный участок цилиндрической поверхности неперемешиваемого слоя на расстоянии R от центра корня составит J0/(2πRl). Запишем уравнение первого закона Фика в радиальных координатах:
Решая уравнение, находим формулу для расчета потока по концентрациям на разном удалении от центра корня (концентрации с1 и с2 для радиальных расстояний R1 и R2).
В расчете на единицу поверхности корня поток составит