код по мкб м8140 3 что значит
Что такое аденокарцинома кишки? Причины возникновения, диагностику и методы лечения разберем в статье доктора Мешечкина В. Г., онколога со стажем в 8 лет.
Определение болезни. Причины заболевания
Аденокарцинома толстой кишки — это самая распространённая форма рака прямой кишки, опухоль развивается в толстой кишке и может метастазировать, как и большинство злокачественных новообразований.
Распространённость аденокарциномы толстой кишки
Факторы риска
Основной фактор риска аденокарциномы толстой кишки — возраст старше 65 лет. Риск развития аденокарциномы толстой кишки также возрастает при наличии некоторых наследственных синдромов:
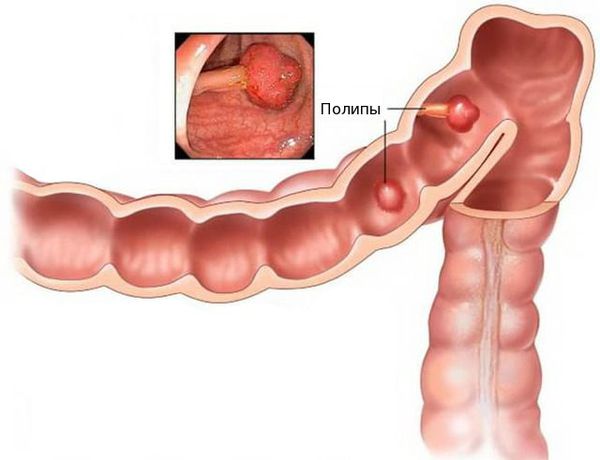
Благоприятным фоном для злокачественного перерождения клеток являются единичные или множественные полипы толстой кишки. Высокий риск перерождения в раковую опухоль имеют аденоматозные полипы. Отказ от их удаления может привести к развитию аденокарциномы.
Хронические воспалительные заболевания толстой кишки, такие как неспецифический язвенный колит и болезнь Крона, также повышают риск развития аденокарциномы.
К дополнительным факторам риска относят:
Симптомы аденокарциномы кишки
Клинические проявления аденокарциномы толстой кишки зависят от расположения опухоли, её типа, темпа роста и наличия сопутствующей патологии. Ранние формы рака являются случайной находкой, так как могут никак себя не проявлять. Их выявляют при эндоскопическом исследовании кишечника по поводу других заболеваний (например, колита, дивертикулита, холецистита, гастрита и др.) или при полостных или гинекологических операциях — аппендэктомии, миомэктомии и кесаревом сечении.
Наиболее частые симптомы аденокарциномы толстой кишки:
Опухоли левого фланка (сигмовидной и прямой кишки, селезёночного угла, нисходящего отдела) чаще манифестируют с запоров, примеси прозрачной или розоватой слизи и тёмной крови в кале, болезненных позывов, отдающих в промежность.
Поиск причины анемии невыясненной этиологии часто приводит к обнаружению рака правой половины толстой кишки.
Патогенез аденокарциномы кишки
Аденокарцинома — это злокачественная опухоль, возникающая из железистых клеток и способная образовывать метастазы (вторичные очаги опухолевого роста). Чаще всего заболевание развивается на фоне длительно существующих полипов, или разрастаний слизистой.
При хроническом повреждении полипов плотными каловыми массами и воспалении развивается дисплазия эпителия (нарушение деления и дифференцировки клеток), переходящая в рак. У кого-то этот процесс может занять десятки лет, у других развивается за два-три года.
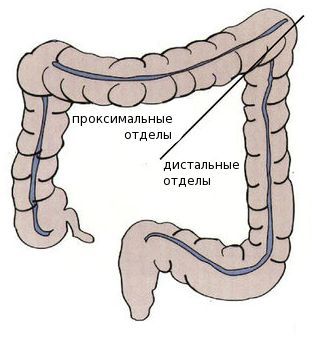
Среди пациентов с раком проксимальных отделов толстой кишки преобладают женщины — вероятно, это связано с наличием гормональных рецепторов эстрогенов в этих отделах. Дистальный рак толстой кишки более характерен для мужчин.
Классификация и стадии развития аденокарциномы кишки
Виды аденокарциномы толстой кишки в зависимости от локализации:
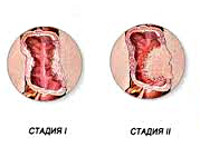
Согласно последней классификации ВОЗ, гистологически выделяют две степени злокачественности аденокарциномы толстой кишки, опираясь на долю железистых структур в составе опухоли: высокую и низкую.
Стадирование новообразований толстой кишки по системе TNM-8 (2017 г.) представлено схемой:
Исходя из этих данных, опухоли присваивают определенную стадию, и далее она уже не меняется. Дальнейшее распространение процесса обозначается как прогрессирование.
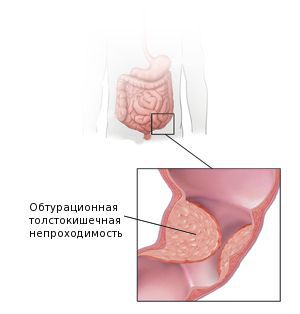
Осложнения аденокарциномы кишки
Также среди частых причин осложнений выделяют перфорацию и кровотечение из повреждённой опухоли. Это может явиться первым симптомом заболевания. Часто таких пациентов экстренно оперируют в условиях многопрофильного стационара, а не специализированного учреждения, и только при обследовании органов брюшной полости становится понятна причина перфорации.
Диагностика аденокарциномы кишки
Сбор анамнеза
Помимо описанных выше жалоб, с которыми первично обращаются пациенты, важны данные анамнеза. На первичном осмотре терапевту или онкологу следует отметить наличие наследственных синдромов, ассоциированных с раком толстой кишки, и хронических неспецифических воспалительных процессов толстой кишки, например неспецифического язвенного колита или болезни Крона.
Физикальное обследование
При физикальном обследовании, помимо общего осмотра и пальпации брюшной полости, обязательно проведение ректального пальцевого исследования, выявляющего изменения в области прямой кишки. Это один из самых простых диагностических приёмов, не требующий дополнительной подготовки и оборудования.
Лабораторная диагностика
Лабораторная диагностика включает:
Это анализы необходимы для исключения возможной сопутствующей патологии.
Биопсия
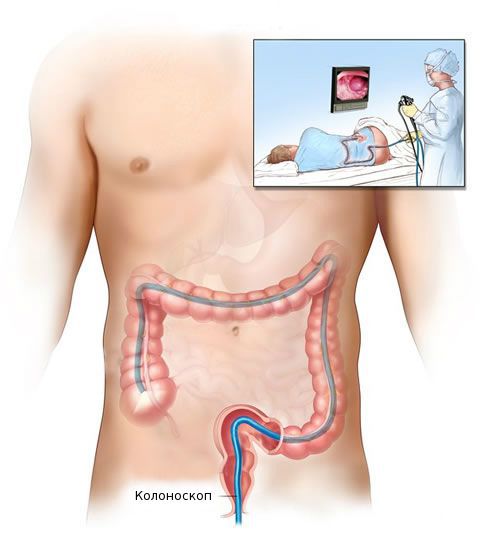
После общеклинического обследования проводят уточняющее исследование (биопсию) для определения гистологической структуры опухоли. Чаще всего биопсия выполняется во время колоноскопии — процедуры, при которой врач с помощи эндоскопа осматривает внутреннюю поверхность толстой кишки.
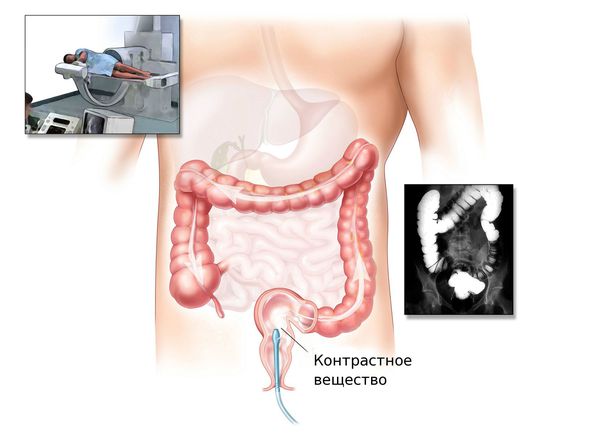
Ирригоскопия и КТ-колонография
При невозможности проведения колоноскопии врач может назначить ирригоскопию или КТ-колонографию.
Ирригоскопия — это рентгенологический метод обследования толстого кишечника с помощью контрастного вещества, вводимого через прямую кишку.
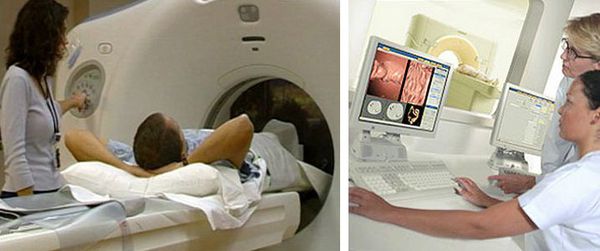
КТ-колонография — разновидность компьютерной томографии, проводимая при помощи компьютерного томографа.
Компьютерная томография (КТ)
КТ органов грудной клетки и брюшной полости с контрастом — стандарт обследования при раке ободочной кишки. Компьютерную томографию проводят для исключения метастазов в лёгких, лимфоузлах средостения, брюшной полости, канцероматоза (переноса раковых клеток из первичного очага), асцита (скопления жидкости в брюшной полости) и вторичного поражения печени.
Магнитно-резонансная томография (МРТ)
МРТ органов брюшной полости с внутривенным контрастированием применяют для планирования операции на печени при её вторичном поражении.
Для точной оценки размеров опухоли перед операцией и правильного стадирования по TNM проводится МРТ малого таза c применением контраста.
Дополнительно, при наличии болевого синдрома или изменений по КТ, проводится остеосцинтиграфия (ОСГ) — исследование состояния костей скелета.
При подозрении на вторичное поражение головного мозга (исходя из жалоб, осмотра и анамнеза) назначается МРТ головного мозга с внутривенным контрастированием.
Позитронно-эмиссионная томография, совмещённая с компьютерной томографией (ПЭТ/КТ)
ПЭТ-КТ не применяется как рутинный метод при первичной диагностике. Обследование проводят при подозрении на вторичные изменения по данным КТ или МРТ для получения дополнительных данных.
Лечение аденокарциномы кишки
Выбор метода лечения аденокарциномы толстой кишки обусловлен стадией онкологического процесса и наличием или отсутствием соматической патологии.
0-I стадия
На ранних стадиях рака ободочной кишки проводятся органосохраняющие операции, например эндоскопическую резекцию слизистой с удалением в подслизистом слое. При поражении краёв резекции, сосудистой, лимфатической или периневральной инвазии (проникновении раковых клеток в периневрий — слои соединительной ткани, образующие оболочку вокруг пучков нервных волокон), как факторах неблагоприятного прогноза, рекомендуется проведение расширенной операции — повторной резекции краёв.
II–III стадия
При резектабельном (c возможностью удаления) локализованном и местнораспространённом раке ободочной кишки II–III стадий на первом этапе предпочтительно оперативное лечение. Объём хирургического вмешательства определяется индивидуально.
Химиотерапия проводится при поражении лимфатических узлов, прорастании опухолью серозной оболочки и соседних органов, наличии факторов риска.
При распространённом раке ободочной кишки с резектабельными или потенциально резектабельными синхронными метастазами в печени или лёгких выполняют R0-резекцию (в пределах здоровых тканей).
Радиочастотная абляция и стереотаксическая лучевая терапия применяются как дополнительные методы к резекции печени и как самостоятельные методы лечения. Действие радиочастотной абляции основано на нагревании с помощью радиоволн поражённых тканей до высоких температур (90–100 °С).
Стереотаксическая лучевая терапия — это один из видов радиохирургии, который состоит в применении высокоточного излучения, воздействующего на опухоли.
При резектабельных очагах рекомендуется их одномоментное хирургическое удаление.
На послеоперационном этапе при резектабельных метастатических очагах показано проведение адъювантной (следующей за операцией) химиотерапии. Также возможно проведение дооперационной химиотерапии до шести циклов, удаление метастазов и первичной опухоли с дальнейшим продолжением химиотерапии до достижения шестимесячной суммарной продолжительности лечения.
IV стадия
Основная цель лечения на IV стадии заболевания — перевод при помощи химиотерапии нерезектабельных метастазов в резектабельные. Хороший эффект даёт добавление к основному лечению таргетной терапии ( целенаправленно воздействующей на специфические мишени в опухолевых клетках) и иммунотерапии.
При проведении нерадикальной резекции возможно продолжение терапии предоперационной комбинацией химиопрепаратов и моноклональных антител (препаратов, избирательно воздействующих на определённую молекулу, от которой зависит развитие болезни ) до достижения суммарной шестимесячной продолжительности лечения.
При генерализованном раке ободочной кишки с нерезектабельными метастазами применяют комбинацию химиопрепаратов. Возможно добавление таргетных препаратов. Цель лечения — максимально долго контролировать развитие заболевания при сохранении качества жизни.
При проведении химиотерапии каждые 1,5-2 месяца оценивают резектабельность опухоли (по данным КТ, МРТ). При преобладании метастатического поражения печени проводят:
Прогноз. Профилактика
Меры профилактики:
Аденокарцинома толстой кишки
Аденокарцинома толстой кишки – это злокачественное новообразование, развивающееся из клеток железистого эпителия. На ранних стадиях протекает со стертой клинической симптоматикой. При прогрессировании наблюдаются слабость, боли в животе, ощущение неполного опорожнение кишечника, нарушения стула, тенезмы, отсутствие аппетита, снижение веса, повышение температуры до субфебрильных цифр, слизь и кровь в кале. Возможна кишечная непроходимость. Диагноз устанавливают на основании жалоб, данных объективного осмотра и результатов инструментальных исследований. Лечение – хирургическое удаление опухоли.
МКБ-10
Общие сведения
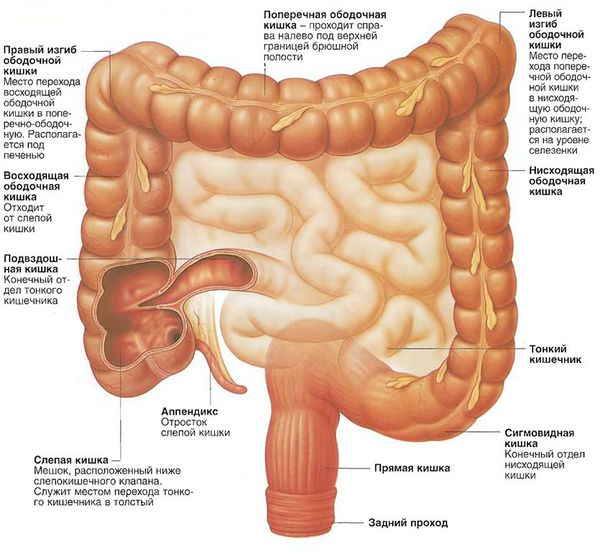
Аденокарцинома толстой кишки – рак, развивающийся из эпителиальных клеток. Составляет около 80% от общего количества злокачественных опухолей толстого кишечника. В 40% случаев поражает слепую кишку. Занимает четвертое место по распространенности среди онкологических заболеваний у женщин и третье – у мужчин, уступая только раку желудка, легкого и молочной железы. Чаще возникает в возрасте после 50 лет.
Вероятность возникновения аденокарциномы увеличивается при различных состояниях и заболеваниях, сопровождающихся нарушением перистальтики и ухудшением кровоснабжения толстого кишечника. На начальных стадиях болезнь обычно протекает бессимптомно или с неярко выраженной неспецифической клинической симптоматикой, что затрудняет диагностику и снижает процент выживаемости. Лечение осуществляют специалисты в области онкологии.
Причины
Предполагают, что аденокарцинома толстой кишки развивается в результате сочетания нескольких неблагоприятных факторов, основными из которых являются соматические заболевания, особенности диеты, некоторые параметры внешней среды и неблагоприятная наследственность. Повышенная вероятность возникновения злокачественных опухолей отмечается при полипах толстой кишки. В число соматических заболеваний, провоцирующих аденокарциному, включают язвенный колит, болезнь Крона, а также патологии, сопровождающиеся хроническими запорами и отложением каловых камней.
Многие исследователи указывают на важность диетических факторов. Вероятность возникновения аденокарциномы толстой кишки возрастает при недостатке в пище растительной клетчатки и употреблении большого количества мясных продуктов. Ученые считают, что растительная клетчатка увеличивает объем каловых масс и ускоряет их продвижение по кишечнику, ограничивая контакт кишечной стенки с канцерогенами, образующимися при расщеплении жирных кислот. Эта теория очень близка к теории развития аденокарциномы под влиянием канцерогенов, появляющихся в пище при неправильной термической обработке продуктов.
К факторам внешней среды относят слишком активное использование средств бытовой химии, профессиональные вредности, сидячую работу и малоподвижный образ жизни. Аденокарцинома толстой кишки нередко возникает при наследственно обусловленном семейном раковом синдроме (после 50 лет заболевает каждый третий носитель гена), при наличии злокачественных новообразований у близких родственников и при некоторых неонкологических наследственных заболеваниях (например, синдроме Гарднера).
Патогенез
Опухоль развивается по общим законам роста и распространения злокачественных новообразований. Для нее характерны тканевый и клеточный атипизм, снижение уровня дифференцировки клеток, прогрессия, неограниченный рост и относительная автономность. Вместе с тем, аденокарцинома толстой кишки имеет свои особенности. Она растет и развивается не так быстро, как некоторые другие злокачественные опухоли, и долго остается в пределах кишки.
Развитие новообразования часто сопровождается воспалением, распространяющимся на расположенные рядом органы и ткани. Раковые клетки проникают в эти органы и ткани, образуя близлежащие метастазы, при этом отдаленное метастазирование может отсутствовать. Неоплазия чаще всего метастазирует в печень и лимфатические узлы, хотя возможна и другая локализация отдаленных метастазов. Еще одной особенностью заболевания является частое одновременное либо последовательное образование нескольких опухолей в толстом кишечнике.
Классификация
С учетом уровня дифференцировки клеток различают три вида аденокарциномы толстой кишки: высокодифференцированная, умеренно дифференцированная и низкодифференцированная. Чем ниже уровень дифференцировки клеток – тем агрессивнее рост опухоли и тем выше склонность к раннему метастазированию. Для оценки прогноза при аденокарциноме толстой кишки врачи-онкологи используют международную классификацию TNM и традиционную российскую четырехстадийную классификацию. Согласно российской классификации:
Симптомы аденокарциномы
На ранних стадиях аденокарцинома толстой кишки протекает малосимптомно. Поскольку патология часто развивается на фоне хронических заболеваний кишечника, больные могут трактовать симптомы, как очередное обострение. Возможны нарушения стула, общая слабость, периодические боли в животе, ухудшение аппетита, появление примесей слизи или крови в каловых массах. При поражении нижних отделов толстого кишечника кровь алая, находится преимущественно на поверхности фекальных масс.
При расположении аденокарциномы в левой половине кишечника кровь темная, смешанная со слизью и каловыми массами. При локализации новообразования в правой половине кишечника кровотечения нередко носят скрытый характер. По мере роста опухоли симптомы становятся более яркими. Пациентов с аденокарциномой толстой кишки беспокоят интенсивные боли. Развивается выраженная утомляемость. Наблюдаются анемия, повышение температуры до субфебрильных цифр и отвращение к мясной пище.
Поносы и запоры становятся постоянными, не проходят при использовании лекарственных препаратов. Аденокарцинома толстой кишки создает механическое препятствие движению каловых масс и вызывает частые тенезмы. Давление кала на опухоль становится причиной ее изъязвления, а образование язв приводит к учащению кровотечений и развитию воспаления. В кале появляется гной. Температура поднимается до фебрильных цифр. Обнаруживаются признаки общей интоксикации.
У многих больных наблюдаются желтушность кожи и иктеричность склер. При распространении воспалительного процесса на забрюшинную клетчатку возникают боли и напряжение мышц в поясничной области. Возможна кишечная непроходимость (особенно – при аденокарциномах с экзофитным ростом). На поздних стадиях выявляются асцит и увеличение печени. Иногда абдоминальные симптомы отсутствуют, опухоль долго проявляется только слабостью, повышенной утомляемостью, снижением веса и ухудшением аппетита.
Диагностика
Диагноз аденокарциномы толстой кишки устанавливают специалисты в сфере клинической онкологии на основании жалоб, анамнеза, данных общего осмотра и пальцевого исследования прямой кишки и результатов инструментальных исследований. Более половины опухолей располагаются в нижних отделах толстого кишечника и выявляются при проведении пальцевого исследования или ректороманоскопии. При высокой локализации новообразования необходима колоноскопия. В процессе эндоскопии врач берет образец опухолевой ткани для последующего гистологического исследования, позволяющего верифицировать опухоль.
Для оценки размеров, формы и распространенности аденокарциномы используют рентгенконтрастное исследование толстого кишечника (ирригоскопию). Для выявления метастазов и при наличии противопоказаний к проведению эндоскопических исследований, например, при кровотечении, применяют ультразвуковые методики. В сложных случаях больного с подозрением на аденокарциному толстой кишки направляют на МСКТ брюшной полости. Пациенту назначают общие анализы крови и мочи, биохимический анализ крови и анализ кала на скрытую кровь. Окончательный диагноз выставляют после изучения биоптата.
Лечение аденокарциномы толстой кишки
Лечение неоплазии оперативное. Важным элементом лечения является предоперационная подготовка, позволяющая обеспечить возможность восстановления непрерывности толстого кишечника и минимизировать количество осложнений. Пациенту назначают бесшлаковую диету и слабительные средства. За несколько дней до операции начинают выполнять очистительные клизмы. В последние годы часто применяют промывание ЖКТ с использованием специальных препаратов.
Объем радикального хирургического вмешательства при аденокарциноме определяют с учетом размера и расположения злокачественного новообразования, наличия или отсутствия регионарных метастазов:
При отдаленных метастазах также проводят паллиативные хирургические вмешательства для профилактики осложнений (кровотечения, кишечной непроходимости, интенсивного болевого синдрома).
Прогноз и профилактика
При выявлении аденокарциномы толстой кишки на 1 стадии пятилетняя выживаемость составляет около 90%. Если лечение начинают на 2 стадии, пятилетний порог выживаемости преодолевают 80% больных. На 3 стадии выживаемость снижается до 50-60%. При поражении прямой кишки прогноз ухудшается.
После операции больных помещают под наблюдение, рекомендуют регулярно осматривать кал на наличие крови и слизи. Ежеквартально проводят ректороманоскопию или колоноскопию. Раз в 6 месяцев пациентов направляют на УЗИ внутренних органов для выявления отдаленных метастазов. Около 85% рецидивов аденокарциномы толстой кишки возникают в первые два года после оперативного вмешательства.
Рак желудка
МКБ 10: C16
Год утверждения (частота пересмотра): 2018 (пересмотр каждые 3 года)
Профессиональные ассоциации
Ассоциация онкологов России
Российское общество клинической онкологии
Ключевые слова
Список сокращений
КТ – компьютерная томография
D0-3 – объем лимфодиссекции
Термины и определения
Безрецидивная выживаемость (БРВ) – интервал от начала лечения до прогрессирования или смерти от любой причины. Бессобытийная выживаемость (БСВ) – интервал от начала лечения до момента прекращения ремиссии независимо от причины, приведшей к ней.
Гастрэктомия – удаление желудка с прилежащей клетчаткой и лимфатическими узлами
Общая выживаемость (ОВ) – интервал от начала лечения до смерти больного от любой причины.
Полная ремиссия (ПР) — отсутствие признаков опухолевого роста в течение 4 нед. после достижения полного эффекта
Полный эффект (ПЭ) — отсутствие признаков опухоли по данным лабораторных и инструментальных методов обследования.
Прогрессирование – появление нового опухолевого очага и/или рост первичного опухолевого очага, метастатических очагов чем, на 20%.
Частичная ремиссия (ЧР) – сокращение сумм максимальных размеров опухолевых очагов более чем на 30% при отсутствии появления новых.
1. Краткая информация
1.1 Определение
Рак желудка – злокачественная опухоль, исходящая из слизистой оболочки желудка.
1.2 Этиология и патогенез
Этиология заболевания окончательно не ясна. Отмечается географическая гетерогенность заболеваемости с максимальным уровнем в Японии, России, Чили, Корее, Китае, минимальным – США, Австралии, Новой Зеландии.
Фоновые заболевания: хронический атрофический гиперпластический гастрит, аденоматозные полипы, пернициозная анемия, состояния после резекции желудка, болезнь Менетрие (гипертрофическая гастропатия, гиперпластический гигантоскладочный гастрит) [1, 2].
1.3 Эпидемиология
Рак желудка, являясь одной из самых распространенных злокачественных опухолей человека, занимает вторую позицию в структуре смертности у мужчин и женщин. Ежегодно в РФ регистрируют около 36 тыс. новых случаев рака желудка и более 34 тыс. больных умирает от этого заболевания. Мужчины заболевают в 1,3 раза чаще женщин, пик заболеваемости приходится на возраст старше 50 лет [3].
1.4 Кодирование по МКБ-10
Злокачественное новообразование (ЗНО) желудка (C16):
C16.1 – ЗНО дна желудка;
C16.2 – ЗНО тела желудка;
C16.3 – ЗНО преддверия привратника;
C16.4 – ЗНО привратника;
C16.5 – ЗНО малой кривизны желудка неуточнённой части;
C16.8 – ЗНО большой кривизны желудка неуточнённой части;
C16.8 – Поражение желудка, выходящее за пределы вышеуказанных областей;
C16.9 – ЗНО желудка неуточнённой локализации.
1.5 Классификация
1.5.1 Гистологическая классификация (МКБ-о)
8140/2 Аденокарцинома in situ, БДУ
8140/3 Аденокарцинома, БДУ
8140/6 Аденокарцинома, метастатическая, БДУ
8141/3 Скиррозная аденокарцинома. Рак с продуктивным фиброзом. Скиррозный рак.
8142/3 Пластический линит (С16._)
8143/3 Поверхностно распространяющаяся аденокарцинома
8144/3 Аденокарцинома, кишечный тип (С16._) Рак, кишечный тип (С16.)
8145/3 Рак, диффузный тип (С16._) Аденокарцинома, диффузный тип (С16.)
1.5.2 Гистологическая классификация рака желудка по Lauren (1965)
Кишечный тип: строение опухоли сходно с раком кишки. Характерны отчетливые железистые структуры, состоящие из высокодифференцированного цилиндрического эпителия с развитой щёточной каёмкой.
Диффузный тип: опухоль представлена слабо организованными группами или одиночными клетками с большим содержанием муцина (перстневидные клетки). Характерен диффузный инфильтративный рост.
Смешанный тип: в опухоли присутствуют участки и кишечного, и диффузного типа.
1.5.3 Макроскопическая классификация рака желудка [1]
Тип 0 – поверхностные плоские опухоли:
Тип 0-I — возвышенный (высота опухоли в два и более раза превышает толщину слизистой оболочки);
Тип 0-II — поверхностный:
0-IIa — приподнятый тип;
Тип 0-III — изъязвлённый (язвенный дефект слизистой оболочки).
Распространенный рак желудка
Тип 1 – грибовидный или полиповидный;
Тип 2 – язвенный с чётко очерченными краями (блюдцеобразный);
Тип 3 – язвенно-инфильтративный;
Тип 4 – диффузно-инфильтративный (linitis plastica);
Тип 5 – неклассифицируемые опухоли.