какую роль играет серная кислота
Назначение и применение серной кислоты
Многие считают, что серная кислота является очень опасной для человека. При непосредственном взаимодействии так оно и есть. Этот продукт активно используется в разных отраслях, так как обладает отличными эксплуатационными характеристиками. Компания «Химия и Технология» предоставляет приобрести серную кислоту на выгодных условиях.
Продукт отличается маслянистой структурой и прозрачностью, обладает достаточно резким запахом. В чистом виде является бесцветным, а дополнительный оттенок указывает на появление определённых соединений. Легко соединяется с водой, выделяя при этом теплоту в больших количествах.
Серная кислота считается мощным окислителем. Активно используется в разных промышленных отраслях. Применяется при изготовлении удобрений, солей и кислот, всевозможных красителей, в металлургической и нефтяной отрасли. Пищевая индустрия также используется серную кислоту.
Высококонцентрированное соединение вещества активно реагирует с водой. Поэтому нужно разбавлять химическую жидкость водой, а не наоборот.
Она хорошо поглощает пары жидкости из воздуха, поэтому используется для осушения газов. По причине низкой летучести, используется для вытеснения летучих кислот из солей. После чего образуются гидраты серной кислоты.
Как упоминалось выше, в высокой концентрации кислота является серьёзным окислителем. Она воздействует на разные металлы, а продукты реакции зависят от активности металла, образуя два ряда солей. В разбавленном виде вещество также взаимодействует с металлами, только без характерных окислительных свойств.
В промышленной индустрии этот химический элемент получают несколькими способами: контактным и нитрозным. Существует несколько видов – аккумуляторная (чистая), техническая и другие.
Применяется при изготовлении удобрений и в качестве аккумуляторного электролита. Используется в красителях и моющих средствах, пластиках и прочих реактивах, при обогащении руд и для очищения нефтепродуктов. В текстильной и фармацевтической отрасли также не обходятся без серной кислоты.
Серная кислота. Свойства, добыча, применение и цена серной кислоты
В городе Ревда с рельсов сошли 15 вагонов с серной кислотой. Груз принадлежал Среднеуральскому медеплавильному заводу.
ЧП произошло на ведомственных железнодорожных путях в 2013-ом году. Кислота разлилась на площади в 1000 квадратных километров.
Это указывает на масштабы потребности промышленников в реагенте. В Средние века, к примеру, в год требовались лишь десятки литров серной кислоты.
В 21-ом же веке мировая выработка вещества в год – десятки миллионов тонн. По объему производства и применения судят о развитии химических отраслей стран. Так что, реагент достоин внимания. Описание начнем со свойств вещества.
Свойства серной кислоты
Внешне 100-процентная серная кислота – маслянистая жидкость. Она бесцветна и тяжела, отличается крайней гигроскопичностью.
Это значит, что вещество поглощает из атмосферы пары воды. При этом, кислота выделяет тепло.
Поэтому, к концентрированной форме вещества воду добавляют малыми дозами. Влей много и быстро, полетят брызги кислоты.
Учитывая ее свойство разъедать материи, в том числе, и живые ткани, ситуация опасна.
Раствор серной кислоты до 40% — неконцентрированный, химически проявляет себя иначе. Воду в него доливать можно достаточно быстро.
Насыщенное же вещество взаимодействует и с неактивными. Исключение – благородные металлы. Почему же концентрат не «трогает» железо, медь?
Причина в их пассивации. Так называют процесс покрытия металлов защитной пленкой оксидов.
Она-то и препятствует растворению поверхностей, правда, лишь в обычных условиях. При нагреве реакция возможна.
Разбавленная серная кислота больше похожа на воду, нежели масло. Концентрат же, отличим не только по тягучести и плотности, но и дыму, исходящему от вещества на воздухе.
К сожалению, в Мертвом озере на Сицилии содержание кислоты меньше 40%. По внешнему виду водоема не скажешь, что он опасен.
Учитывая разъедающую способность водоема, местные преступники взялись сбрасывать в него трупы. Несколько дней, и от органики не остается и следа.
Качество горючего получаемого из обработанной органики низкое. Кислота в реакции является окислителем, хотя, может быть и восстановителем.
В последней роли вещество выступает, к примеру, взаимодействуя с галогенами. Это элементы 17-ой группы таблицы Менделеева.
Все эти вещества сами не являются сильными восстановителями. Если же кислота встречается с таковыми, выступает лишь в роли окислителя.
Пример: — реакция с сероводородом. А какие реакции дают саму серную кислоту, как ее добывают и производят?
Добыча серной кислоты
В прошлые века реагент добывали не только из железной руды, называемой пиритом, но и из железного купороса, а так же, квасцов.
В принципе, все перечисленные минералы являются серосодержащим сырьем, поэтому, могут применяться для производства серной кислоты и в современности.
Минеральная основа бывает разной, но итог ее обработки один – серный ангидрит с формулой SO2. Образуется при реакции серы с кислородом. Получается, нужно сжечь основу.
В обычных условиях сернистый ангидрид с ним взаимодействует медленно. Поэтому, промышленники окисляют сырье на катализаторах.
Однако, за последний метод «голосуют» лишь 20% промышленников. Основная же масса серной кислоты получается по контактной схеме.
Если подсчитать практику человечества по получению серной кислоты, «накапает» более 1000 лет.
Первые упоминания о реагенте и его добыче содержит труд, датируемый 940-ым годом.
Это записи одного из персидских алхимиков по имени Абубекер аль-Рази. Однако, о кислых газах, получаемых путем прокаливания квасцов, говорил и Джафар аль-Суфи.
Этот арабский алхимик жил еще в 8-ом веке. Однако, судя по записям, в чистом виде серную кислоту не получил.
Применение серной кислоты
Более 40% кислоты идут на производство минеральных удобрений. В ходу суперфосфат, сульфат аммония, аммофос.
Все это комплексные подкормки, на которые делают ставки фермеры и крупные производители.
В удобрения добавляют моногидрат. Это чистая, 100-процентная кислота. Кристаллизуется уже при 10 градусах Цельсия.
На производство всего одной тонны удобрения уходят 600 кило концентрата кислоты.
Около 30% серной кислоты тратятся на очистку углеводородов. Реагент улучшает качество смазочных масел, керосина, парафина.
К ним примыкают минеральные масла и жиры. Их тоже очищают с помощью серного концентрата.
Способность реагента растворять металлы применяется при переработке руд. Их разложение столь же бюджетно, как и сама кислота.
В главе «Свойства» указывалось, что при нагреве серная кислота справляется с оксидными пленками на латуни, меди, железе.
Поэтому, горячий реагент используют для их травления. Так именуют очистку металлических поверхностей. После обработки, сплавы и изделия из них выглядят как новые.
Способность кислоты поглощать воду из атмосферы, делает реагент отличным осушителем.
Если воздействовать на воздух 95-процентным раствором, остаточная влажность составит всего 0,003 миллиграмма паров воды на литр осушаемого газа. Метод применяют в лабораториях и на промышленных производствах.
Стоит отметить роль не только чистого вещества, но и его соединений. Они пригождаются, в основном, в медицине.
Бариевая каша, к примеру, задерживает рентгеновское излучение. Врачи заполняют веществом полые органы, облегчая исследования рентгенологов. Формула бариевой каши: — BaSO4.
Необходим минерал и строителям, использующим его в качестве связующего, скрепляющего материала, а так же, для декоративной отделки.
Цена серной кислоты
Цена на реагент – одна из причин его популярности. Килограмм технической серной кислоты можно приобрести всего за 7 рублей.
Столько за свою продукцию просят, к примеру, менеджеры одного из предприятий Ростова на Дону. Разливают канистрами по 37 кило.
Это стандартный объем тары. Встречаются, так же, канистры в 35 и 36 килограммов.
Купить серную кислоту специализированного плана, к примеру, аккумуляторную, немногим дороже.
За 36-килограммовую канистру просят, как правило, от 2000 рублей. Вот, кстати, еще одна сфера применения реагента.
Не секрет, что разбавленная дистиллированной водой кислота – это электролит. Он нужен не только для обычных батареек, но и машинных аккумуляторов.
Разряжаются они, поскольку серная кислота расходуется, при этом, выделяется более легкая вода. Падает плотность электролита, а значит, и его эффективность.
Формула и физические свойства
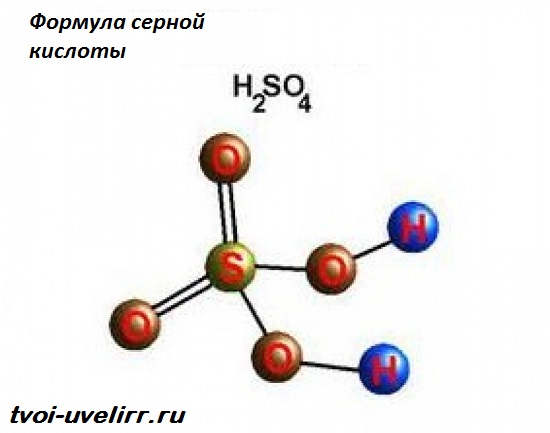
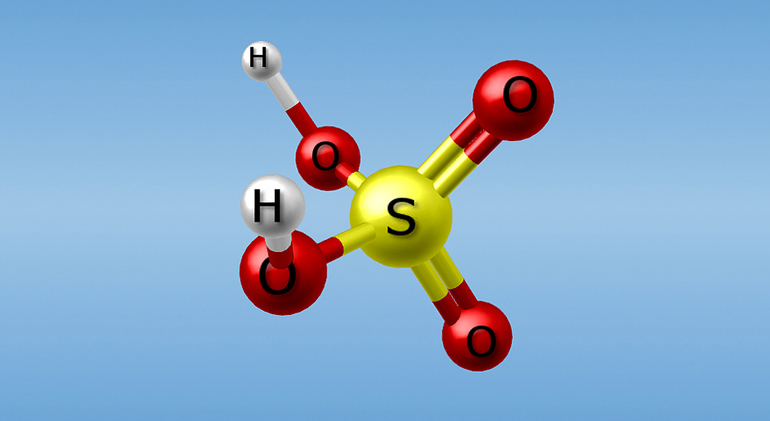
Одно из основных соединений в промышленности — серная кислота — имеет химическую формулу H2SO4. Её молекула состоит из четырёх атомов кислорода, двух — водорода и одного — серы. Эта токсичная плотная маслянистая жидкость без запаха в очищенном состоянии не имеет цвета и обладает характерным «медным» привкусом. Плотность при нормальных условиях составляет 1,84 г/куб. см. Примеси придают неочищенному продукту желтоватую или буро-жёлтую окраску.
Медикам и строителям давно известен природный гипс — кристаллогидрат сульфата кальция. Садоводы и огородники любят медный купорос — ценный помощник в борьбе с различными вредителями и болезнями растений. Квасцы незаменимы в производстве красок и для дубления кожи. Десятиводный кристаллогидрат сульфата натрия — «глауберова соль» — используется в химической промышленности, деревопереработке и медицине (слабительное и желчегонное средство для людей и животных).
Сульфат бария или «бариевая каша» обладает уникальной способностью взаимодействовать с рентгеновским излучением, задерживая его, и это большой плюс при исследованиях полых органов человеческого тела.
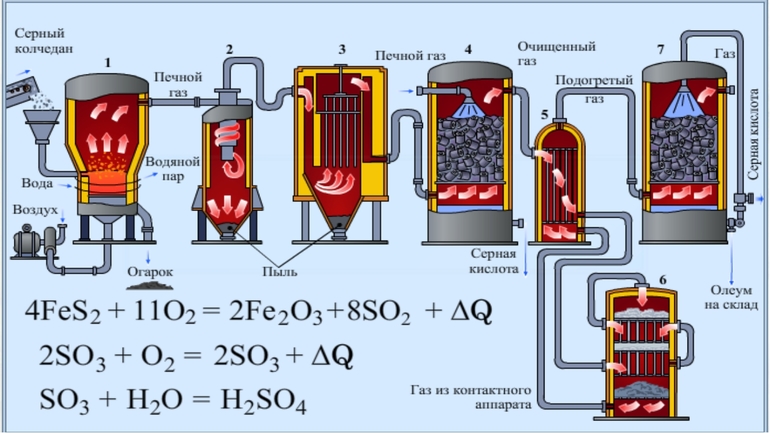
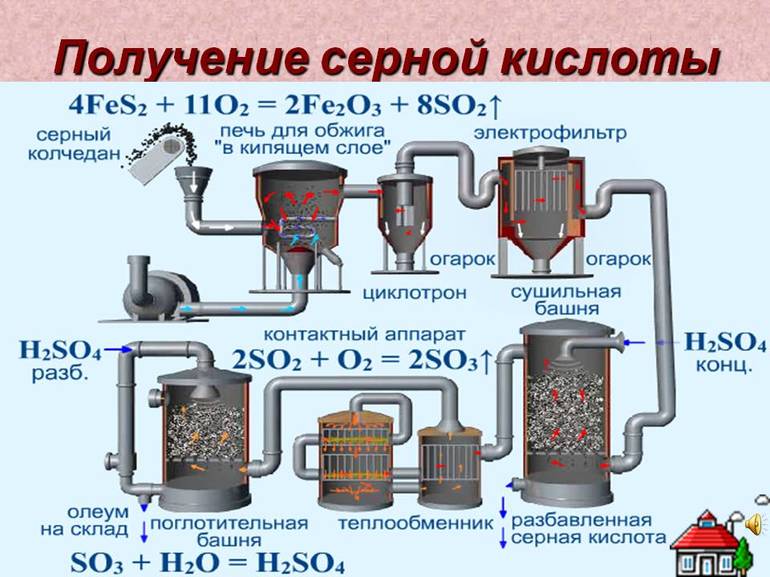
Способы промышленного производства
В качестве сырья долгое время использовался природный минерал пирит — «серный колчедан». Сегодня ему на смену пришли элементарная сера или её соединения: сероводород, соли — сульфиты и сульфаты, а также газовые отходы теплоэлектростанций, работающих на неочищенной нефти. Производство имеет ряд последовательных стадий:
В общем объёме минеральных кислот, которые производятся сегодня химической промышленностью, H2SO4 занимает почётное первое место. При этом она является наиболее дешёвой, технологичной и не разрушает чёрные металлы в концентрированном состоянии.
Камерный метод получения
В эпоху средневековья алхимики синтезировали купоросное масло т. н. камерным способом. Для этого использовались специальные большие, размером с целую комнату, камеры, обложенные изнутри свинцом. Поверхности стенок в результате окисления покрывались защитным слоем сульфата свинца. При горении в присутствии воздуха смеси, состоящей из серы и калиевой селитры, образовывался твёрдый остаток оксидов азота и солей калия и выделялся газообразный оксид серы (III).
Он поглощался водой, имевшейся в камере, и позволял получить продукт малой крепости, которая требовала дальнейшей концентрации. После открытия каталитических свойств оксидов азота, камерный метод уступил место менее трудоёмким и более эффективным технологиям производства.
Современные способы синтеза
«Едва ли найдётся другое, искусственно добываемое вещество, столь часто применяемое в технике» — эти слова гениального русского учёного Д. И. Менделеева наглядно характеризуют ценность серной кислоты. Сегодня при её производстве используются две методики окисления диоксида серы:
При контактном способе смесь реагентов пропускается сквозь твёрдый катализатор, расположенный слоями для увеличения поверхности. Нитрозный метод подразумевает орошение сырья водой или разбавленной кислотой в башенных реакторах. Первый способ более производителен и компактен, позволяет получать продукт большей чистоты при меньших затратах и постепенно вытесняет нитрозного конкурента.
Ускорителей процесса окисления было открыто немало. Наибольший эффект проявляют платина, оксиды ванадия V2O5 и железа Fe2O3. Но первая стоит дорого и быстро отравляется примесями мышьяка, содержащимися в газовой фазе SO2. Для поддержания каталитической активности оксида железа необходимы температуры свыше 600 °C. Наиболее экономичным признан ванадиевый катализатор — он и применяется в производстве.
При улавливании SO3 водой выделяется много тепла, и продукт закипает с образованием аэрозоля. Поэтому используется 100% концентрированная кислота, и получается олеум, который затем разбавляется до необходимых пропорций.
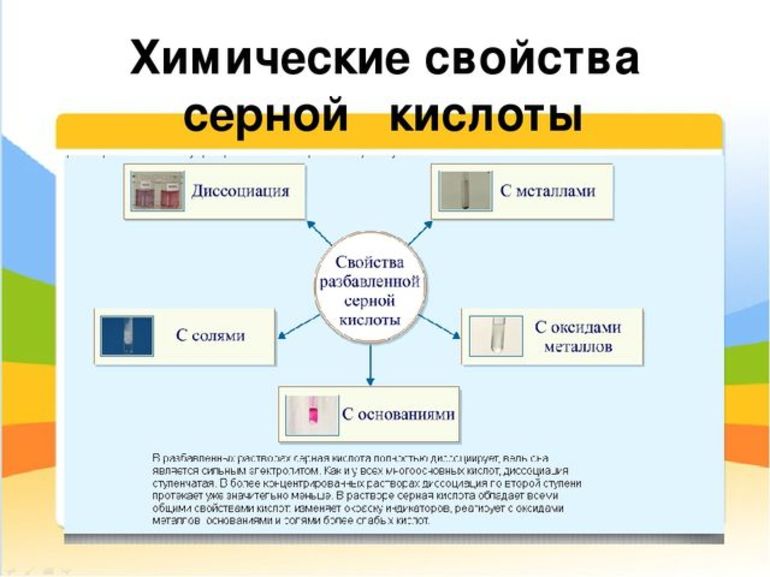
Химические свойства продукта
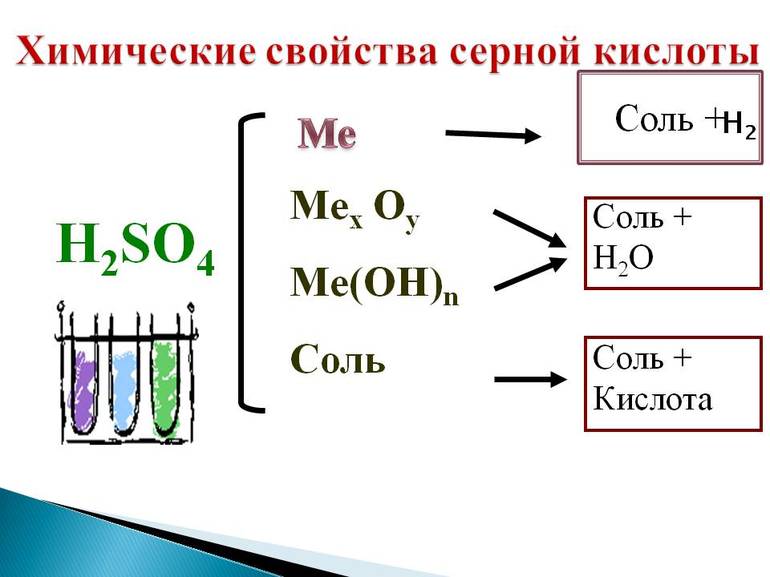
Серная кислота занимает привилегированное положение среди наиболее сильных минеральных кислот. Такую активность легко охарактеризовать высокой полярностью молекулярной связи водород — кислород, и, соответственно, лёгкостью её разрыва. Это придаёт H2SO4 не только ряд общих для всех соединений её класса свойств, например, взаимодействие кислот с металлами, но и специфические качества. Среди основных химических свойств стоит отметить:
Специфические свойства концентрированных растворов обусловлены структурными особенностями формулы серной кислоты: в молекуле H2SO4 положительно заряженный атом серы находится в максимальной, четвёртой степени окисления. Поэтому он может только принимать электроны и сообщать соединению высокие окислительные свойства. Стоит отметить некоторые из них:
Интересно, что в природе эта едкая кислота встречается в чистом 100%-м виде: на итальянском острове Сицилия существует уникальное Озеро смерти, к которому не приближаются даже насекомые и птицы. В этих местах дисульфид железа из земной коры выступает сырьём для синтеза H2SO4, и продукт сочится прямо из дна! Действующие вулканы тоже вносят вклад — извергают в земную атмосферу сернокислотные выбросы, которые причиняют непоправимый вред окружающей среде и становятся причиной серьёзных климатических изменений.
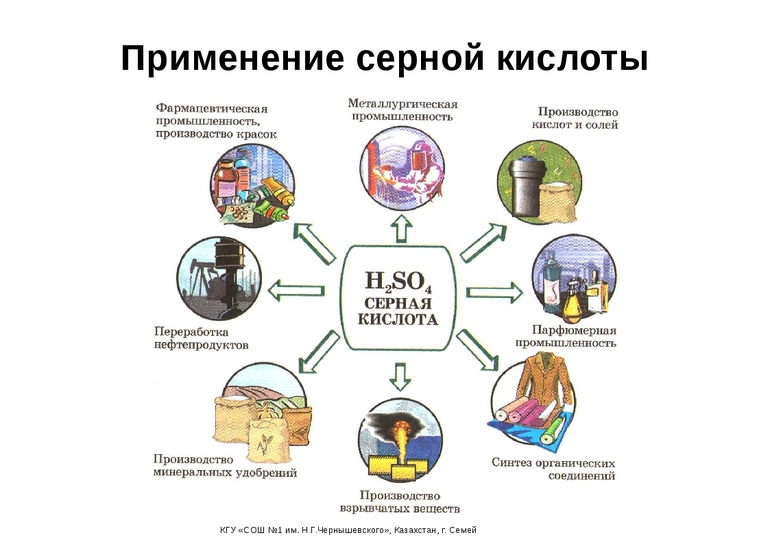
Применение в народном хозяйстве
Достижения химии всегда служили научно-техническому прогрессу. Высокие окислительные способности позволили H2SO4 стать важным компонентом в ряде отраслей промышленности. Её используют:
Отдельно стоит упомянуть промышленный органический синтез — источник эфиров и спиртов, синтетических моющих средств и искусственных волокон. Он немыслим реакций дегидратации, гидратации, сульфирования, алкилирования. Металлообрабатывающие заводы очищают поверхности изделий от окислов, образующихся при сильном нагревании. Но основным потребительским сегментом является изготовление минеральных удобрений (больше всего — фосфорных). Из-за этого сернокислотные заводы рекомендуется размещать недалеко от предприятий по производству этих ценных химических продуктов.
Все приведённые положительные характеристики были бы неполными, если не вспомнить, что серная кислота и олеум — опасные, чрезвычайно агрессивные продукты. Атмосферные кислотные аэрозоли периодически образуются в результате выбросов металлургических и химических заводов и выпадают в виде осадков. Они поражают кожу и слизистые, что приводит к затруднению дыхания, провоцирует кашель и бронхолёгочные заболевания с отёками гортани.
При попадании на кожные покровы возникают химические ожоги, их тяжесть напрямую зависит от концентрации и площади контакта. При проглатывании появляются резкие боли во рту и пищеводе, затем начинается рвота, кашель, затрудняется дыхание и ослабляется сердечная деятельность, а смертельной считается доза 5 мг. Первая помощь при отравлении парами заключается в обеспечении притока свежего воздуха и промывании слизистых содовым раствором. При растекании по коже поражённое место обильно орошают водой, а проглатывание требует промывания желудка и приёма известковой воды.
Серная кислота — Все что необходимо знать
Вещество серная кислота – токсичный и смертельно опасный реагент. Но без него современное человечество обойтись не может. используют при производстве лекарственных препаратов, химической продукции, металлургии, удобрений, нефтепродуктов. Вещество не имеет особого запаха, бесцветно, вязкой консистенции, но имеет привкус меди. Отлично взаимодействует с водой в любых пропорциях. Из-за хорошего взаимодействия с другими веществами и водой имеет неофициальное название «кровь химии».
Где применяется серная кислота
За год во всем мире используют более 200 миллионов тонн вещества. В основном оно уходит на производство удобрений и химической продукции:
Разбавленная серная кислота – 7 типов солей
Серная кислота используется в концентрированном виде и в виде растворов точнее солей. Смеси различных химических веществ:
Еще разбавленная серная кислота используется при производстве аккумуляторов в виде дистиллята. Так же такой вид раствора как Олеум. Он чаще всего необходим для транспортировки, так как не воздействует со сталью в отличие от концентрированной серной кислоты.
История. Кто начал использовать раствор серной кислоты
Всем, кто имеет дачный участок или дом в деревне известен медный купорос. Изучением и производством растворов с содержанием серной кислоты активно начали заниматься в 13 веке. Химики того времени придумали нагревать алюмокалиевые квасцы. В 15 веке химики продвинулись и придумали «купоросное масло». В 16 веке Иоганн Глаубер придумал другой способ добычи вещества. С помощью горения нитрата калия серы в присутствии водных паров, он получил Серную кислоту. Уже в это время Серную кислоту использовали химики, фармацевты и ювелиры.
В дальнейшем в Англии ученый Джон Робак решил удешевить производство и заменил стеклянные резервуары на освинцованные. Этим способом он получал 65% раствор вещества Н2SO4.
Современный метод добычи открыли в 19 веке. Он получил название «Нитрозный». К концу 19 века в Европе выпускали за год 1 миллион тонн серной кислоты.
В России первые фабрики по производству открылись в Москве в 1805 году.
Как производят серную кислоту в наше время
На сегодняшний день используют два метода Контактный и Нитрозный.
Контактный метод используется по всему миру. Его распространённость обусловлена следующими преимуществами:
При Контактном методе используют следующие виды сырья:
Пирит измельчают для ускорения прохождения химической реакции. Далее измельченные пирит смешивают с водой. Это позволяет удалить не нужные примеси, они остаются на поверхности. Далее под воздействием высокой температуры (800 °C) вода испаряется не нужные взвеси сгорают. Далее Добавляют катализатор и уменьшают температуру (420-550 °C) Происходит процесс окисления и диоксид серы превращается в ангидрид серной кислоты. Далее в поглотительной башне ангидрит отделяется и появляется чистая серная кислота. В процессе производства вырабатывается огромное количество тепла, которое используют как вспомогательный источник энергии. При использовании данного метода получения Н2SO4 почти нет отходов.
Нитрозный метод представлен в двух вариантах камерный и башенный. При его использовании получится 75% серная кислота. В составе остается железо оксид азота, и иных примесей. Данный способ вреден для экологии, но до сих пор достаточно часто применяется, так как он проще и дешевле Контактного метода.
Основные производители серной кислоты в России
В России ежегодно производят около 10 миллионов тонн серной кислоты. Заводы представляют собой комплекс различных производств и поэтому в основном самостоятельно перерабатывают почти все полученное вещество. В основном это производители удобрений, но так же выпускают следующие виды серной кислоты:
Основные крупнейшие производители серной кислоты в России:
Не маловажную роль играют поставщики вещества пирит. В России их добывают на двух горно-обогатительных комбинатах Талнахский и Норильский.
Транспортировка вещества серная кислота
Серная кислота вещество повышенной опасности и требует определенных мер при транспортировке. Вещество взрывоопасно и имеет 8 класс опасности в перевозке грузов. В случае ошибки водителя и аварии велика вероятность разлива серной кислоты и нанесения вреда экологии.
Поэтому для перевозки опасных грузов требуются особе правила. Подпирается специальная устойчивая емкость для перевозки. Цистерны или специальные бочки и ёмкости, которые изготовлены из определённых сплавов, на которые не оказывает воздействие кислоты и яды.
Транспорт обязательно должен иметь соответствующую маркировку предупреждающую других водителей об опасном грузе. Водитель проходит специальное обучение и получает свидетельство АДР. Для каждой транспортировки разрабатывается специальный маршрут следования, которые исключает места большого количества людей и крупные производственные объекты. Чтобы избежать экологической катастрофы в случае ДТП и воздействия опасных химических веществ на людей.
В чем опасность серной кислоты для человека
Н2SO4 очень токсичное вещество. Легко растворяется в воде и вступает в контакт с другими химическими веществами. В чистом виде сильно поглощает влагу и может распространиться в газообразной форме, в случае аварии на производстве или при транспортировке. Серная кислота в большой концентрации взрывоопасна.
В случае если на человека попадут капли вещества на кожу либо он вдохнет пары или что еще хуже каким-то образом выпьет даже несколько капель последствия могут очень плачевными. Серная кислота очень агрессивна плюс в её состав входит мышьяк, который усиливает отравление организма человека. Но существует безвредная доза серной кислоты, содержащаяся в воздухе, 0.3мг на 1 кв. метр. При воздействии серной кислоты на человека часто возникает трахеит, бронхит, ларингит. Если кислота попала на кожный покров, то кожа разъедается, и рана очень долго заживает. При этом если не обратиться за профессиональной медицинской помощью место ожога может разрастись и привести к летальному исходу пострадавшего. Какие признаки отравления серной кислотой бывают:
Последний пункт очень опасный симптом. Человек в этом случае очень близок к удушью и летальному исходу.
Варианты первой помощи при отравлении серной кислотой
Если вы находитесь в зоне, где в воздухе скапливается серная кислота, необходимо немедленно выйти на чистый воздух. Далее обратиться к мед. работникам, вызвать скорую помощь. В момент ожидание помощи, можно попробовать облегчить свое состояние после отравления серной кислотой. Если раствор вещества попал внутрь, то нужно сделать промывание желудка большим количеством теплой воды. Если Н2SO4 попало на слизистую, то необходимо сразу промыть ее чистой водой в большом количестве. Дальнейшую помощь и последующее лечение окажут профессиональные сотрудники мед. учреждений. Самолечение невозможно, так как это может привести к ухудшению состояния человека и к летальному исходу.
Ликвидация разлива серной кислоты
В случае аварии на производстве либо в момент транспортировки может произойти возгорание или разлив серной кислоты. Устранение аварии производят в специальных костюмах химической защиты, например, изолирующие костюмы Стрелец. Газоспасатели в костюмах химзащиты эвакуируют пострадавших в безопасную зону. Устраняют течь и с помощью большого количества воды гасят серную кислоту. В дальнейшем собирают жидкость в специальные емкости и утилизируют. Газоспасателям оказывают помощь пожарные, им так же приходится работать в костюмах химзащиты.