какую роль играет холестерин в мембранах
Польза или вред? Как холестерол влияет на структуру рецепторов в нервных клетках
Польза или вред? Как холестерол влияет на структуру рецепторов в нервных клетках
Холестерол (оранжевый) внутри холинергического рецептора (часть белка показана прозрачной). На картинке также дана молекула мембранного фосфолипида (бирюзовый), взаимодействующего с рецептором.
Автор
Редакторы
Многие наслышаны о вреде холестерина, содержащегося в продуктах, которые мы потребляем. Так ли уж вредна эта молекула для нашего организма? Холестерол (он же холестерин) и его производные являются важными компонентами клеточных мембран, особенно если речь заходит о нервной ткани. Недавно было опубликовано исследование, в котором обнаружена необычная функция холестерола. Оказывается, он способен связываться с холинергическими рецепторами, влияя при этом на их пространственную структуру. Кроме того, были обнаружены специфические сайты связывания холестерола. Это позволяет по-новому взглянуть на его роль в функционировании нервной ткани.
Никотиновый ацетилхолиновый (холинергический) рецептор (nAChR) представляет собой неспецифический ионный канал (Na + /K + ), активация которого происходит в результате связывания различных молекул-лигандов. Этот белок играет центральную роль во многих нервных и мышечных процессах. Свое название он получил благодаря способности селективно связывать молекулу никотина. Нарушение работы данного рецептора связано с развитием многих неврологических заболеваний (эпилепсия, шизофрения, болезни Паркинсона и Альцгемера и др.), а также алкогольной, никотиновой и кокаиновой зависимостей. Кроме того, с nAChR связано действие общих анестетиков. Неудивительно, что пространственная организация рецептора вызывает повышенный интерес. На данный момент в распоряжении исследователей имеется структура nAChR из «батареи» электрического ската (Torpedo), полученная с помощью метода электронной микроскопии высокого разрешения (ЭМ, см. также [1]). Согласно этим данным, канал представляет собой гетеропентамер, образованный несколькими различными субъединицами (αβ, β, δ, αδ и γ). Интересно, что в областях контакта между субъединицами, формирующими рецептор, наблюдаются многочисленные полости, роль которых до сих пор не была установлена.
Исследователи из Центра молекулярного моделирования Университета Пенсильвании, проанализировав многочисленные экспериментальные данные, пришли к выводу, что холестерол должен играть важную роль в пространственной организации nAChR [2]. Причем, если раньше такую роль видели в создании специфического липидного окружения канала в мембране («холестероловой шубы»), то в данном случае была выдвинута гипотеза, что холестерол может непосредственно встраиваться между субъединицами nAChR.
Для проверки это гипотезы было привлечено сразу несколько современных методов молекулярного моделирования: недостающие петлевые фрагменты в ЭМ-структуре белка были достроены с помощью моделирования по гомологии (см. также [3]), нахождения сайтов связывания холестерола было произведено алгоритмами докинга (см. также [4]), оптимизация полученной структуры комплекса nAChR со встроенными молекулами холестерола, помещенного в липидный бислой (модель клеточной мембраны), была выполнена в ходе расчетов молекулярной динамики (МД, см. также [5]). Данная система насчитывала более 200 тыс. атомов, поэтому ресурсоемкие расчеты МД были выполнены с использованием суперкомпьютерного кластера.
В результате было показано, что данный рецептор способен связывать 15 молекул холестерола, которые заполняют специфические полости между его субъединицами. При этом размер и геометрия таких полостей обеспечивают специфическое связывание именно холестерола, а не других компонентов мембран (например, фосфолипидов). Интересно, что специфическое встраивание холестерола внутрь nAChR стабилизирует структуру рецептора: в отсутствии холестерола структура быстро коллапсирует в процессе МД и утрачивает характерную укладку, необходимую для формирования проводящей поры канала. В то же время в комплексе с холестеролом структура рецептора остается близкой к экспериментальной в течение всего модельного эксперимента.
Таким образом, в канальной функции nAChR (а в общем — проведении нервного импульса) холестерол может играть неожиданно важную роль. Эта особенность, по мнению авторов, должна быть свойственна и другим родственным nAChR рецепторам, среди которых такие важные молекулы, как рецепторы серотонина и ГАМК. Пока в подтверждении своей гипотезы исследователи располагают только косвенными экспериментальными данными, а также результатами моделирования. Окончательный вердикт, видимо, можно будет вынести, когда удастся получить кристаллографическую структуру комплекса холинергического рецептора с холестеролом.
Холестерин и его функции в организме
Холестери́н (др.-греч. χολή — жёлчь и στερεός — твёрдый) — органическое соединение, природный полициклический липофильный спирт, содержащийся в клеточных мембранах всех животных и человека. Холестерин в составе клеточной плазматической мембраны придает ей определённую жёсткость за счёт увеличения плотности «упаковки» молекул фосфолипидов. Таким образом, холестерин — стабилизатор текучести плазматической мембраны. Холестерин открывает цепь биосинтеза стероидных половых гормонов (эстрогены, прогестерон, тестостерон) и кортикостероидов (кортизол, альдостерон), служит основой для образования желчных кислот и витаминов группы D, участвует в регулировании проницаемости клеток и предохраняет эритроциты крови от действия гемолитических ядов.
Холестерин бывает двух видов: низкой плотности (ЛПНП) и высокой плотности (ЛПВП). Большое содержание ЛПВП в крови характерно для здорового организма, поэтому часто эти липопротеиды называют «хорошими». Высокомолекулярные липопротеиды хорошо растворимы и не склонны к выделению холестерина в осадок, и тем самым защищают сосуды от атеросклеротических изменений (то есть не являются атерогенными).
Уровень холестерина в крови измеряется либо в ммоль/л (миллимоль на литр — единица, действующая в РФ) либо в мг/дл (миллиграмм на децилитр, 1 ммоль/л равен 38,665 мг/дл). Идеально, когда уровень «плохих» низкомолекулярных липопротеидов ниже 2,586 ммоль/л (для лиц с высоким риском сердечно-сосудистых заболеваний — ниже 1,81 ммоль/л). Такой уровень, однако, у взрослых достигается редко. Если уровень низкомолекулярных липопротеидов выше 4,138 ммоль/л, рекомендуется использовать диету для снижения его ниже 3,362 ммоль/л (что может привести к депрессивным расстройствам, повышенному риску инфекционных и онкологических заболеваний. Если этот уровень выше 4,914 ммоль/л или упорно держится выше 4,138 мг/дл, рекомендуется рассмотреть возможность лекарственной терапии. Для лиц с высоким риском сердечно-сосудистых заболеваний эти цифры могут снижаться. Доля «хороших» высокомолекулярных липопротеидов в общем уровне холестерин-связывающих липопротеидов чем выше, тем лучше. Хорошим показателем считается, если он гораздо выше 1/5 от общего уровня холестерин-связывающих липопротеидов.
К факторам, повышающим уровень «плохого» холестерина, относятся:
В организме здорового человека в результате обменных процессов количество холестерина поддерживается на постоянном уровне. При этом некоторое его количество поступает в организм с продуктами питания, так называемый пищевой холестерин, а большая часть синтезируется в организме из жиров и углеводов. Прием холестерина в пределах суточной нормы (0,6 г) существенно не влияет на его уровень в крови. Холестерин преимущественно продуцируется в печени, причем его синтез находится в обратной зависимости от количества холестерина, поступающего с пищей. Повышенное потребление продуктов с высоким содержанием холестерина при нормальном липидном обмене снижает его выработку в организме. Однако, при длительном потреблении пищевого холестерина сверх дневной нормы его уровень в крови повышается. При нарушенном липидном обмене даже незначительное увеличение потребляемого с пищей холестерина приводит к повышению его уровня в крови. Нарушение липидного обмена может произойти при длительном несоблюдении правильного режима питания, при некоторых хронических заболеваниях, в результате изменения гормонального фона организма, от генетической предрасположенности и т.д. Наряду с тем, что холестерин относится к физиологически необходимым веществам, выполняющим жизненно важные функции в организме, он также является основным фактором развития атеросклероза.
К продуктам с высоким содержанием холестерина относятся яичный желток, говяжий жир, мозги животных, печень, почки, икра, масло, сметана и другие жирные молочные продукты. При нарушении липидного обмена следует сократить потребление продуктов с высоким содержанием холестерина, особенно больным атеросклерозом и ишемической болезнью сердца, а также людям пожилого возраста. Исключение составляют яйца и молочные жиры, содержащие лицетин. Благодаря содержанию в нем фосфора и холина, лецитин является биологическим антагонистом холестерина, он способствует улучшению процессов обмена холестерина в организме и препятствует возникновению атеросклероза. Здоровым людям не следует строго соблюдать бесхолестериновые диеты. Пища, даже с высоким содержанием холестерина, потребляемая в умеренных количествах, не может вызвать серьезных отрицательных последствий. Но и перегружать организм избыточным потреблением продуктов с высоким содержанием холестерина тоже нельзя.
Информация подготовлена врачом по гигиеническому воспитанию ФБУЗ «Центр гигиены и эпидемиологии в Калининградской области» Деревягиной В.А.
Хороший, плохой, злой холестерин
Хороший, плохой, злой холестерин
Нарушение жирового обмена является основным фактором развития атеросклероза и связанных с ним осложнений (ишемическая болезнь сердца, инфаркт, инсульт, облитерация сосудов нижних конечностей и пр.). При этом наиболее важным фактором повышенного риска атеросклероза является повышение содержания в крови атерогенных липопротеинов.
Автор
Редакторы
Статья на конкурс «био/мол/текст»: Вряд ли сейчас найдется человек, который не слышал, что высокий холестерин — это плохо. Однако столь же мала вероятность встретить человека, который знает, ПОЧЕМУ высокий холестерин — это плохо. И чем определяется высокий холестерин. И что такое высокий холестерин. И что такое холестерин вообще, зачем он нужен и откуда берется.
Конкурс «био/мол/текст»-2012
Эта статья представлена на конкурс научно-популярных работ «био/мол/текст»-2012 в номинации «Лучший обзор».
Спонсор конкурса — дальновидная компания Thermo Fisher Scientific.
Довольно подробно о роли холестерина в работе биомембран рассказывается в статье «Липидный фундамент жизни» [12]. — Ред.
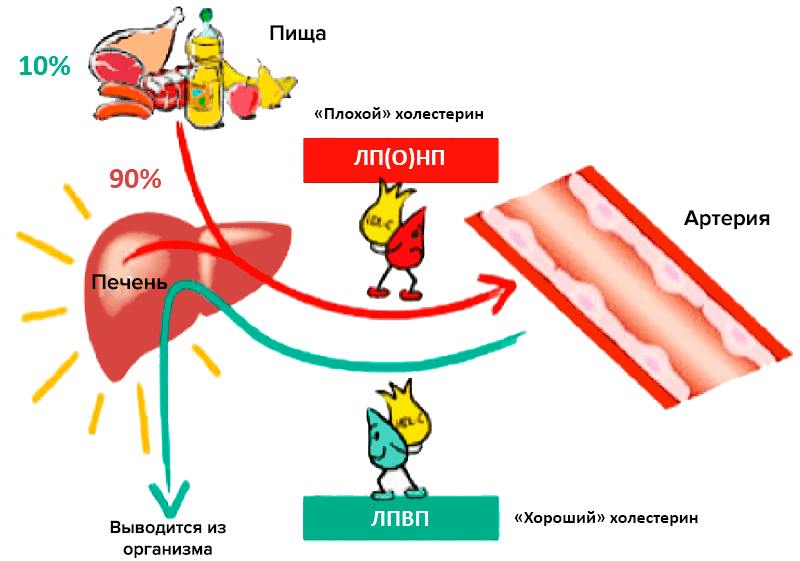
Главный липидный компонент пищевого жира и жировых отложений — это триглицериды, которые представляют собой эфиры глицерина и жирных кислот. Холестерин и триглицериды, будучи неполярными липидными веществами, транспортируются в плазме крови в составе липопротеиновых частиц. Частицы эти подразделяют по размеру, плотности, относительному содержанию холестерина, триглицеридов и белков на пять больших классов: хиломикроны, липопротеины очень низкой плотности (ЛПОНП), липопротеины промежуточной плотности (ЛППП), липопротеины низкой плотности (ЛПНП) и липопротеины высокой плотности (ЛПВП) [2]. Традиционно ЛПНП считается «плохим» холестерином, а ЛПВП — «хорошим» (рис. 1).
Рисунок 1. «Плохой» и «хороший» холестерины. Участие различных липопротеиновых частиц в транспорте липидов и холестерина.
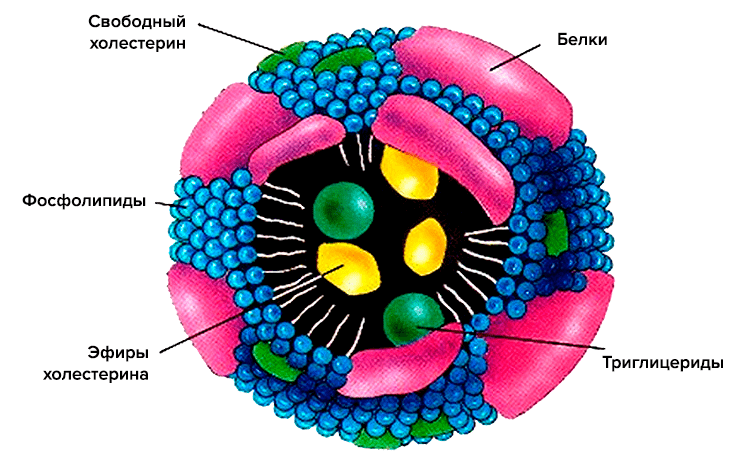
Схематично структура липопротеина включает неполярное ядро, состоящее по большей части из холестерина и триглицеридов, и оболочку из фосфолипидов и апопротеинов (рис. 2). Ядро — функциональный груз, который доставляется до места назначения. Оболочка же участвует в распознавании клеточными рецепторами липопротеиновых частиц, а также в обмене липидными частями между различными липопротеинами [3].
Рисунок 2. Схематическое строение липопротеиновой частицы
Баланс уровня холестерина в организме достигается следующими процессами: внутриклеточный синтез, захват из плазмы (главным образом из ЛПНП), выход из клетки в плазму (главным образом в составе ЛПВП). Предшественник синтеза стероидов — ацетил коэнзим А (CoA). Процесс синтеза включает, по крайней мере, 21 шаг, начиная с последовательного преобразования ацетоацетил CoA. Лимитирующая стадия синтеза холестерина в большой степени определяется количеством холестерина, абсорбируемого в кишечнике и транспортируемого в печень [4]. При недостатке холестерина происходит компенсаторное усиление его захвата и синтеза.
Транспорт холестерина
Систему транспорта липидов можно разделить на две большие части: внешнюю и внутреннюю.
Внешний путь начинается с всасывания в кишечнике холестерина и триглицеридов. Его конечный результат — доставка триглицеридов в жировую ткань и мышцы, а холестерина — в печень. В кишечнике пищевой холестерин и триглицериды связываются с апопротеинами и фосфолипидами, формируя хиломикроны, которые через лимфоток попадают в плазму, мышечную и жировую ткани. Здесь хиломикроны взаимодействуют с липопротеинлипазой — ферментом, который освобождает жирные кислоты. Эти жирные кислоты поступают в жировую и мышечную ткани для накопления и окисления соответственно. После изъятия триглицеридного ядра остаточные хиломикроны содержат большое количество холестерина и апопротеина Е. Апопротеин Е специфически связывается со своим рецептором в клетках печени, после чего остаточный хиломикрон захватывается и катаболизируется в лизосомах. В результате этого процесса освобождается холестерин, который затем преобразуется в желчные кислоты и выводится или участвует в формировании новых липопротеинов, образующихся в печени (ЛПОНП). При нормальных условиях хиломикроны находятся в плазме в течение 1–5 ч. после приема пищи [2], [3].
Внутренний путь. Печень постоянно синтезирует триглицериды, утилизируя свободные жирные кислоты и углеводы. В составе липидного ядра ЛПОНП они выходят в кровь. Внутриклеточный процесс формирования этих частиц схож с таковым для хиломикронов, за исключением различия в апопротеинах. Последующее взаимодействие ЛПОНП с липопротеинлипазой в тканевых капиллярах приводит к формированию остаточных ЛПОНП, богатых холестерином (ЛППП). Примерно половина этих частиц выводится из кровотока клетками печени в течение 2–6 ч. Остальные претерпевают модификацию с замещением оставшихся триглицеридов эфирами холестерина и освобождением от всех апопротеинов, за исключением апопротеина В. В результате формируются ЛПНП, которые содержат ¾ всего плазменного холестерина. Их главная функция — доставка холестерина в клетки надпочечников, скелетных мышц, лимфоцитов, гонад и почек [3]. Модифицированные ЛПНП (окисленные продукты, количество которых возрастает при повышенном содержании в организме активных форм кислорода, так называемом окислительном стрессе) могут распознаваться иммунной системой как нежелательные элементы. Тогда макрофаги их захватывают и выводят из организма в виде ЛПВП. При чрезмерно высоком уровне ЛПНП макрофаги становятся перегруженными липидными частицами и оседают в стенках артерий, образуя атеросклеротические бляшки.
Основные транспортные функции липопротеинов приведены в таблице.
| Класс | Размеры | Функция |
|---|---|---|
| ЛПВП | 4–14 нм | Транспорт холестерина от периферийных тканей к печени |
| ЛПНП | 20–22,5 нм | Транспорт холестерина, триглицеридов и фосфолипидов от печени к периферийным тканям |
| ЛППП | 25–35 нм | Транспорт холестерина, триглицеридов и фосфолипидов от печени к периферийным тканям |
| ЛПОНП | 30–80 нм | Транспорт холестерина, триглицеридов и фосфолипидов от печени к периферийным тканям |
| Хиломикроны | 75–1200 нм | Транспорт холестерина и жирных кислот, поступающих с пищей, из кишечника в периферические ткани и печень |
Регуляция уровня холестерина
Уровень холестерина в крови в большой степени определяется диетой. Пищевые волокна снижают уровень холестерина, а пища животного происхождения повышает его содержание в крови.
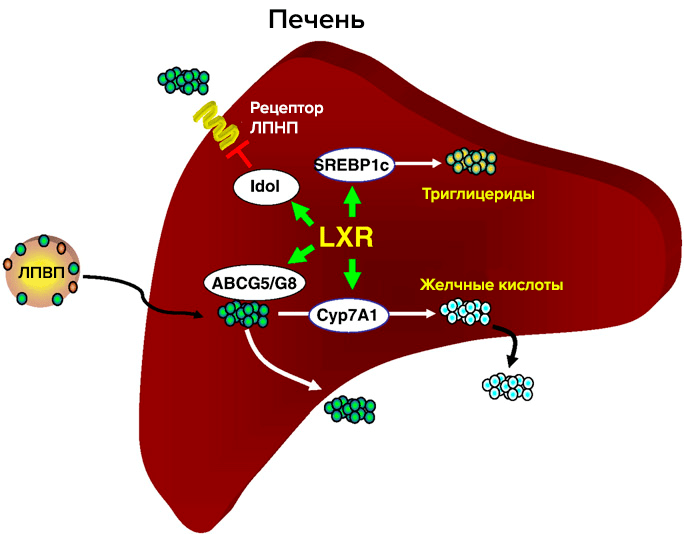
Один из основных регуляторов метаболизма холестерина — рецептор LXR (рис. 3). LXR α и β принадлежат к семейству ядерных рецепторов, которые образуют гетеродимеры с ретиноидным Х рецептором и активируют гены-мишени. Их естественные лиганды — оксистерины (окисленные производные холестерина). Обе изоформы идентичны на 80% по аминокислотной последовательности. LXR-α обнаружен в печени, кишечнике, почках, селезенке, жировой ткани; LXR-β в небольшом количестве обнаруживается повсеместно [6]. Метаболический путь оксистеринов быстрее, чем у холестерина, и поэтому их концентрация лучше отражает краткосрочный баланс холестерина в организме. Существует всего три источника оксистеринов: ферментативные реакции, неферментативное окисление холестерина и поступление с пищей. Неферментативные источники оксистеринов как правило минорные, но в патологических состояниях их вклад возрастает (окислительный стресс, атеросклероз), и оксистерины могут действовать наряду с другими продуктами перекисного окисления липидов [6]. Основное влияние LXR на метаболизм холестерина: обратный захват и транспорт в печень, вывод с желчью, снижение кишечного всасывания. Уровень продукции LXR различается на протяжении аорты; в дуге, зоне турбулентности, LXR в 5 раз меньше, чем в участках со стабильным течением. В здоровых артериях повышение экспрессии LXR в зоне сильного потока оказывает антиатерогенное действие [7].
Рисунок 3. Участие рецептора LXR в метаболизме холестерина в печени
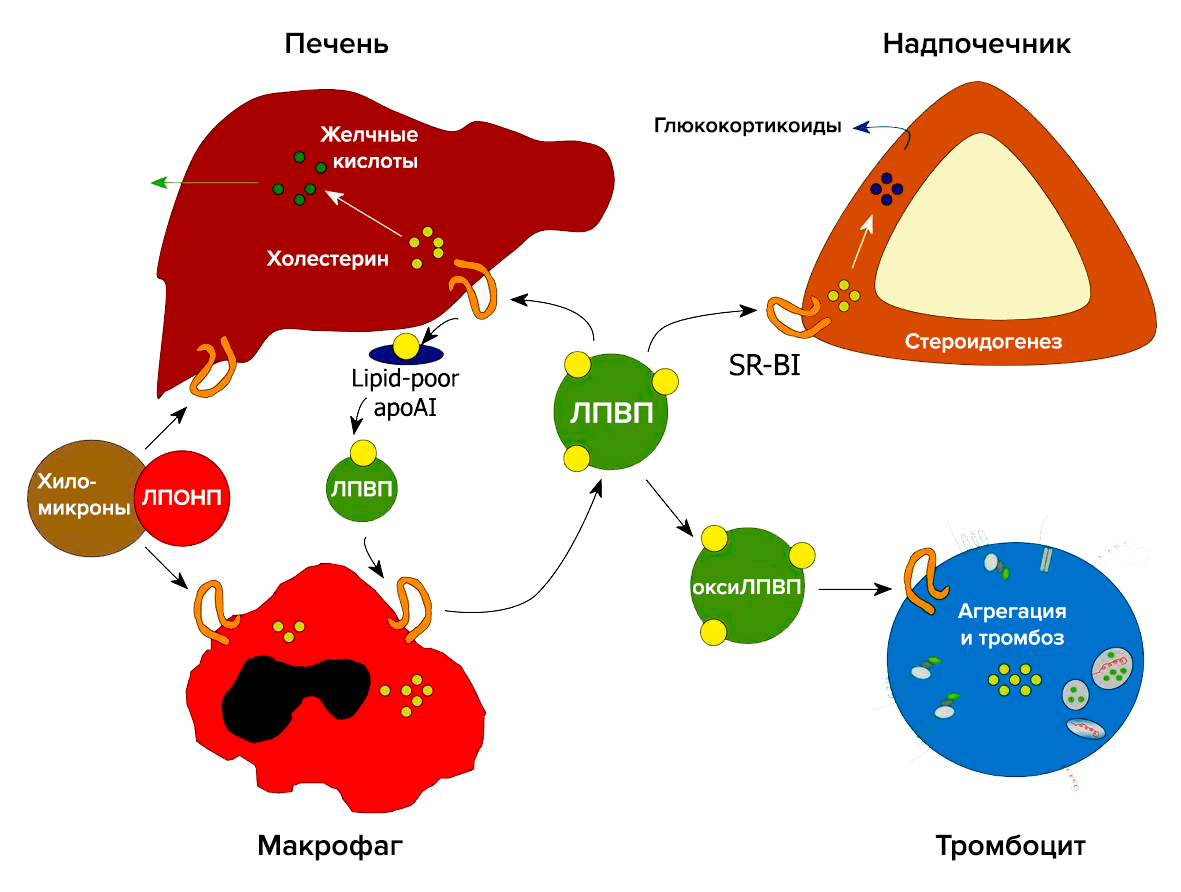
Важную роль в метаболизме холестерина и стероидов играет рецептор-«мусорщик» SR-BI (рис. 4). Он был обнаружен в 1996 году как рецептор для ЛПВП [8]. В печени SR-BI отвечает за избирательный захват холестерина из ЛПВП. В надпочечниках SR-BI опосредует избирательный захват этерифицированного холестерина из ЛПВП, который необходим для синтеза глюкокортикоидов. В макрофагах SR-BI связывает холестерин, что является первым этапом в обратном транспорте холестерина. SR-BI также захватывает холестерин из плазмы и опосредует его прямой выход в кишечник [9].
Рисунок 4. Участие рецептора SR-BI в метаболизме холестерина
Выведение холестерина из организма
Классический путь выведения холестерина: транспорт холестерина с периферии в печень (ЛПВП), захват клетками печени (SR-BI), экскреция в желчь и выведение через кишечник, где большая часть холестерина возвращается в кровь [10].
Основная функция ЛПВП — обратный транспорт холестерина в печень. Плазменные ЛПВП являются результатом комплекса различных метаболических событий. Состав ЛПВП очень различается по плотности, физико-химическим свойствам и биологической активности. Это сферические или дисковидные образования. Дисковидные ЛПВП в основном состоят из апопротеина A-I с вложенным слоем фосфолипидов и свободного холестерина. Сферические ЛПВП больше и дополнительно содержат гидрофобное ядро из эфиров холестерина и небольшого количества триглицеридов.
При метаболическом синдроме активируется обмен триглицеридов и эфиров холестерина между ЛПВП и триглицерид-богатыми липопротеинами. В результате содержание триглицеридов в ЛПВП повышается, а холестерина снижается (т.е. холестерин не выводится из организма) [11]. Отсутствие ЛПВП у людей встречается при болезни Tangier, главные клинические проявления которой — увеличенные оранжевые миндалины, роговичная дуга, инфильтрация костного мозга и мукозного слоя кишечника [3].
Восстановление этого баланса искусственным путем (например, на молекулярном уровне с использованием наночастиц) когда-нибудь станет основным способом лечения атеросклероза (см. «Наночастицами — по „плохому“ холестерину!» [13]). — Ред.
Холестерин не всегда причина атеросклероза
ЖИЗНЕННО НЕОБХОДИМЫЙ ХОЛЕСТЕРИН
ХОЛЕСТЕРИН НЕ ВСЕГДА ПЕРВОПРИЧИНА АТЕРОСКЛЕРОЗА
Примечание редактора:
В продолжение информации на данной странице рекомендован к изучению обзорный материа:
Содержание страницы:
С тех пор, как Всемирная организация здравоохранения объявила холестерин одной из главных причин атеросклероза, это вещество впало в немилость. Однако следует знать, что холестерин является жизненно важным веществом для организма человека и он является не единственной причиной атеросклероза (речь идет о причинно-следственной связи). Иными словами, да, холестерин и атеросклероз взаимосвязаны, но истоки патологии могут лежать не в самом стероидном соединении и его уровне в организме (См.: Краткие сведения о холестерине, его биосинтезе и липидном обмене ).
ЧТО ТАКОЕ ХОЛЕСТЕРИН?
Холестерин часто путают с жирами. В отличие от жиров, он не используется организмом для получения калорий и не имеет отношения ни к ожирению, ни, тем более, к целлюлиту. Холестерин (С27Н46О) — жироподобное органическое вещество животного происхождения из группы стероидов — соединений с ядром из трех шести- и одного пятичленного углеродных колец.
Рис.1. Стуктура и модель молекулы ходестерина
Рис.2. Шариковая модель триглицерида. Красным цветом выделен кислород, чёрным — углерод, белым — водород
Рис.3. Триглицериды. Зелёным цветом выделен остов глицерина, чёрным на белом фоне — часть молекулы жирных кислот (на рисунке — это радикалы пальмитиновой кислоты)
Открытие холестерина. Заслуга открытия холестерина всецело принадлежит французским химикам. В 1769 году Пулетье де ла Саль получил из желчных камней плотное белое вещество («жировоск»), обладавшее свойствами жиров. В чистом виде холестерин был выделен химиком, членом национального Конвента и министром просвещения Франции А. Фуркруа в 1789 году. И лишь в 1815 году Мишель Шеврель, также выделивший это соединение, неудачно окрестил его холестерином (др.-греч. χολη — желчь и στερεος — твёрдый). В 1859 году Пьер Бертло доказал, что холестерин принадлежит к классу липофильных спиртов. Это обязывало в химическом названии вещества использовать суффикс «-ол», поэтому в 1900 году холестерин был переименован в холестерол, но в России прижилось неноменклатурное название. Вообще, путаница в названиях химических соединений — дело обычное.
Из холестерина в организме человека вырабатываются все стероидные вещества, в том числе витамин D и гормоны (рис. 1). Без него невозможно функционирование многих жизненно важных систем организма. В организме содержится до 350 г этого вещества. Только одну треть (примерно 0,3–0,5 г в день) необходимого холестерина мы получаем с пищей, а две трети (0,7–1 г) синтезируем сами: 80% в печени, 10% в стенке тонкого кишечника и 5% в коже. Синтезом собственного холестерина организм компенсирует избыток или недостаток в рационе.
Рис.4. Близкие родственники: холестерин, гормоны (кортизол, тестостерон), витамин D, фитостеролы (эргостерол, β-ситостерол).
В печени из холестерина синтезируются желчные кислоты, необходимые для эмульгирования и всасывания жиров в тонком кишечнике. На эти цели уходит 60–80% холестерина. Материнское молоко богато холестерином. Грудные и растущие дети особенно нуждаются в богатых жирами и холестерином продуктах для полноценного развития мозга и нервной системы.
Рис.5. Холестерин в составе клеточной мембраны
Как трудно представить себе дом без фундамента, так невозможно вообразить эукариотическую клетку без этого вещества. Совместно с фосфолипидами холестерин обеспечивает их прочность и особую мультифункциональность [1], [2]. Так, оболочки эритроцитов содержат 23% холестерина, клеток печени — примерно 17%, митохондриальные мембраны — 3%. Миелиновое многослойное покрытие нервных волокон, выполняющее изоляционные функции, на 22% состоит из холестерина. В составе белого вещества мозга содержится 14% холестерина, а серого — 6%.
Холестерин служит также «сырьем» для производства стероидных гормонов коры надпочечников — гидрокортизона и альдостерона, — а также женских и мужских половых гормонов — эстрогенов и андрогенов [3]. У мужчин помешательство на бесхолестериновых продуктах может быть опасным для сексуальной активности [4].
Следует подчеркнуть, соблюдение бесхолестериновой диеты здоровыми (!) женщинами детородного возраста бессмысленно, поскольку до наступления климакса женские половые гормоны просто не дают холестерину откладываться на стенках сосудов (рис. 7).
Рис.7. Холестериновые бляшки кровеносных сосудов.
Никакие диеты им, как правило, потерей сексуальности не грозят [5]. А вот у женщин, страдающих гормональными и обменными расстройствами, нередко прекращаются «критические дни». Увлечение обезжиренными продуктами чревато существенным снижением гормона эстрадиола в лютеиновой фазе менструального цикла [6], что, несомненно, может привести к бесплодию. Кроме того, у таких женщин в фолликулярной фазе менструального цикла регистрируются повышенные уровни триглицеридов и липопротеинов очень низкой плотности [7], что, как будет сказано ниже, сокращает путь к атеросклерозу. Биологическая активность лактогенных гормонов (пролактина и соматотропина) лютеиновой фазы на 28% выше у женщин, потребляющих пищу, богатую жирами, по сравнению с теми, кто «сидит» на диете с низким содержанием жира [8]. Кормящим мамочкам стоит обратить на это особое внимание!
И уж совсем непозволительно экспериментировать с диетами беременным женщинам! Исследованиями сложных взаимоотношений холестерина и гормонов в организме матери и ее будущего ребенка установлено, что изменения в уровне липопротеинов могут вызвать нарушения в обмене стероидов, связанных с полом плода. Концентрации Х-ЛПВП в пуповинной крови новорожденных женского пола были выше, чем у новорожденных мужского пола, в то время как по уровням Х-ЛПНП различий не наблюдалось. В самом организме матери концентрации Х-ЛПНП и стероидов находились вне зависимости от пола ребенка, однако содержание Х-ЛПВП было выше в плазме женщин, родивших девочек [10].
Некоторые сокращения, используемые в разделе:
ПУТИ ХОЛЕСТЕРИНА
Биохимик Конрад Блох (он эмигрировал в Штаты из гитлеровской Германии) и его сотрудники в 1942 г. показали, что в организме человека синтез холестерина начинается с уксусной кислоты. Основные звенья биосинтеза холестерина: ацетат → холестерин → жирные кислоты → половые гормоны. Благодаря этому открытию стало ясно, что холестерин является необходимым компонентом всех клеток организма, и что все стероидные вещества в организме человека вырабатываются из холестерина. В 1964 г. К. Блоху совместно с Ф. Линеном была присуждена Нобелевская премия по физиологии и медицине «за открытия, касающиеся механизмов и регуляции обмена холестерина и жирных кислот».
Механизм внутриклеточного холестеринового гомеостаза сложен [27]. Содержание холестерина в клетке регулируется двумя путями. Первый из них контролирует продукцию холестерина по механизму обратной отрицательной связи. Второй связан с регуляцией его транспорта через клеточную мембрану из межклеточного пространства. Этот транспорт осуществляется при участии рецепторов липопротеидов низкой плотности (ЛПНП), о которых будет сказано ниже.
Баланс уровня холестерина в организме достигается благодаря процессам внутриклеточного синтеза, захвата из плазмы (преимущественно из ЛПНП), выхода из клетки в плазму (преимущественно в составе ЛПВП) [26]. Лимитирующая стадия синтеза холестерина в значительной мере определяется количеством холестерина, абсорбируемого в кишечнике и транспортируемого в печень. При недостатке этого вещества происходит компенсаторное усиление его захвата и синтеза. Иными словами, поскольку холестерин столь важен для нормальной жизнедеятельности организма, поступление его с пищей (экзогенный холестерин) дополняется синтезом в клетках почти всех органов и тканей (эндогенный холестерин), однако, как указывалось ранее, в значительных количествах он образуется в печени (80%), в стенке тонкой кишки (10%) и коже (5%).
Мозг и холестерин.
Генетическая природа холестериновых аномалий
В обмене холестерина принимают участие десятки ферментов, и мутация в каждом из кодирующих их генов может привести к нарушению работы всей системы. Известны, например, так называемые семейные формы гиперхолестеринемии [1], [28]. Эти нарушения липидного обмена связаны с мутацией генов, кодирующих рецепторы липопротеидов низкой плотности.
«ПЕРЕВОЗЧИКИ» ХОЛЕСТЕРИНА
Транспорт холестерина: В организме холестерин никогда не бывает сам по себе — он всегда связан с липидами. Будучи гидрофобным соединением, это вещество нерастворимо в воде и плазме крови. Холестерин может переноситься с током крови только в составе так называемых транспортных форм — липопротеинов (белково-липидных комплексов), представляющих собой сферические частицы (рис. 8), наружный (гидрофильный) слой которых образуют фосфолипиды и белки-апопротеины (или просто «апо»), а гидрофобное ядро составляют триглицериды (попросту говоря, жиры) и холестерин (точнее, эфир холестерина). Ядро — функциональный груз, который доставляется до места назначения. Оболочка же участвует в распознавании клеточными рецепторами липопротеиновых частиц и в обмене липидными частями между различными липопротеинами (то есть, служит своего рода контейнером) [30].
Рис.8. Белково-липидный комплекс.
«Перевозчик-1» (Хиломикрон)
Хиломикроны (ХМ) — самые большие по размеру (диаметр 80–500 нм), но самые маленькие по плотности. Они образуются в эндоплазматическом ретикулуме кишечника, секретируются в лимфу и затем через грудной проток попадают в кровь. Период полужизни ХМ составляет 5–20 минут. При попадании в кровоток хиломикроны теряют аполипопротеины А-1, А-11, А-1V, но приобретают аполипопротеины апоС и апоЕ. Фермент липопротеиновая липаза, находящаяся в капиллярах, гидролизует триглицериды сердцевины хиломикронов путем активации аполипопротеина С-11. Триглицериды поглощаются адипозными (жировыми) тканями и мышечными клетками, а образовавшийся липопротеиновый комплекс входит в состав ЛПВП.
«Перевозчик-2» (ЛПОНП)
Липопротеиды очень низкой плотности (ЛПОНП; их называют также пре-β-липопротеидами) являются транспортной формой эндогенных триглицеридов, на их долю приходится около 50–70% массы всех липопротеидных частиц, содержащих 90–92% липидов и 8–10% белков (аполипопротеины В-100, С-1, С-11, С-111, Е). Их плотность — менее 1,006 г/мл, диаметр частицы — 30–80 нм. Формируются в печени, из них образуются ЛПНП.
«Перевозчик-3» (ЛППП)
Липопротеиды промежуточной плотности (ЛППП) присутствуют в очень низких концентрациях и являются продуктом метаболизма ЛПОНП. Соотношение липидов и белка (аполипопротеины В-100, Е) в составе частиц непостоянно. Их плотность — 1,006–1,019 г/мл, диаметр частицы — 25–35 нм.
«Перевозчик-4» (ЛПНП)
Липопротеиды низкой плотности (ЛПНП; их называют также β-липопротеидами) являются основным переносчиком эндогенного холестерина в крови (около 70% общего холестерина плазмы). Плотность — 1,019–0,063 г/мл, диаметр частицы — 18–28 нм. Сферические частицы ЛПНП состоят на 80% из липидов, на 20% из белков, ключевым белком является аполипопротеин В-100 (АпоВ-100). В каждой частице ЛПНП только одна молекула АпоВ-100, которая располагается на ее поверхности. Там же располагается и холестерин, который после этерификации в качестве холестеринового эфира попадает внутрь сферы (рис. 9).
Рис.9. Строение сферической частицы Х-ЛПНП (частицы Х-ЛПВП имеют похожую организацию, их основной аполипопротеин — АпоА). В таком упакованном виде холестерин переносится из печени в ткани. Частицы ЛПНП варьируют по размеру, плотности, составу и физико-химическим свойствам, вследствие чего количество их субфракций может достигать 15. Обычно различают большие легкие, малые плотные и промежуточные. Большие легкие содержат 2750 молекул холестерина, малые плотные — 2100. Количественное распределение разных ЛПНП по субфракциям у разных людей может варьировать.
Липидное ядро ЛПНП почти полностью состоит из эфиров холестерина. Период полужизни ЛПНП в крови — 2,5 дня. За это время до 75% из них захватывается клетками печени, а остальные 25% попадают в другие органы. Чтобы холестерин попал в печень, ее клетки должны «выхватить» ЛПНП из кровяного русла. Для этого на поверхности каждой частицы и находятся сигнальные аполипопротеины (иногда для краткости их называют апопротеинами или апобелками), а на поверхности клетки-захватчицы — соответствующие им рецепторы. Именно за открытие в клетках печени специфического рецептора LXR (liver X receptor) для поглощения из крови избыточного Х-ЛПНП американские генетики Майкл Браун и Джозеф Голдстайн в 1985 году и получили Нобелевскую премию в области физиологии и медицины «за выдающиеся открытия, касающиеся обмена холестерина и лечения нарушений уровня холестерина в крови». Рецепторы имеют высокое сродство к ЛПНП и прочно связывают их. Основная функция LXR — обратный транспорт холестерина в печень, вывод с желчью, снижение кишечного всасывания [28], [31].
Метаболизм ЛПНП идет двумя путями. Первый путь — связывание с АпоВ/Е-рецепторами печени, клеток надпочечников и периферических клеток, включая гладкомышечные клетки и фибробласты. В норме рецептор-опосредованным путем из кровеносного русла удаляется около 75% ЛПНП. После проникновения в клетку частицы ЛПНП распадаются и высвобождают свободный холестерин. Существует обратная отрицательная связь: чем больше холестерина внутри клетки, тем хуже он поглощается. При избытке внутриклеточного холестерина он через взаимодействие с геном рецептора ЛПНП подавляет синтез рецепторов к ЛПНП и, наоборот, при низком уровне внутриклеточного холестерина синтез рецепторов к ЛПНП возрастает.
Альтернативный путь метаболизма частиц ЛПНП — окисление. Перекисно-модифицированные ЛПНП слабо распознаются Апо-В/Е-рецепторами, но быстро распознаются и захватываются так называемыми скэвенджерами (англ. scavenger — мусорщик) — рецепторами макрофагов [32]. Этот путь катаболизма ЛПНП, в отличие от рецептор-зависимого пути, не подавляется при увеличении количества внутриклеточного холестерина. Развитие этого процесса приводит к превращению макрофагов в переполненные эфирами холестерина «пенистые» клетки — компоненты жировых пятен [33]. Последние являются предшественниками атеросклеротической бляшки, за что липопротеиды низкой плотности считают «плохими» липопротеидами.
«Перевозчик-5» (ЛПВП)
Липопротеиды высокой плотности (ЛПВП) — самые мелкие липопротеидные частицы (плотность — 1,055–1,21 г/мл, диаметр частицы — 5–9 нм). Их также называют α-липопротеидами. На их долю приходится 20–30% общего холестерина крови, но из всех липопротеидов именно эти частицы содержат наибольшее количество фосфолипидов и белка (поровну). А-1, А-11, С-1, С-II, С-III, Е — апопротеины ЛПВП-частиц. Основной компонент ЛПВП — аполипопротеин А-1, составляющий около 30% всей частицы. Его функции — быть кофактором для реакции, осуществляемой LCAT (лецитин-холестерол-ацетилтрансферазой), и обеспечивать поглощение холестерина из клеток. Это ключевая стадия обратного переноса холестерина в печень для его дальнейшего распада. Синтезируется апоА-1 в тонком кишечнике и печени примерно в равных количествах.
По наличию аполипопротеина С различают три субфракции ЛПВП:
АпоС-1 активирует LCAT и ингибирует фосфолипазу А2. АпоСII — кофактор липопротеиновой липазы. АпоСIII защищает ремнантные липопротеины — продукты распада хиломикронов и ЛПОНП.
Синтезируются ЛПВП-С в кишечнике и печени в виде предшественников (дисковидных частиц), которые превращаются в сферические частицы уже в плазме.
Важную роль в метаболизме холестерина и стероидов играет рецептор-«мусорщик» SR-BI. Он был обнаружен в 1996 г. как рецептор для ЛПВП [34] при избирательном захвате холестерина в печени, надпочечниках, макрофагах, плазме.
«Перевозчик-6»
Но полиморфизм липопротеинов на этом не заканчивается. В последнее время идентифицирован еще и липопротеин ЛП(a) — опасный родственник ЛПНП. Собственно, это и есть ЛПНП, но с «довеском» в виде белка апопротеина (а), связанного с АпоВ дисульфидной связью. Синтезируется ЛП(a) в печени, а катаболизируется в почках, в отличие от других липопротеинов. Апо(а) — гликопротеин с очень большим содержанием нейраминовой кислоты и поэтому водорастворимый, в отличие от АпоВ-100. Белковая часть этого гликопротеина состоит из доменов типа «kringle» (крендель), имеющих гомологию с белками системы свертывания крови — плазминогеном, тканевым активатором плазминогена и фактором ХII. Количество доменов в молекуле апо(а) человеческой популяции варьирует от 12 до 51, а уровни ЛП(a) могут находиться в диапазоне от 1000 мг/л. Это предопределяется генетически, то есть не зависит ни от возраста, ни от пола, ни от диеты, ни от условий жизни, а потому понизить концентрацию ЛП(a) в крови практически невозможно ни изменением диеты, ни снижением массы тела, ни лекарственными препаратами [35]. Повышенные уровни ЛП(a) указывают на генетический риск грядущих коронарных событий и ишемических инсультов у лиц, в данный момент практически здоровых.
СУДЬБУ ХОЛЕСТЕРИНА В ОРГАНИЗМЕ ОПРЕДЕЛЯЮТ АПОЛИПОПРОТЕИНЫ
Или холестерин высвободится из «упаковки» и будет поглощен клетками для выполнения своих жизненно важных функций, или излишний холестерин будет удален из тканей и крови и упакован внутрь липопротеиновой частицы, которая унесет его в печень. Аполипопротеины являются структурными элементами, у которых гидрофильный участок контактирует с водными компонентами плазмы, тем самым обеспечивая перенос водонерастворимых липидов кровотоком. Они служат лигандами для рецепторов специфических липопротеинов (например, обеспечивающих первую стадию поглощения липидов клетками). Наконец, некоторые из них — это кофакторы липолитических ферментов, обеспечивающих метаболизм холестерина и липопротеинов.
Основной компонент ЛПВП — аполипопротеин А1, тогда как ключевым компонентом ХМ, ЛПОНП, ЛППП, ЛПНП является аполипопротеин В. Именно он обеспечивает выемку холестерина из «упаковки» и передачу его в клетки, отвечает за способность липопротеинов переносить холестерин из печени в ткани, необходим для образования липопротеинов, богатых триглицеридами. Аполипопротеин В отличается полиморфизмом и встречается в двух формах:
«ПЛОХОЙ» и «ХОРОШИЙ» ХОЛЕСТЕРИН
Термины «плохой» и «хороший» холестерин возникли после того, как было установлено, что в организме холестерин никогда не бывает сам по себе — он всегда связан с липидами [36]. Различные классы липопротеинов по-разному причастны к возникновению атеросклероза. Так, атерогенность липопротеинов частично зависит от размера частиц. Самые мелкие липопротеиды, такие как ЛПВП, легко проникают в стенку сосуда, но так же легко ее покидают, не вызывая образования атеросклеротической бляшки. За это их и называют «хорошими» липопротеинами. ЛПНП, ЛППП и ЛПОНП при окислении легко задерживаются в сосудистой стенке. ЛПНП — наиболее атерогенные липопротеины крови.
А вот хиломикроны сами по себе неатерогенны: они слишком велики, вследствие чего неспособны проникать в сосудистый эпителий и вызывать эндотелиальные дисфункции. Но когда их триглицеридная «начинка» расходуется, их остатки (remnants) сильно уменьшаются в размерах и приобретают потенциальную атерогенность. Такие ремнантные частицы содержат экзогенный (пищевой) холестерин, апоВ-48 и апоЕ. Именно маленький размер ремнантных хиломикронов позволяет им проникать через стенки артерий и связываться со специфическими участками на тканевых макрофагах, вызывая их превращение в «пенистые» клетки и запуская медленный воспалительный процесс в стенках артерий (об этом — чуть позже). В норме апоЕ, расположенный на поверхности таких частиц, в печени связывается с рецепторами Х-ЛПНП и там же утилизируется. Но до этого момента ремнантные частицы (теоретически) могут успеть реализовать свою потенциальную атерогенность, особенно, если печень нездорова (например, поражена вирусом гепатита С) [37]. В общем, именно высвобождение из хиломикронов триглицеридов и последующая неэффективная утилизация ремнантных ХМ и повышают риск атерогенеза [38].
Большая часть того того, что известно о «хороших» и «плохих» свойствах холестерина, касается именно липопротеинов — «перевозчиков». Холестерин, связанный с липопротеинами низкой, промежуточной и очень низкой плотности, стали называть «плохим», а связанный с не имеющими отношения к атеросклерозу липопротеинами высокой плотности — «хорошим» [39]. Это стало очевидным из многочисленных проспективных исследований, в которых было доказано, что повышение уровня «плохого» Х-ЛПНП и понижение концентрации «хорошего» Х-ЛПВП увеличивает риск возникновения и развития атеросклероза, риски фатальных и нефатальных инфарктов миокарда и ишемических инсультов [40], [41].
Полученные результаты послужили платформой для разработки рекомендаций по снижению концентрации «плохого» холестерина, ставших, как считали, основой профилактики атеросклероза и стратегической целью диетического и медикаментозного вмешательства. Но, как оказалось, все не так просто, и остались вопросы.
Размер частиц Х-ЛПНП был признан предиктором возникновения и развития ССЗ и последующих острых коронарных событий. В марте 2006 года на страницах одного из самых престижных медицинских журналов появился манифест, подписанный тридцатью специалистами из десяти стран [44]. Он призывает к установлению новых правил оценки риска ССЗ. Предлагается заменить общепринятое определение в плазме общего холестерина, Х-ЛПНП и Х-ЛПВП на измерение концентраций АпоВ и АпоА — основных апопротеинов Х-ЛПНП и Х-ЛПВП, соответственно. Именно показатель баланса атерогенных и антиатерогенных частиц АпоВ/АпоА — самый точный индикатор риска ССЗ у лиц с бессимптомными сердечнососудистыми заболеваниями и диабетиков.
К сожалению, уменьшение размера частиц Х-ЛПНП — далеко не все, что делает «плохой» холестерин «еще хуже». Оказалось, что избыточная концентрация глюкозы в крови диабетиков приводит к нарушению обмена холестерина, а главная причина их смертности — ССЗ, вызванные гиперхолестеринемией. В основе такой причинно-следственной связи лежит гликозилирование — неферментативное присоединение глюкозы к апопротеину, в результате чего химически модифицированный АпоВ делает частицы Х-ЛПНП более атерогенными. А это приводит к выводу, что у двух лиц с одинаковым количеством частиц Х-ЛПНП одинакового размера могут быть разные уровни гликозилированного АпоВ и, стало быть, разные судьбы. И закономерно возникает вопрос: можно ли считать нарушение метаболизма холестерина и изменение размера частиц Х-ЛПНП единственными причинами атеросклероза? Ведь изменения концентраций «плохого» холестерина не объясняют всех случаев ССЗ: примерно половина сердечных приступов и ишемических инсультов происходят при нормальных уровнях холестерина.
ИНФЕКЦИИ И АТЕРОСКЛЕРОЗ
Было установлено, что в атеросклеротических повреждениях стенок сосудов всегда обнаруживается миелопероксидаза (МПО) — центральный нападающий неспецифического иммунитета. Этот гем-содержащий фермент выполняет одну из ключевых функций в микробицидной системе, опосредованной нейтрофилами. Супероксидные анионы, являющиеся продуктами окислительного и нитрозативного стресса, повреждают не только микроорганизмы, но и ткани макроорганизма. На то он и неспецифический иммунитет! Это происходит при многих воспалительных процессах [45], в том числе и при атеросклерозе. Высокореактивные соединения окисляют и модифицируют в «плохом» Х-ЛПНП практически все его компоненты, вследствие чего пусть «плохой», но «свой» Х-ЛПНП превращается в окисленный и уже «чужой» о-Х-ЛПНП. И тут иммунная система начинает его уничтожать. Макрофаги, признав в модифицированном АпоВ чужака, интенсивно поглощают о-Х-ЛПНП, превращаясь в «пенистые» клетки, перегруженные окисленными фосфолипидами и холестерином [46]. Медленный воспалительный процесс запущен! (рис. 10).
Несмотря на то, что между атеросклерозом, повышенным уровнем о-Х-ЛПНП и хроническими инфекциями существует определенная связь, атеросклероз инфекционным заболеванием не является. Хронические инфекции могут лишь приводить к его возникновению и развитию [47].
Рис.10. Строение атеросклеротической бляшки, образовавшейся в результате воспалительного процесса. «Воспалительная» теория утверждает, что атеросклероз — это вызываемый неспецифическим иммунитетом вялотекущий воспалительный процесс в стенках сосудов.
ЛИПОПРОТЕИДЫ ВЫСОКОЙ ПЛОТНОСТИ
Мы помним, какие хорошие ЛПВП! Ведь они удаляют избыточный холестерин из клеток органов, тканей и крови, то есть проявляют антиатерогенные свойства. Помимо этого, частицы ЛПВП, содержащие «хороший» холестерин (Х-ЛПВП), обладают многими другими положительными характеристиками [50], [51]:
Количественный вклад каждого из этих факторов в понижении риска атерогенеза пока не ясен, но в целом их значение трудно переоценить [28].
ВОСПАЛИТЕЛЬНАЯ ТЕОРИЯ АТЕРОГЕНЕЗА
Причины возникновения атеросклероза и механизм его развития на сегодня нельзя считать окончательно установленными. Как видно из сказанного выше, наряду с традиционной «инфильтративной» теорией атерогенеза сосуществует «воспалительная» теория, утверждающая, что атеросклероз — это вызываемый неспецифическим иммунитетом вялотекущий воспалительный процесс в стенках сосудов. Нельзя сказать, что новые теории возникновения атеросклероза скрывают от общественности, их просто редко освещают.
Неузнаваемо преобразились методические возможности изучения атеросклероза. Сегодня ученые в его возникновении и формировании выделяют четыре определяющих механизма:
В каждом из них обнаружено не одно патологическое звено, формирующее в конечном итоге тот комплекс патогенетических факторов, которые определяют возникновение атеросклеротических изменений в стенке сосуда [32]. Многочисленными эпидемиологическими исследованиями было показано, что атеросклероз — это полиэтиологическое заболевание. Приписывание холестерину всех напастей в настоящее время вызывает у специалистов, вырвавшихся из плена «инфильтративной» теории, все больше и больше сомнений.
В процессе формирования атеросклероза состояние сосудистой стенки играет не меньшую роль, чем нарушения липидного обмена. Право на жизнь получила теория, основанная на том, что для возникновения болезни необходимо повреждение стенки сосуда (механическое, химическое или иммунологическое).
Нарушение функции эндотелия могут вызвать многие факторы: гемодинамические (артериальная гипертония), избыточный уровень гормонов (гиперинсулинемия), инфекции, токсичные соединения и др. Оказалось, что в местах, предрасположенных к формированию атеросклероза, происходит, прежде всего, трансформация клеток. В этих областях сосудов вместо дифференцированных, четко отграниченных клеток эндотелия появляются крупные многоядерные клетки неправильной формы. Меняются и входящие в состав стенки сосуда гладкомышечные клетки — они увеличиваются в размерах, вокруг их ядер накапливается коллаген [33]. Именно этот факт имеет большое значение в понимании процесса развития атеросклероза у больных с нормальным и даже пониженным содержанием холестерина в крови. Возможно, образование холестериновых бляшек — это патологическое развитие защитной реакции, направленной на устранение дефекта в стенке сосуда, и холестерин здесь не причина, а следствие (рис. 11).
Рис.11. От повреждения эндотелия до инфаркта.
ГОМОЦИСТЕИН
Среди факторов, повреждающих стенки сосудов, в последнее время особый акцент делается на гомоцистеин [55]. В 1995 году научный мир потрясло известие о том, что ученые открыли «новый холестерин» [56], хотя это соединение впервые описали еще в 1932 году, а гомоцистеиновая теория атеросклероза возникла еще в 1969 году. До недавнего времени о гомоцистеине практически не говорили, однако сегодня трудно найти авторитетное медицинское издание, которое бы не обсуждало важную роль нарушений его метаболизма в развитии сердечнососудистых и ряда других заболеваний [57].
Рис. 12. Гомоцистеин — непротеиногенная аминокислота
Гомоцистеин — это промежуточный продукт обмена незаменимой аминокислоты метионина. В окончательные соединения, вырабатываемые организмом, он не входит. В норме гомоцистеин живет в организме очень короткое время и под воздействием фолиевой кислоты и витамина В12 рециклируется обратно в метионин или под влиянием витамина В6 превращается в следующий продукт обмена — цистотионин. Различные наследственные и приобретенные нарушения в организме приводят к тому, что гомоцистеин не утилизируется. В этом случае он накапливается в организме и становится для него опасным. Главное негативное его действие заключается в том, что он, обладая цитотоксичностью, поражает внутреннюю стенку артерий — интиму, покрытую эндотелием [58]. Образуются разрывы эндотелия, которые организм пытается чем-то заживить. Вот тогда он и использует для этого холестерин и другие жирные субстанции.
Даже очень маленькие количества гомоцистеина могут оказывать достаточно сильное действие на сосуды, поэтому нормы этого вещества для человека практически не существует, хотя и принято считать уровень гомоцистеина в крови натощак в диапазоне 5–15 мкМ/л нормальным. Концентрация этого вещества в крови в 1000 раз меньше, чем холестерина, и повышение его уровня всего на 20–30% может вызвать тяжелые последствия [59]. Установлено, что гомоцистеин вклинивается в холестериновый гомеостаз нейронов, а совместное действие с холестерином в присутствии меди существенно повышает уровни реактивных кислородных радикалов, делая нейроны более уязвимыми к амилоиду-β. Гипергомоцистеинемия является фактором риска деменции [60], [61].
«Фолиум» в переводе с латинского означает «лист». Поэтому неудивительно, что естественным источником фолиевой кислоты являются салаты, капуста, сельдерей, лук, зеленый горошек, спаржа. Немало фолатов и в цитрусовых, бананах, авокадо, свежих грибах, свекле, зерновых, гречневой и овсяной крупах, пшене, орехах и др. Однако следует иметь в виду, что беременные женщины не должны злоупотреблять этим витамином. Как показали результаты исследований, дети, родившиеся у матерей с высокими уровнями фолиевой кислоты во время беременности, имеют повышенный риск развития астмы.
Фолиевая кислота прежде ничем не выделялась среди своих собратьев-витаминов. Но в последнее время она стала настоящим возмутителем спокойствия. Именно недостатком в организме человека этого витамина многие ученые объясняют теперь возникновение главной болезни цивилизации — атеросклероза [63].
Гомоцистеиновая теория весьма убедительно объясняет причины возникновения и патогенез атеросклероза, хотя, как и другие теории, не дает исчерпывающих ответов на все поставленные вопросы.
ПОЛЬЗА И ВРЕД СТАТИНОВ
Статины — вещества, специфически подавляющие активность 3-гидрокси-3-метилглутарил КоА редуктазы, фермента, необходимого для одного из первых этапов синтеза холестерина, — были открыты в 1976 году. В этот список входят ловастатин (мевакор), правастатин (правакол), симвастатин (зокор), флувастатин (лескол), аторвастатин (липитор). И он постоянно пополняется, несмотря на неоднозначные результаты применения статинов в клинической практике.
«Организм человека физиологически и биохимически является настолько точно и тонко скоординированной системой, что длительное вмешательство в тот или иной естественный жизненный процесс не может остаться без разнообразных, часто неожиданных последствий» [1].
Так, женщинам пожилого нерепродуктивного возраста прием статинов категорически противопоказан, так как эти препараты повышают риск диабета 2 типа [64]. По сравнению со сверстницами, не принимающими гипохолестеринемические средства, у них риск этого заболевания выше на 48% [65]. В мета-анализе двух недавно проведенных широкомасштабных плацебо-контролируемых исследований установлено, что статиновая терапия повышает риск диабета 2 типа на 9–13% по сравнению с контролем [66].
Частый побочный эффект такого лечения — миопатия — приводит к слабости и атрофии мышц. Наше сердце тоже мышца, причем самая главная, а ее кровоснабжение в первую очередь страдает при атеросклерозе. И если на эту уже больную мышцу подействовать статинами, нетрудно представить, что за этим может последовать.
Был сделан вывод, что статины действительно снижают риск ССЗ у людей среднего возраста, тогда как у людей в возрасте 75–85 лет способствуют повышению частоты их смертности.
ЗАКЛЮЧЕНИЕ ПО РАЗДЕЛУ О ХОЛЕСТЕРИНЕ И АТЕРОСКЛЕРОЗЕ
Традиционные подходы к этиопатогенезу атеросклероза, основанные на исключительной роли клеток, тканей, либо органов человека, больше не способны дать новых конструктивных идей, позволяющих разрабатывать высокоэффективные формы и методы профилактики и лечения. В этой связи микрофлора (кишечный микробиом) является важнейшим фактором регулирования атеросклеротических процессов. Микроэкологические нарушения в организме человека следует считать пусковыми механизмами нарушений липидного обмена.

И напоследок стоит отметить, что поддержание кишечного микробиома в норме способствует снижению сердечно-сосудистого риска. Так, например, исследование экспертов университета Ноттингема и Королевского колледжа Лондона в 2018 г. показало, что у всех женщин существует значительная корреляция (взаимосвязь) между разнообразием микробов в кишечнике и здоровьем артерий. После коррекции метаболических изменений и артериального давления показатель жесткости артерий был выше у женщин с меньшим разнообразием здоровых бактерий в кишечнике. Также, в др. исследованиях было показано, что с возрастом микробиота кишечника начинает производить токсичные молекулы, включая ТМАО (триметиламиноксид), которые попадают в кровоток, вызывают воспаление, окислительный стресс и повреждают ткани сосудов. При этом, ТМАО, показанный в ранних исследованиях, был связан с повышенным риском атеросклероза, инфаркта и инсульта. Таким образом, все результаты доказывают, что поиск диетических мер воздействия для улучшения здоровых бактерий в кишечнике может быть использован для снижения риска сердечных заболеваний. Подробнее об этом см. по ниже приведеннным ссылкам:
К разделам:
Будьте здоровы!
Источник: Шаланда А. О холестерине замолвите слово. Сага в семи частях. Коммерческая биотехнология, 2005
Литература
ССЫЛКИ К РАЗДЕЛУ О ПРЕПАРАТАХ ПРОБИОТИКАХ