какую функцию выполняет гликокаликс
Какую функцию выполняет гликокаликс
В основе многих патологических состояний лежат расстройства эндотелия. Общепринято, что микроальбуминурия при гломерулонефрите, преэклампсии и сепсисе связана с дисфункцией эндотелия. Полиангиопатии, характерные для сахарного диабета, также являются следствием поражения эндотелия. Однако механизмы этих расстройств до последнего времени оставались не до конца понятными. Причиной эндотелиальной дисфункции долгое время считалась сама эндотелиальная клетка, при том что еще в 50-х годах ХХ века на поверхности эндотелиальных клеток обнаружено некое однородное нечеткое покрытие [1], которому в то время не придали особого значения. Как выяснилось впоследствии, именно оно оказалось защитной стеной между кровотоком в сосуде и поверхностью самого эндотелиоцита [2]. Это образование, состоящее из гликопротеинов, протеогликанов и глигозаминогликанов [3, 4] и являющееся интегральной частью эндотелия, получило в дальнейшем название «гликокаликс». Последующие исследования выявили фундаментальную роль, которую играет гликокаликс в процессах регуляции кровотока, воспаления и коагуляции.
В этом обзоре мы постараемся рассмотреть строение и физиологию гликокаликса, а также патофизиологию и клиническое значение повреждения и полного уничтожения гликокаликса.
Краткая предыстория вопроса или «откуда он взялся?»
Наличие слоя протеинов на эндотелии впервые постулировано J. Danielli в 1940 г. [5]. В середине 50-х годов XX века G. Palade одним из первых указал на наличие однородного нечеткого покрытия на поверхности эндотелиальных клеток [1].
До того, как термин «гликокаликс» стал общепризнанным, эту структуру именовали как «клеточная стенка», «поверхностный клеточный слой», «мукозное антигенное покрытие», «кутикулярный эритроцитарный антиген» и др. [1, 6, 7]. В 1963 г. H. Bennett [8] предложил термин «гликокаликс» как общее название для этого «внеклеточного сахаридного покрытия», где бы оно ни находилось. Гликокаликс по-гречески означает «сладкая оболочка».
Визуализация гликокаликса сдерживалась отсутствием необходимых методик окрашивания и фиксации, которые не разрушали бы эту хрупкую структуру [3]. В 1966 г. J. Luft [7] был первым, кто предложил использовать рутений красный для визуализации гликокаликса при электронной микроскопии и выявил «тонкую структуру капилляров и эндокапиллярного слоя». Исследования физиологической роли гликокаликса начались в 70-х годах XX века с изучения изменений капиллярного гематокрита, вызванных как физиологическими раздражителями, так и разрушением гликокаликса [9, 10].
В 2003 г. B. van den Berg [4] с помощью электронной микроскопии визуализировал ворсинчатую структуру гликокаликса левого желудочка сердца крысы (рис. 1). 
Строение и свойства
Гликокаликс — это сложная гелеподобная структура, расположенная между протекающей кровью и эндотелиально-клеточной стенкой сосуда. Современные методики позволяют визуализировать гликокаликс, он обнаружен на протяжении всего сосудистого русла от крупных сосудов до мельчайших капилляров [3—6]. Его общая площадь у человека составляет в среднем 350 м 2 [6].
Гликокаликс вырабатывается эндотелием и располагается в критической зоне раздела тока крови и эндотелиальных клеток [11]. Гликопротеиновый гликокаликс окутывает весь здоровый сосудистый эндотелий. Это составная часть сосудистого барьера [11, 12]. Он взаимодействует с белками и липидами плазмы [13]. Состав и размеры гликокаликса непрерывно меняются, так как протекающая плазма постоянно слущивает его молекулы [14]. Толщина гликокаликса различна на всем протяжении сосудистого русла и составляет по одним данным от 0,1 до 1 мкм [15], по мнению других исследователей, достигает 3 мкм [5]. Толщина гликокаликса в микрососудах может быть определена в подъязычных тканях методом ортогональной поляризационной спектральной визуализации и хорошо коррелирует с результатами дилюционных методик [16] (рис. 2). 
Гликопротеины и протеогликаны формируют основу гликокаликса [6, 11]. Гликопротеины, как правило, это то, что мы себе представляем как рецепторы на поверхности клетки: селектины, интегрины и другие функционально-динамические белки клеточной поверхности [17].
Протеогликаны играют роль стромы гликокаликса и состоят из стволовых белков, плотно прикрепленных к клеточной мембране, к которым в свою очередь прикрепляются отрицательно заряженные боковые цепочки гликозаминогликанов (ГАГ). Протеогликаны различаются по размеру своих протеиновых основ, количеству прикрепленных ГАГ и способам крепления к мембране клетки. Некоторые протеины гликокаликсной основы прочно прикреплены к мембране клетки посредством мембранно-связующего домена (синдеканы), другие — с помощью гликозилфосфатидилинозитолового якоря (глипиканы). Остальные белки основы — перлеканы, версиканы, декорины, бигликаны и мимеканы секретируются после прикрепления боковых цепей ГАГ [5].
Гликопротеины и протеогликаны синтезируются и формируются в несколько этапов по мере того, как они внутриклеточно выделяются из эндоплазматического ретикулума к аппарату Гольджи и, наконец, соединяются с мембраной клетки [17].
ГАГ можно рассматривать как растворимые соединения, в виду того что они синтезируются внеклеточно и позже связываются с протеогликанами и гликопротеинами.
Известны 5 типов гликозаминогликановых цепей: гепарансульфат (ГС), составляющий 50—90%, а также гиалуроновая кислота (ГК) (гиалурононан), хондроитин-, дерматан- и кератинсульфат. Некоторое время назад считали, что ГК — единственная из ГАГ, не связанная с белковой основой и образующая вязкие растворы с водой [4]. Однако затем установлено, что ГК связывается с эндотелиальным поверхностным рецептором CD44 [18, 19]. Именно взаимодействие ГК/CD44 обусловливает фильтрующие свойства молекулярного сита гликокаликса [19].
Гликокаликс формирует на поверхности эндотелиальной клетки сетчатую структуру, позволяющую связывать белки плазмы и растворимые ГАГ [3, 5, 13]. Гликокаликс сам по себе не активен, но как только компоненты плазмы связываются с ним, он формирует физиологически активный эндотелиальный поверхностный слой (ЭПС) [20].
Гликопротеины играют роль молекул адгезии и, участвуя в коагуляции, являются частью систем гемостаза и фибринолиза. Молекулы клеточной адгезии делятся на селектины (Е и Р), интегрины и иммуноглобулины. Гистамин и тромбин стимулируют экспрессию Р-селектина, тогда как интерлейкин (IL-1), фактор некроза опухоли α (TNF-α) и липополисахариды стимулируют экспрессию Е-селектина. Интегрины связаны с коллагеном, фибронектином и ламинином в субэндотелиальный матрикс и регулируют взаимодействие тромбоцитов с эндотелиальной клеткой.
Иммуноглобулины включают интерцеллюлярные молекулы адгезии 1-го и 2-го типов (ICAM-1, ICAM-2), молекулы адгезии сосудистого эндотелия 1-го типа (VCAM-1) и тромбоцитоэндотелиальные молекулы адгезии 1-го типа (PECAM-1). Они являются лигандами для интегринов на лейкоцитах и тромбоцитах, участвуя в адгезии к эндотелию и в диапедезе [5].
Гликокаликс имеет отрицательный заряд, что определяет его взаимодействие с компонентами плазмы. Отрицательный заряд зависит от сульфатации боковой цепи ГАГ, тип которой изменяется во времени, а также под влиянием физиологических и патофизиологических стимулов. Изменения в типе сульфатации влияют на связывание белков и сосудистую проницаемость [5].
Заряженная сетка гликокаликса действует как макромолекулярное сито [3], отталкивая отрицательно заряженные молекулы, а также эритроциты и тромбоциты [4]. Макромолекулы массой более 70 кДа отторгаются гликокаликсом. Несмотря на то что альбумин имеет сетевой отрицательный заряд и массу 67 кДа, он крепко связывается с гликокаликсом благодаря своей амфотерной природе, к тому же, он несет слабый положительный заряд вдоль белковой цепи [6]. Связка гликокаликс—альбумин снижает гидравлическую проводимость через сосудистый барьер [11]. Некоторое количество альбумина проникает через гликокаликс с коэффициентом отражения 0,75—0,95 для различных типов капилляров [21]. В норме альбумин проникает через гликокаликс в интерстиций со скоростью 5% от его общего плазменного объема в час [21].
Гликокаликс отталкивает эритроциты. Это выглядит как зона отчуждения, идущая параллельно эндотелиальному слою и выстраивающая эритроциты в центрированную колонну. Эта зона отчуждения суживается при повреждениях гликокаликса [5].
Гликокаликс демпфирует взаимодействие тромбоцитов и лейкоцитов. Во-первых, его отрицательный заряд отталкивает клетки, а во-вторых, молекулы адгезии, такие как PECAM, VACM и ICAM, скрывающиеся внутри его структуры [5, 15], становятся менее доступными. Интегрины и селектины способствуют адгезии моноцитов и многоядерных нейтрофилов. Кроме того, ICAM-1, ICAM-2, VCAM и PECAM участвуют во взаимодействии клеток крови со стенкой сосуда и адгезии во время диапедеза [22].
Как уже сказано, вся структура гликокаликса в целом вместе с находящимися в нем молекулами и экстравазированной плазмой называется эндотелиальным поверхностным слоем (ЭПС). Он защищает эндотелиальные клетки от избыточного слущивания, вызванного током крови [6]. Вместе с тем повышение слущивания эндотелия вызывает увеличение синтеза оксида азота, который в свою очередь расширяя сосуды, уменьшает стресс [23]. Эндотелиальные клетки пупочной вены человека под воздействием слущивания удваивают продукцию ГК в гликокаликсе. Это также является механизмом, способным компенсировать слущивание [13]. Повреждения гликокаликса нарушают оба эти механизма и снижают устойчивость эндотелия к слущиванию [24].
Связывание лигандов и ферментов с эндотелиальным гликокаликсом способствует клеточной сигнализации и ферментативной модификации [5], например, функционирование фактора роста фибробласта зависит от взаимодействия лиганда и рецептора внутри гликокаликса [25]. Гликокаликс вовлечен также и в липолитическую систему, так как связывает липазу липопротеина с ее лигандом [4].
Некоторые антикоагулянтные медиаторы могут связываться с гликокаликсом. Антитромбин III является ингибитором тромбина и активированных факторов IX и Х. Его антикоагулянтная активность увеличивается при присоединении к ГС, который является одним из ГАГ, обнаруживаемых в гликокаликсе. Гепариновый кофактор II активируется дерматансульфатом, также находящимся в гликокаликсе. Тромбомодулин продуцируется эндотелиальными клетками и содержит еще один ГАГ, хондроитинсульфат, который взаимодействует с тромбином при активации антикоагулянтного каскада протеина С. Ингибитор каскада тканевого фактора связывается с ГС и ингибирует VIIa и Ха [22].
Еще одним механизмом, с помощью которого гликокаликс защищает эндотелий, является его способность связывать ферменты, блокирующие свободные радикалы кислорода, такие как внеклеточная супероксиддисмутаза. Эти ферменты помогают снизить окислительный стресс и поддерживать биодоступность NO, предотвращая таким образом эндотелиальные дисфункции [4].
Скорее всего, до полноты представления о строении и функциях гликокаликса еще достаточно далеко, и исследователи находятся лишь в начале пути.
Деструктивные факторы и слущивающий (shear) стресс
ЭПС на удивление хрупок. Например, ишемия с реперфузией разрушают ЭПС воздействием свободных кислородных радикалов. Так, 20-минутная ишемия при температуре 37 °C с последующей реперфузией способна вызвать почти полное разрушение гликокаликса [26].
Сосудистый эндотелий — одна из самых первых структур, вовлекаемых в синдром системного воспалительного ответа [15]. Сосудистый эндотелий повреждается при воздействии TNF-α и бактериального липополисахарида. Тучные клетки, активированные TNF-α, высвобождают цитокины, протеазы, гистамин и гепариназу, что усугубляет деструкцию гликокаликса.
Потеря ГАГ ведет к утончению и уплотнению гликокаликса. При этом теряются в основном ГС, хондроитинсульфат и ГК [27, 30]. Уплотнение гликокаликса при потере ГАГ сохраняет его способность препятствовать капиллярной утечке, несмотря на уменьшение толщины и возможное увеличение проницаемости [27]. Уплотнение гликокаликса, появление циркулирующих в плазме ГС [28, 29], ГК [30] или хондроитина [31] служат маркерами повреждения гликокаликса. Это называют «линькой», «слущиванием» или «слущивающим стрессом» (shear-stress) [11, 32] (рис. 3). 
Концентрация синдекана — протеогликана, важнейшего компонента гликокаликса, возрастает в плазме при усиленном слущивании последнего [28, 33, 34].
К настоящему времени известны медиаторы воспаления, разрушающие гликокаликс, включают С-реактивный белок [35], стимуляторы рецептора аденозина А3 [36, 37], TNF-α [38], брадикинин [39] и триптазу тучных клеток [40].
Из результатов последних клинических исследований становится очевидным, что гликокаликс повреждается при системных воспалительных состояниях и других расстройствах, таких как сепсис [33, 41], гипергликемия [42], хирургическая агрессия [28], травма [34] и сахарный диабет [30].
Последствия деструкции гликокаликса от слущивающего стресса нарушают морфологию эндотелиоцитов и влияют на их функциональные возможности [32]. Разрушение гликокаликса может приводить к капиллярной утечке, отеку, резкому воспалению, агрегации тромбоцитов, гиперкоагуляции и потере сосудистой управляемости [15] (рис. 4). 
Повышенная концентрация ГАГ в плазме обнаружена у больных септическим шоком и, как выяснилось, приводила к снижению антибактериальных свойств плазмы [43]. Высокие плазменные концентрации компонентов гликокаликса, отмеченные у септических больных, свидетельствуют о его деструкции и коррелируют с высокой летальностью [43]. Ряд других молекул, выделенных из эндотелия и плазмы и участвующих в процессах коагуляции и воспаления, содержатся в гликокаликсе.
Гипергликемия является одним факторов, разрушающих гликокаликс. У больных сахарным диабетом I типа толщина гликокаликса в 2 раза меньше, чем у здоровых, а у больных диабетом с микроальбуминурией гликокаликс еще тоньше [30]. В том же исследовании у больных диабетом в плазме отмечены высокие концентрации ГК и гиалуронидазы вследствие повышенного слущивания в поврежденном гликокаликсе. При гипергликемии повреждение может быть вызвано кислородными радикалами либо активацией ферментов, деградирующих гликокаликс. Очевидно, что необходимы дальнейшие исследования по изучению вклада расстройств ЭПС в патогенез микроангиопатий при диабете [30, 42, 44].
Гликокаликс утончается при употреблении пищи с высоким содержанием жиров и холестерина, способствуя атерогенезу [45]. Инфузии клинически значимых доз окисленного липопротеина низкой плотности вызывают деструкцию гликокаликса у хомяков и приводят к локальной адгезии тромбоцитов [46].
Быстрая внутривенная инфузия кристаллоидов в опытах на добровольцах приводила к значительному повышению уровня ГК в плазме и поэтому была опасной [47]. У пациентов после острой гиперволемической гемодилюции в качестве процедуры предоперационного кровосбережения 60% инфузированного объема уходило в интерстициальное пространство в течение нескольких минут [48]. Массивная кровопотеря и сопровождающая ее ишемия с реперфузией также являются факторами деструкции [49].
Применение аппарата искусственного кровообращения (АИК) во время оперативных вмешательств также разрушает гликокаликс [47]. Гиповолемия повреждает гликокаликс и является триггером выброса предсердного натриуретического пептида, который оголяет ЭПС [50, 51]. В исследовании, проведенном еще в 1983 г., показано, что лидофлазин, блокатор кальциевых канальцев, ныне ассоциируемый с купированием желудочковых аритмий и пролонгацией интервала QT, защищал гликокаликс пациентов во время операций с АИК [52].
Нормальное функционирование почек возможно только при неповрежденном гликокаликсе. Только 0,06% альбумина может в норме проникать через почечный фильтр, при том что поры в гломерулярном слое значительно больше молекулы альбумина. Возможно, это происходит за счет отрицательного заряда гликокаликсного выстилающего слоя [53]. Микроальбуминурия является свидетельством системной эндотелиальной дисфункции и сердечно-сосудистых осложнений не только у больных диабетом, но также пациентов с обычной гипертензией и женщин с преэклампсией [54, 55].
Исследования с липидными каплями позволили определить, что толщина зоны отчуждения эритроцитов над гломерулярной эндотелиальной поверхностью составляет 175 нм. Причем под влиянием гиалуронидазы, гепариназы и хондроитиназы она еще более уменьшается. Деструкция гликокаликса увеличивает проницаемость гломерулярного капилляра для обычного альбумина, но не для фиколла (электрически нейтральный альбумин), свидетельствуя, что нарушения гликокаликса ведут к потере электрической избирательности [54]. После выполнения хирургических вмешательств на коронарных и периферических артериях отмечено возрастание плазменных концентраций компонентов эндотелиального слоя [15]. Электронная микроскопия позволяет выявлять обнаженные эндотелиальные клетки со слущенными и смытыми ГАГ, увеличением транссудата и проницаемости для коллоидов [56].
Маркеры деструкции гликокаликса
Из сказанного выше очевидно, что большинство, если не все, патологические состояния в организме связаны с той или иной степенью деструкции гликокаликса; поэтому возрастает актуальность вопроса прижизненной диагностики степени деструкции и дисфункции гликокаликса.
Микроальбуминурия
Появление и нарастание микроальбуминурии в сочетании с увеличением сосудистой проницаемости, выражающейся в появлении отеков, является следствием деструкции гломерулярного эндотелиума, часто наблюдаемой в клинике при остром септическом поражении почек [57]. У ряда пациентов соотношение микроальбуминурия/креатинин мочи (МАКС) коррелирует с оценкой тяжести в баллах по шкалам Surgical Stress Score [58], SOFA [59], APACHE II [60], Injury Severity Score [61] и SAPS II, а также с длительностью искусственной вентиляции легких и индексом оксигенации (PaO2/FiO2) [62]. У пациентов с сепсисом высокие уровни МАКС появляются раньше, чем увеличение уровней С-реактивного белка и прокальцитонина [63]. Уровень микроальбуминурии сам по себе может служить маркером тяжести септического процесса [64].
Синдекан-1
Уровень синдекана-1, циркулирующего в кровотоке, зависит от степени эндотелиального повреждения и деструкции гликокаликса, а также коррелирует с уровнями воспалительных цитокинов [65]. У пациентов с травмой он ассоциируются с различными коагулопатиями и высокой летальностью [34]. Так как уровень синдекана-1 у больных с сепсисом выше, чем у остальных хирургических пациентов, он может служить биомаркером более тяжелой деструкции гликокаликса, учитывая, что синдекан-1 является белком его основы [33].
Эндокан
Эндокан является еще одним белком основы гликокаликса и может выделяться из него при воздействии IL-1 и TNF-α. Он может служить биомаркером у больных сепсисом. Величина свободного эндокана в плазме коррелирует со степенью тяжести септического процесса [66]. Высокие уровни эндокана в плазме у пациентов с тяжелой травмой ассоциируются с острым легочным поражением [67]. Таким образом, эндокан рассматривается как перспективный маркер эндотелиальной дисфункции при сепсисе [32].
Гликозаминогликаны
ГАГ, в частности ГС и ГК, являются одними из основных структурных элементов гликокаликса. Как уже указано, доля ГС среди всех ГАГ гликокаликса составляет 50—90% [4]. Деструкция гликокаликса вызывает появление в плазме высоких уровней ГАГ [28—30, 47]. Специфические структурные характеристики циркулирующих ГАГ могут дополнительно указывать на функциональное значение фрагментов гликокаликса. Так, дополнительно сульфатированные цепочки ГС могут проявлять биологическую активность, либо связываясь с антитромбином III и вызывая гепариноподобный эффект либо повышая взаимодействие факторов роста с рецепторами [68]. Эти биологически высоко активные субстанции могут значительно влиять на течение патологического процесса у пациентов в критических состояниях. Кроме того, ГС и фрагменты ГК могут сами по себе оказывать повреждающее действие на ткани, вызывая воспаление и микротравмы [69].
Показано, что количество циркулирующих ГС и ГК, а также модели сульфатации цепочек ГС различаются в зависимости от степени легочного поражения при остром респираторном дистресс-синдроме. Уровни свободных ГС коррелировали с продолжительностью пребывания в палате интенсивной терапии и летальностью [70]. Эти данные позволили сделать вывод, что уровень циркулирующих ГАГ может служить как диагностическим, так и прогностическим маркером тяжести состояния у пациентов с острой дыхательной недостаточностью [70]. Высокие уровни свободно циркулирующих ГАГ отмечены у больных с септическим шоком, и эти уровни коррелируют с уровнем летальности [43, 70].
Ангиопоэтины
Ангиопоэтины (Ang) являются новым, недавно признанным классом сосудистых факторов роста, играющих существенную роль в воспалительном процессе [71]. Ang-1 повышает структурную стабильность кровеносных сосудов, тогда как Ang-2 вызывает дестабилизацию и увеличивает сосудистую проницаемость [71]. Ang-1 и Ang-2 являются взаимно антагонистичными факторами, участвующими в важнейших процессах клеточной регуляции. У больных в критических состояниях высвобождение Ang-2 напрямую отражает расстройство сосудистого барьера [72]. В исследованиях показано, что Ang-2 резко повышен у больных септическим шоком, и его уровень коррелирует с летальностью [73]. К сожалению, рутинное измерение свободно циркулирующего Ang-2 в клинике пока невозможно.
Несомненно, список приведенных выше маркеров деструкции гликокаликса является далеко не полным, так как постоянно появляются результаты исследований, показывающих возможности использования все новых и новых субстанций в качестве маркеров эндотелиального поражения.
Последние два десятилетия отмечены бурным ростом числа исследований и публикаций, посвященных проблемам гликокаликса и эндотелиальной дисфункции. Это позволило по-иному оценить физиологию и патофизиологию эндотелия, увидеть глубину этой проблемы и те потенциальные выгоды, которые можно получить, изменив подходы к различным клиническим ситуациям, взглянув на них через призму гликокаликса.
Слой гликокаликса является хрупкой структурой и разрушается при быстрой внутривенной инфузии жидкостей, острой гипергликемии, хирургических вмешательствах и сепсисе. Исследования гликокаликса показали его вовлеченность практически во все патологические процессы. Наиболее значительные нарушения строения и функции гликокаликсного барьера отмечены при воспалении, ишемии, гипергликемии и даже гипо- и гиперволемии. При всех воспалительных состояниях целостность эндотелиального гликокаликса в различной степени нарушается. Особенно тяжелые повреждения отмечены при сепсисе. Вызванная воспалением деструкция гликокаликса может быть ответственной за ряд специфических клинических проявлений сепсиса, включая острое поражение почек, дыхательную и печеночную недостаточность.
В ХХ веке стал общепризнанным факт, что виновником многих клинических состояний является эндотелиит. Нынешнему веку удалось обнаружить структуру, регулирующую большинство функций эндотелия. Следующая задача — научиться предотвращать деструкцию и восстанавливать разрушенный гликокаликс.
Наука XXI века стоит на пороге рождения новой клинической парадигмы.
Финансирование. Исследование не имело спонсорской поддержки.
Конфликт интересов: автор заявляет об отсутствии конфликта интересов.
Какую функцию выполняет гликокаликс
• У многих прокариот наружная поверхность содержит слой, обогащенный полисахаридами, который называется капсула или слизистый слой
• Предполагается, что капсула или слизистый слой предотвращает высыхание бактерий, обеспечивает их связывание с рецепторами клеток хозяина при попадании в организм, а также помогает бактериям избежать атаки со стороны его иммунной системы
• Формирование капсулы у Е. coli происходит по крайней мере по одному из четырех различных путей
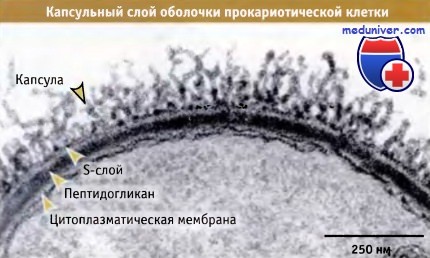
• У многих прокариот, наряду с капсулой или вместо нее, существует S-слой. представляющий собой внешнее белковое покрытие обладающее кристаллическими свойствами
Большинство прокариот, если не все, поверх клеточной стенки образуют гликокаликс или капсулу. Термин гликокаликс приложим к клеткам как прокариот, так и эукариот; и используется для обозначения смеси внеклеточных полисахаридов и белков. В случае прокариотических клеток, между различными типами гликокаликса существуют довольно произвольные различия. Полисахариды, ковалентно связанные с клеткой, называются капсулой.
Непрочно связанные полисахариды, способные отщепляться от клетки, называются «слизистым слоем» или внеклеточными полисахаридами. Состав капсулы значительно варьирует, однако обычно в состав ее входят полисахариды, включая полиспирты и аминосахара, протеогликаны и гликопротеины. Толщина и степень пластичности этого слоя варьируют в зависимости от его химического состава. Полисахариды капсулы образуются при объединении моносахаридов в длинные цепи.
Поскольку любой моносахарид способен соединиться с другим моносахаридом, существует большое разнообразие капсулярных полисахаридов. Серологические свойства капсулярных ингредиентов можно использовать для выяснения отличий ее состава у родственных организмов. Например, у Е. coli описано более 80 различных капсулярных полисахаридов или К-антигенов. Известно, что штаммы, экспрессирующие некоторые К-антигены, связаны с определенными инфекциями.
На этой микрофотографии представлена оболочка Bacillus anthracis.
Капсульный слой выполняет несколько функций, включая защиту клеток от высыхания, фагоцитов, детергентов и бактериофагов. Защита от высыхания играет важную роль в переносе инкапсулированных микроорганизмов от одного хозяина к другому. Капсула выполняет важную роль, обеспечивая адгезию клеток к тканям хозяина и к внешним поверхностям. Капсулы также обеспечивают связывание с другими прокариотами, что приводит к образованию биопленки. Например, Pseudomonas aeruginosa продуцирует огромные количества альгинатов, которые способствуют образованию биопленки в легких.
Такая прочная пленка из альгината также способствует защите патогенных микробов от антибиотиков и защитных систем организма хозяина.
Капсула играет важную роль не только при инфицировании организма хозяина патогенным микроорганизмом Р. aeruginosa. Например, основным вирулентным фактором Bacillus anthracis, вызывающего сибирскую язву, оказалась капсула. Капсула В. anthracis состоит из полимера D-глутаминовой кислоты. Это единственная капсула прокариот, состоящая из пептидов. Материал капсулы продуцируется in vivo, и штаммы В. anthracis, неспособные синтезировать капсулу, характеризуются ослабленной патогенностью. Считается, что, поскольку материал капсулы В. anthracis обладает слабой иммуногенностью, она защищает патогенный микроорганизм от атаки иммунной системы организма хозяина. Капсула также оказывает ингибирующее действие на связывание белков комплемента, тем самым позволяя микробу существовать в системе кровообращения хозяина.
Капсула также является основным фактором вирулентности Mycobacterium tuberculosis. У Mycobacterium капсула обеспечивает связывание с макрофагами, что служит критическим шагом в проникновении бактерии в организм хозяина. Поскольку макрофаги являются фагоцитами, которые захватывают и разрушают микробы, последние выработали различные механизмы, позволяющие им выживать находясь внутри макрофагов. Для Mycobacterium капсула играет критическую роль в одном из таких механизмов.
Во-первых, она обеспечивает связывание с CR3 рецептором макрофагов, что вызывает сигнальный каскад, приводящий к «безопасному» пути инфекции. Также она играет важную роль в нейтрализации активных кислород-радикалов, присутствующих в макрофагах и способных разрушить микроб. Это помогает объяснить, каким образом энкапсулированные Mycobacteria избегают атаки иммунной ситемы и персистируют в организме хозяина, в то время как бескапсульные штаммы обладают меньшей вирулентностью. В действительности, бескапсульные штаммы Mycobacterium используются для изготовления вакцины, обеспечивающей иммунитет к тубекулезу.
Биогенез капсулы изучен на нескольких видах бактерий, однако, вероятно, лучше всего на E. coli. По генетическим и биохимическим критериям капсулы этой бактерии подразделяются на четыре группы. Особенно подробно исследован биогенез групп 1 и 2. Транспорт капсул этих групп к поверхности клетки, вероятно, происходит в местах тесного контакта между цитоплазматической и наружной мембранами. В транслокации капсул, относящихся к первой группе, участвует высокомолекулярный комплекс, который образует Wza, представляющий собой липопротеид наружной мембраны. Предполагается, что Wza, представляющий собой белок, формирующий цилиндр (b-barrel), вместе с Wzc образует канал, через который происходит секреция предшественников капсулы. Эта система секреции функционально и генетически близка к Usher белку наружной мембраны, РарС.
При участии белков KpsE и KpsD, компоненты капсул группы 2 мигрируют через наружную мембрану в обоих направлениях. Белок KpsE связывается с плазматической мембраной через свой N-концевой домен, в то время как большая часть белка находится в периплазматическом пространстве. Хотя KpsE не пронизывает наружную мембрану, С-концевой участок его молекулы связан с ней. Функционирование такого секреторного аппарата зависит от взаимной близости цитоплазматической и наружной мембран. Хотя функция белка KpsD до конца не выяснена, известно, что он представляет собой периплазматический белок, который, возможно, необходим для мобилизации белка KpsE на наружной мембране. Биогенез капсул, относящихся к группам 3 и 4, изучен недостаточно.
У многих бактерий и археев на наружной поверхности находится белковая структура, которая называется поверхностный слой (S-слой). Ее можно рассматривать как альтернативу капсуле или как дополнение к ней. S-слои образуются из одного белка или фрагментов гликопротеинов, которые в процессе самосборки формируют кристаллическую решетку. Структура белка не является консервативной, однако часто он содержит много остатков кислых и гидрофобных аминокислот. Иногда, главным образом у археев и грамположительных бактерий, обнаруживаются гликозилированные белки. Особенно характерно наличие множественных сайтов гликозилирования.
Гликозильные цепи состоят из 20-50 идентичных субъединиц, содержащих набор сахарных остатков. На рисунке ниже представлен препарат S-слоя, приготовленный с использованием метода «замораживания-травления» (видна поверхность, обладающая гексагональной симметрией, и поперечный срез через S-слой). Обычно толщина S-слоя составляет от 5 до 25 нм. Наружная поверхность его довольно гладкая, а внутренняя выглядит сморщенной в тех местах, где слой взаимодействует с более глубоко лежащими слоями. Сборка S-слоя находится под контролем клеточной оболочки, которая взаимодействует с такими молекулами, расположенными на поверхности, как теихоевые кислоты (у грамположительных бактерий) или липополисахариды (у грамотрицательных бактерий). Каким образом сборка и позиционирование S-слоя связаны с капсулой (в случае когда существуют два слоя), пока не ясно.
Если у археев пептидогликан или эквивалентный компонент отсутствует, то S-слой представляет собой основной компонент клеточной оболочки. Хотя белки S-слоя составляют значительную часть тотального клеточного белка, их функции пока не вполне выяснены. Многие штаммы прокариот, культивируемые в лаборатории, утратили способность формировать S-слой, однако прекрасно растут. Возможно, существует некий смысл не формировать этот слой в условиях, когда он не требуется.

Слева: электронная микрофотография, иллюстрирующая гексагональную симметрию наружной поверхности S-слоя.
Справа: электронная микрофотография поперечного среза клеточной оболочки, содержащей S-слой.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021