Как называется соединения содержащие углерод
Углерод (C)
Углерод в виде древесного угля известен человеку с незапамятных времен, поэтому, о дате его открытия говорить не имеет смысла. Собственно свое название «углерод» получил в 1787 году, когда была опубликована книга «Метод химической номенклатуры», в которой вместо французского названия «чистый уголь» (charbone pur) появился термин «углерод» (carbone).
Сейчас рассмотрим углерод с точки зрения неорганической химии.
Рис. Строение атома углерода.
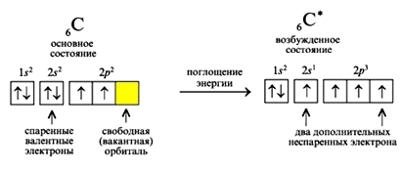
Рис. Переход атома углерода в возбужденное состояние.
«Уникальность» атома углерода заключается в том, что на его внешнем энергетическом уровне находятся 4 электрона, поэтому, для завершения уровня (к чему, собственно, стремятся атомы любого химического элемента) он может с одинаковым «успехом», как отдавать, так и присоединять электроны с образованием ковалентных связей (см. Ковалентная связь).
Углерод, как простое вещество
Как простое вещество углерод может находиться в виде нескольких аллотропных модификаций:
Алмаз
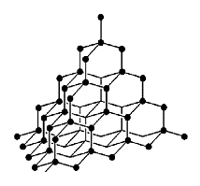
Рис. Кристаллическая решетка алмаза.
Свойства алмаза:
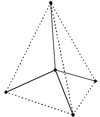
Рис. Тетраэдр алмаза.
Графит
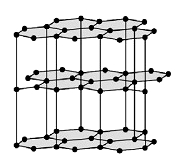
Рис. Кристаллическая решетка графита.
Свойства графита:
В графите атомы углерода образуют правильные шестиугольники, лежащие в одной плоскости, организованные в бесконечные слои.
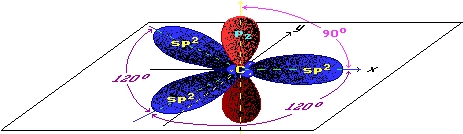
Рис. Распределение орбиталей атома углерода в графите.
Фуллерен
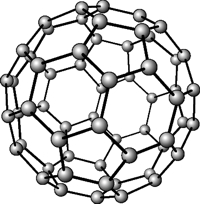
Рис. Кристаллическая решетка фуллерена.
Свойства фуллерена:
Карбин
Свойства карбина:
Химические свойства углерода
При нормальных условиях углерод является инертным веществом, но при нагревании может реагировать с разнообразными простыми и сложными веществами.
Углерод является восстановителем в реакциях с кислородом и другими элементами, имеющими более высокую электроотрицательность (см. таблицу электроотрицательности элементов):
Углерод проявляет окислительные свойства в реакциях с металлами и водородом:
Углерод получают термическим разложением его соединений или пиролизом метана (при высокой температуре):
CH4 = C + 2H2.
Применение углерода
Соединения углерода нашли самое широкое применение в народном хозяйстве, перечислить все их не представляется возможным, укажем только некоторые:
Если вам понравился сайт, будем благодарны за его популяризацию 🙂 Расскажите о нас друзьям на форуме, в блоге, сообществе. Это наша кнопочка:
Код кнопки: 
Политика конфиденциальности Об авторе
Углерод и его соединения
Углерод встречается в природе, как в свободном виде, так и в соединениях. В свободном виде встречается в виде аллотропных видоизменений – алмаз, графит, карбин, фуллерен.
Кристаллическое вещество, прозрачное, сильно преломляет лучи света, очень твёрдое, не проводит электрический ток, плохо проводит тепло, ρ = 3,5 г/см 3 ; t°пл. = 3730°C; t°кип. = 4830°C.
Можно получить из графита при p > 50 тыс. атм; t° = 1200°C.
Шлифовальный порошок, буры, стеклорезы, после огранки — бриллианты.
Электроды, карандашные грифели, замедлитель нейтронов в ядерных реакторах, входит в состав некоторых смазочных материалов.
Чёрный порошок; ρ = 2 г/см 3 ; полупроводник.
Состоит из линейных цепочек –C≡C–C≡C– и =С=С=С=С=.
При нагревании переходит в графит.
В конце 80-х годов XX века было обнаружено ещё одно аллотропное видоизменение – фуллерит. Он, в отличие от алмаза и графита, имеет не атомную, а молекулярную кристаллическую решётку.
Атомы углерода могут образовывать также полые трубки – так называемые нанотрубки. В настоящее время фуллерены и нанотрубки рассматриваются в качестве основы для технологий будущего.
Соединения углерода весьма распространены: все живые организмы, каменный уголь, торф, нефть и др. содержат углерод. Углерод входит в состав многих неорганических веществ (известняк, мел, мрамор и др).
ХИМИЧЕСКИЕ СВОЙСТВА УГЛЕРОДА
Углерод — малоактивен, на холоде реагирует только со фтором; химическая активность проявляется при высоких температурах.
С 0 – 4 е — → С +4 или С 0 – 2 е — → С +2
C 0 + O2 t ˚ C → CO2 углекислый газ
при недостатке кислорода наблюдается неполное сгорание образуется угарный газ:
2C 0 + O2 t ˚ C → 2C +2 O
C 0 + H2O t ˚ C → С +2 O + H2 водяной газ
4) с оксидами металлов
C 0 + 2CuO t˚C → 2Cu + C +4 O2
5) с кислотами – окислителями:
С 0 + 4 HNO 3(конц.) → С +4 O 2 + 4 NO 2 + 2 H 2 O
Оксид углерода(II) – СО
(угарный газ, окись углерода, монооксид углерода)
Физические свойства: бесцветный ядовитый газ без вкуса и запаха, горит голубоватым пламенем, легче воздуха, плохо растворим в воде. Концентрация угарного газа в воздухе 12,5—74 % взрывоопасна.
Формальная степень окисления углерода +2 не отражает строение молекулы СО, в которой помимо двойной связи, образованной обобществлением электронов С и О, имеется дополнительная, образованная по донорно-акцепторному механизму за счет неподеленной пары электронов кислорода (изображена стрелкой):
В связи с этим молекула СО очень прочна и способна вступать в реакции окисления-восстановления только при высоких температурах. При обычных условиях СО не взаимодействует с водой, щелочами или кислотами.
Основным антропогенным источником угарного газа CO в настоящее время служат выхлопные газы двигателей внутреннего сгорания. Угарный газ образуется при сгорании топлива в двигателях внутреннего сгорания при недостаточных температурах или плохой настройке системы подачи воздуха (подается недостаточное количество кислорода для окисления угарного газа CO в углекислый газ CO2). В естественных условиях, на поверхности Земли, угарный газ CO образуется при неполном анаэробном разложении органических соединений и при сгорании биомассы, в основном в ходе лесных и степных пожаров.
1) В промышленности (в газогенераторах)
CO2 + C = 2CO – 175 кДж
В газогенераторах иногда через раскалённый уголь продувают водяной пар:
смесь СО + Н2 – называется синтез – газом.
2) В лаборатории — термическим разложением муравьиной или щавелевой кислоты в присутствии H2SO4(конц.):
При обычных условиях CO инертен; при нагревании – восстановитель;
CO — несолеобразующий оксид.
2 C +2 O + O 2 t ˚ C → 2 C +4 O 2↑
C +2 O + CuO t ˚ C → Сu + C +4 O2↑
3) с хлором (на свету)
CO + Cl2 свет → COCl2 (фосген – ядовитый газ)
4)* реагирует с расплавами щелочей (под давлением)
CO + NaOH P → HCOONa (формиат натрия)
Влияние угарного газа на живые организмы:
Угарный газ опасен, потому что он лишает возможности кровь нести кислород к жизненно важным органам, таким как сердце и мозг. Угарный газ объединяется с гемоглобином, который переносит кислород к клеткам организма, в следствии чего тот становится непригодным для транспортировки кислорода. В зависимости от вдыхаемого количества, угарный газ ухудшает координацию, обостряет сердечно-сосудистые заболевания и вызывает усталость, головную боль, слабость, Влияние угарного газа на здоровье человека зависит от его концентрации и времени воздействия на организм. Концентрация угарного газа в воздухе более 0,1% приводит к смерти в течение одного часа, а концентрация более 1,2% в течении трех минут.
Главным образом угарный газ применяют, как горючий газ в смеси с азотом, так называемый генераторный или воздушный газ, или же в смеси с водородом водяной газ. В металлургии для восстановления металлов из их руд. Для получения металлов высокой чистоты при разложении карбонилов.
Оксид углерода (IV) СO2 – углекислый газ
Углекислый газ имеет следующие электронную и структурную формулы —
Все четыре связи ковалентые полярные.
1. Термическим разложением солей угольной кислоты (карбонатов). Обжиг известняка – в промышленности:
2. Действием сильных кислот на карбонаты и гидрокарбонаты –
3. Сгорание углеродсодержащих веществ:
4. При медленном окислении в биохимических процессах (дыхание, гниение, брожение)
1) с водой даёт непрочную угольную кислоту:
2) реагирует с основными оксидами и основаниями, образуя соли угольной кислоты
Качественная реакция на углекислый газ:
Помутнение известковой воды Ca ( OH )2 за счёт образования белого осадка – нерастворимой соли CaCO 3:
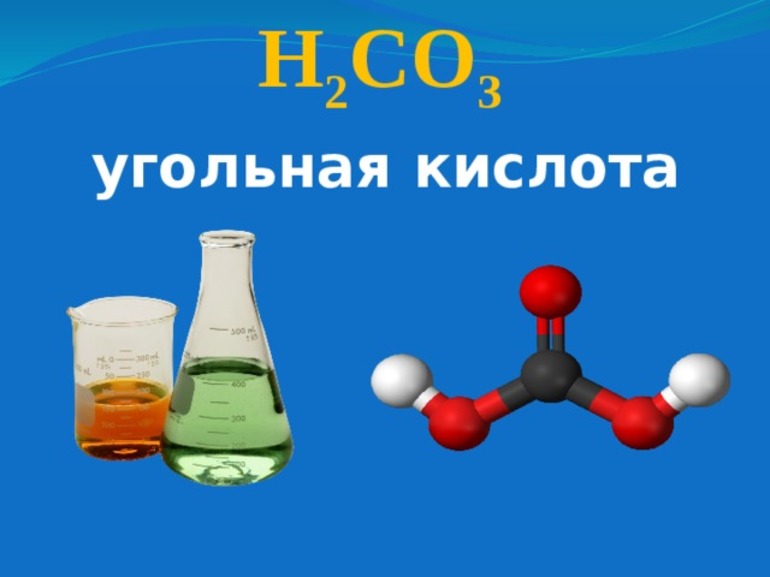
Угольная кислота и её соли
Структурная формула – все связи ковалентные полярные:
Кислота слабая, существует только в водном растворе, очень непрочная, разлагается на углекислый газ и воду:
Для угольной кислоты характерны все свойства кислот.
1) Диссоциация – двухосновная кислота, диссоциирует слабо в две ступени, индикатор — лакмус краснеет в водном растворе:
2) с активными металлами
3) с основными оксидами
5) Очень непрочная кислота – разлагается
Соли угольной кислоты – карбонаты и гидрокарбонаты
Угольная кислота образует два ряда солей:
В природе встречаются:
K 2 CO 3(поташ, в золе растений)
Na 2 CO 3 – сода, кальцинированная сода
Na 2 CO 3 x 10 H 2 O – кристаллическая сода
Все карбонаты – твёрдые кристаллические вещества. Большинство из них в воде не растворяются. Гидрокарбонаты растворяются в воде.
Химические свойства солей угольной кислоты:
Общие свойства солей:
1) Вступают в реакции обмена с другими растворимыми солями
2) Разложение гидрокарбонатов при нагревании
3) Разложение нерастворимых карбонатов при нагревании
4) Карбонаты и гидрокарбонаты могут превращаться друг в друга:
Нахождение в природе
В природе углерод встречается как в чистом виде, так и в форме соединений. В свободном кристаллическом состоянии он находится в виде двух аллотропных видоизменений:
Есть еще одна модификация — аморфный углерод. Это пористое вещество черного цвета. Его «известные представители» — кокс, сажа, древесный и костяной уголь. В чистом виде не встречается, всегда содержит примеси.
В связанном состоянии углерод встречается в карбонатах (кальцит, известняк, мел, мрамор, железный шпат FeCO3, марганцевый шпат MnCO3, цинковый шпат ZnCO3, магнезит, доломит, малахит, и прочие). Кроме того, углерод — основная составная часть каменных и других углей, нефти, горючих природных газов, всех живых организмов.
Основные свойства
Углерод инертен по отношению ко всем обычным растворителям. Исключение — некоторые расплавленные металлы. Однако после остывания он снова кристаллизуется в графит.
При нормальных условиях более химически активный только черный углерод. Он может соединяться со фтором, а при повышении температуры — с водородом, кремнием, серой, бором и некоторыми другими металлами. В результате реакции образуются карбиды:
Ряд карбидов имеет состав, который не подчиняется «общепринятому» представлению о валентности. К таким относится, например, Fe3C.
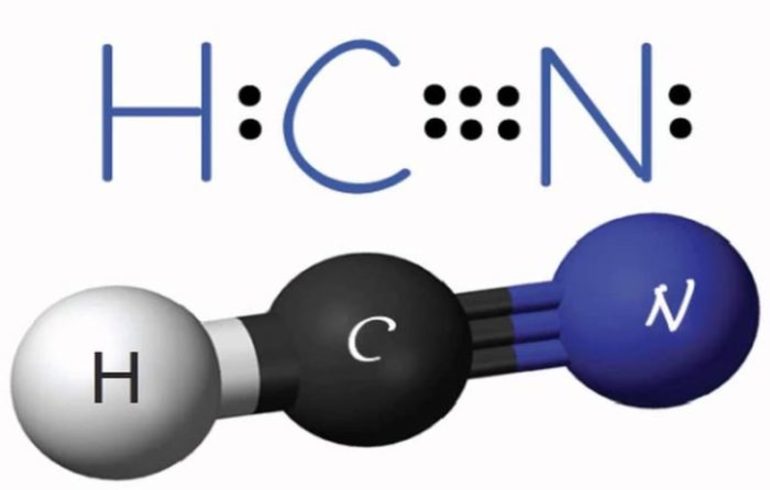
С азотом углерод не соединяется, но в присутствии водорода образует циановодород (формула вещества HCN). В реакциях с кислородом он образует монооксид и диоксид, при этом выделяется большое количество тепла:
Углерод — один из наиболее сильных восстановителей, известных в химии. При взаимодействии с оксидами металлов он «отнимает» у них кислород, восстанавливая при этом вещества до свободного состояния:
При взаимодействии избытка углерода с диоксидом кремния (кварцем, песком), кроме чистого Si, образуется карборунд (окись кремния) — очень твердое вещество: SiO2 + 3C → SiC + 2CO.
С галогенами «чистый» углерод не взаимодействует. Соединения с ними образуются из других веществ (например, углеводородов).
Углеродные соединения
В начале XIX века вещества были разделены на неорганические и органические. Ко второй группе относятся углеводороды (метановый, этиленовый и ацетиленовый ряды), белки, углеводы, жиры. Изучением этих веществ занимается органическая химия.
Неорганическая химия изучает другие соединения углерода: галогениды, цианиды, карбиды, оксиды. Наиболее значимыми являются кислородсодержащие вещества — CO, CO2. Есть еще C2O (окись диуглерода) и C3O2 (недооксид), но это пока не слишком изученные вещества.
Монооксид или угарный газ
Оксид углерода 2 (другое название монооксида) — образуется при неполном сгорании C, или продуктов, его содержащих. Его основные свойства:
Монооксид — ядовитый газ, не имеющий цвета и запаха. Его отравляющее действие состоит в том, что он необратимо взаимодействует с гемоглобином крови, в результате чего полностью утрачивается способность переносить кислород от легких к тканям.
В промышленности монооксид получают в процессе газификации твердого топлива. В лаборатории синтезировать соединение можно путем воздействия концентрированной серной кислоты на щавелевую (C2H2O4) или муравьиную (HCOOH). Реакция протекает при нагревании:
По химическим свойствам двухвалентный оксид — хороший восстановитель. Он отлично горит, выделяя при этом большое количество тепла: 2CO + O2 → 2CO2. Другие характерные признаки:
Угарный газ находит широкое практическое применение. Он входит в состав искусственного газообразного топлива. Кроме того, незаменим при процессах органического синтеза.
Диоксид углерода или CO2
Это газ, не имеющий цвета, обладающий слабым кисловатым запахом и вкусом. Молярная масса равна 44.01 г/моль.
Примечание: оксид углерода 4 в полтора раза тяжелее воздуха, поэтому его можно «переливать» из пробирки в пробирку.
Углекислый газ (еще одно название диоксида углерода) не поддерживает горения. Кроме того, он делает невозможным дыхание: в комнате, где концентрация вещества будет высокой, человек задохнется. Какие свойства присущи соединению:
В промышленности диоксид углерода синтезируют путем термического разложения известняка или мела (иногда доломита, магнезита): CaCO3 → CaO + CO2. Также это вещество можно выделить из коксового газа, при сжигании угля, торфа, нефтепродуктов, древесины. Кроме того, он содержится и в природных источниках: например, «появляется» в результате вулканической деятельности, при распаде органических веществ.
В лабораторных условиях его получают при взаимодействии CaCO3 и соляной кислоты: CaCO3 + 2HCl → CaCL2 + CO2 + H2O (реакция проводится в аппарате Киппа). Другой способ — прокаливание гидрокарбоната натрия: NaHCO3 → Na2CO3 + CO2 + H2O.
Углекислый газ имеет промышленное значение: он необходим в содовом производстве, в пищевой промышленности (изготовление газированных напитков), для синтеза органических кислот. Сухой лед (твердый диоксид) используется в качестве хладагента — углекислая среда предотвращает продукты питания от разложения. Кроме того, CO2 применяется и в медицине (углекислотные ванны для активизации метаболических функций). Незаменим он и для сельского хозяйства — оксид углерода IV участвует в фотосинтезе, поэтому его недостаток негативно сказывается на растениях.
Углерод. Химия углерода и его соединений
Углерод
Положение в периодической системе химических элементов
Углерод расположен в главной подгруппе IV группы (или в 14 группе в современной форме ПСХЭ) и во втором периоде периодической системы химических элементов Д.И. Менделеева.
Электронное строение углерода
Электронная конфигурация углерода в основном состоянии :
+6С 1s 2 2s 2 2p 2 1s 

Электронная конфигурация углерода в возбужденном состоянии :
+6С * 1s 2 2s 1 2p 3 1s 

Атом углерода содержит на внешнем энергетическом уровне 2 неспаренных электрона и 1 неподеленную электронную пару в основном энергетическом состоянии и 4 неспаренных электрона в возбужденном энергетическом состоянии.
Физические свойства
Углерод в природе существует в виде нескольких аллотропных модификаций: алмаз, графит, карбин, фуллерен.
Графит — мягкое вещество серо-стального цвета, с металлическим блеском. Хорошо проводит электрический ток. Жирный на ощупь.
Карбин — вещество, в составе которого атомы углерода находятся в sp-гибридизации. Состоит из цепочек и циклов, в которых атомы углерода соединены двойными и тройными связями. Карбин — мелкокристаллический порошок серого цвета.
[=C=C=C=C=C=C=]n или [–C≡C–C≡C–C≡C–]n
Фуллерен — это искусственно полученная модифицикация углерода. Молекулы фуллерена — выпуклые многогранники С60, С70 и др. Многогранники образованы пяти- и шестиугольниками, в вершинах которых расположены атомы углерода.
Фуллерены — черные вещества с металлическим блеском, обладающие свойствами полупроводников.
В природе углерод встречается как в виде простых веществ (алмаз, графит), так и в виде сложных соединений (органические вещества — нефть, природные газ, каменный уголь, карбонаты).
Качественные реакции
Видеоопыт взаимодействия карбоната кальция с соляной кислотой можно посмотреть здесь.
Качественная реакция на углекислый газ CO2 – помутнение известковой воды при пропускании через нее углекислого газа:
При дальнейшем пропускании углекислого газа осадок растворяется, т.к. карбонат кальция под действием избытка углекислого газа переходит в растворимый гидрокарбонат кальция:
Видеоопыт взаимодействия гидроксида кальция с углекислым газом (качественная реакция на углекислый газ) можно посмотреть здесь.
Соединения углерода
Наиболее типичные соединения углерода:
| Степень окисления | Типичные соединения |
| +4 | оксид углерода (IV) CO2 гидрокарбонаты MeHCO3 |
| +2 | оксид углерода (II) СО муравьиная кислота HCOOH |
| -4 | метан CH4 карбиды металлов (карбид алюминия Al4C3) бинарные соединения с неметаллами (карбид кремния SiC) |
Химические свойства
При нормальных условиях углерод существует, как правило, в виде атомных кристаллов (алмаз, графит), поэтому химическая активность углерода — невысокая.
1.1. Из галогенов углерод при комнатной температуре реагирует с фтором с образованием фторида углерода:
1.2. При сильном нагревании углерод реагирует с серой и кремнием с образованием бинарного соединения сероуглерода и карбида кремния соответственно:
C + 2S → CS2
C + Si → SiC
При взаимодействии углерода с водородом образуется метан. Реакция идет в присутствии катализатора (никель) и при нагревании:
1.4. С азотом углерод реагирует при действии электрического разряда, образуя дициан:
2С + N2 → N≡C–C≡N
1.5. В реакциях с активными металлами углерод проявляет свойства окислителя. При этом образуются карбиды:
2C + Ca → CaC2
при недостатке кислорода образуется угарный газ СО:
2C + O2 → 2CO
Алмаз горит при высоких температурах:
Горение алмаза в жидком кислороде:
Графит также горит:
Графит также горит, например, в жидком кислороде:
Графитовые стержни под напряжением:
2. Углерод взаимодействует со сложными веществами:
2.1. Раскаленный уголь взаимодействует с водяным паром с образованием угарного газа и водорода:
C 0 + H2 + O → C +2 O + H2 0
ZnO + C → Zn + CO
Также углерод восстанавливает железо из железной окалины:
4С + Fe3O4 → 3Fe + 4CO
При взаимодействии с оксидами активных металлов углерод образует карбиды.
3С + СаО → СаС2 + СО
2.3. Концентрированная серная кислота окисляет углерод при нагревании. При этом образуются оксид серы (IV), оксид углерода (IV) и вода:
2.4. Концентрированная азотная кислотой окисляет углерод также при нагревании. При этом образуются оксид азота (IV), оксид углерода (IV) и вода: