Как называется so3 в химии
Оксиды серы SO2 и SO3
Автор текста Анисимова Е.С. Из курса лекций по химии
Оксиды серы: SO2 и SO3
Атомы, элементы
1. В природе есть атомы, а в атомах есть протоны.
2. О. – Атомы с восемью протонами называются атомами кислорода (атомами химического элемента кислород).
3. Не путать атом кислорода с веществом «кислород», которым люди дышат:
дышат люди молекулами кислорода, которые состоят из двух атомов кислорода каждая.
4. Атом кислорода обозначается буквой О, а молекула из двух атомов О – это О2.
5. S. – Атомы с 16-тью протонами называются атомами серы (атомами химического элемента сера) и обозначаются буквой S.
6. Атомы с одинаковым числом протонов считаются атомами одного химического элемента.
7. Сера – это химический элемент.
Оксиды
8. Атомы кислорода могут соединяться с атомами другого химического элемента.
9. Соединения атомов кислорода с атомами серы называются оксидами серы.
10. Соединение из двух атомов водорода (Н) и одного атома кислорода (О) называется: молекулой оксида водорода или молекулой ВОДЫ.
S и 2О = SО2
11. Атом серы (S) может соединиться с двумя атомами кислорода (О).
12. Объединение одного атома серы S и двух атомов О даёт соединение состава SО2.
13. SО2 – это молекула. Формула молекулы.
14. SО2 является газом. В обычных условиях.
15. Вещество, молекулы которого имеют состав (и формулу) SО2, называется сернистым газом или оксидом серы IV.
16. SО2 – это формула молекулы сернистого газа.
SО2 и воздух
17. SО2 в атмосфере почти нет в норме. (Очень мало)
18. SО2 выделяется вулканами, заводами и автомобилями.
19. SО2 образуется при сжигании бензина, угля и т.д. Потому что примеси серы есть в угле и бензине.
20. В современной атмосфере SО2 больше, чем сто или тысячу лет назад.
21. Почему сейчас SО2 больше, чем сто лет назад? См. выше.
22. Поступление SО2 в атмосферу приводит к кислотным дождям.
23. Кислотные дожди портят здания, автомобили, памятники – всё созданное людьми. В том числе древние памятники искусства, шедевры архитектуры.
24. Из-за кислотных дождей во многих озёрах не стало рыбки.
25. Из-за кислотных дождей во многих лесах не стало листьев: листва опадает, деревья погибают.
26. Из-за кислотных дождей на многих полях не стало нормальной почвы: почва становится слишком кислой.
27. Из-за кислотных дождей на многих полях снизились урожаи.
28. Снижение урожаев грозит голодом.
29. Кислотные дожди портят леса, поля и озёра и создают угрозу голода.
30. Избавиться от кислотных дождей нужно за счёт снижения выбросов SO2 в атмосферу.
31. SO2 может быть источником серы для промышленности и с/х.
32. В атмосфере SO2 превращается в серную кислоту. (через…)
33. Много SO2 есть в атмосфере Венеры, вокруг неё целые облака из серной кислоты.
34. S и 3О = SО3
35. Атом серы (S) может соединиться с тремя атомами кислорода (О).
36. Объединение одного атома серы S и трёх атомов О даёт соединение состава SО3.
37. SО3 – это молекула. Формула молекулы.
38. SО3 является жидкостью. В обычных условиях.
39. SO3 – это единственный жидкий оксид, кроме воды.
40. Вещество, молекулы которого имеют состав (и формулу) SО3, называется оксидом серы-VI.
41. SО3 – это формула молекулы оксиды серы VI.
42. Контакт молекул SO3 с молекулами воды даёт серную кислоту.
Оксид серы (VI) SO3, серный ангидрид
Взаимодействуя с кислородом, сера образует два оксида:
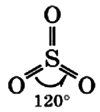
Молекула сернистого газа сильно полярна, угловой формы (угол между связями составляет 119°):
В таком виде молекула серного ангидрида может находиться только в газообразном состоянии.
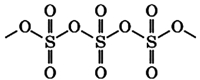
В жидком и твердом состоянии происходит полимеризация молекул:
Физические свойства серного ангидрида:
Химические свойства серного ангидрида
Оксид серы (VI) является типичным кислотным оксидом:
Серный ангидрид очень хорошо растворяется в серной кислоте, образуя раствор, называемый олеумом:
В кислотно-восстановительных реакциях выступает в роли сильного окислителя, восстанавливаясь до сернистого ангидрида:
Получение и применение серного ангидрида
В промышленных целях серный ангидрид получают путем окисления сернистого газа в присутствии катализатора:
Серный ангидрид используют для получения серной кислоты, а также, в качестве сульфирующего и обезвоживающего реагента.
Если вам понравился сайт, будем благодарны за его популяризацию 🙂 Расскажите о нас друзьям на форуме, в блоге, сообществе. Это наша кнопочка:
Код кнопки: 
Политика конфиденциальности Об авторе
Оксиды серы. Серная кислота
Сера с кислородом образует два оксида: SO2 – оксид серы (IV) и SO3 – оксид серы (VI).
Оксид серы (IV) — SO2 (сернистый газ, сернистый ангидрид)
Сернистый газ – это бесцветный газ с резким запахом, ядовит. Тяжелее воздуха более чем в два раза. Хорошо растворяется в воде. При комнатной температуре в одном объёме воды растворяется около 40 объёмов сернистого газа, при этом образуется сернистая кислота H2SO3.
Химические свойства
Сернистый газ – типичный кислотный оксид. Он взаимодействует:
а) с основаниями, образуя два типа солей: кислые (гидросульфиты) и средние (сульфиты):
б) с основными оксидами:
Сернистая кислота существуют только в растворе, относится к двухосновным кислотам. Сернистая кислота обладает всеми общими свойствами кислот.
Окислительно – восстановительные свойства
В окислительно-восстановительных процессах сернистый газ может быть как окислителем, так и восстановителем, потому что атом серы в этом соединении имеет промежуточную степень окисления +4.
Как окислитель SO2 реагирует с более сильными восстановителями, например с сероводородом:
Как восстановитель SO2 реагирует с более сильными окислителями, например с кислородом в присутствии катализатора, с хлором и т.д.:
Получение
1) Сернистый газ образуется при горении серы:
2) В промышленности его получают при обжиге пирита:
3) В лаборатории сернистый газ можно получить:
а) при действии кислот на сульфиты:
б) при взаимодействии концентрированной серной кислоты с тяжелыми металлами:
Применение
Сернистый газ находит широкое применение в текстильной промышленности для отбеливания различных изделий. Кроме того, его используют в сельском хозяйстве для уничтожения вредных микроорганизмов в теплицах и погребах. В больших количествах SO2 идет на получение серной кислоты.
Оксид серы (VI) – SO3 (серный ангидрид)
Серный ангидрид SO3 – это бесцветная жидкость, которая при температуре ниже 17 о С превращается в белую кристаллическую массу. Очень хорошо поглощает влагу (гигроскопичен).
Химические свойства
Как типичный кислотный оксид серный ангидрид взаимодействует:
а) с основаниями, образуя два типа солей – кислые (гидросульфиты) и средние (сульфаты):
Особым свойством SO3 является его способность хорошо растворяться в серной кислоте. Раствор SO3 в серной кислоте имеет название олеум.
Оксид серы (VI) характеризуется сильными окислительными свойствами (обычно восстанавливается до SO2):
Получение и применение
Серный ангидрид образуется при окислении сернистого газа:
В чистом виде серный ангидрид практического значения не имеет. Он получается как промежуточный продукт при производстве серной кислоты.
Серная кислота H2SO4
Упоминания о серной кислоте впервые встречаются у арабских и европейских алхимиков. Ее получали, прокаливая на воздухе железный купорос (FeSO4∙7H2O): 2FeSO4 = Fe2O3 + SO3↑ + SO2↑ либо смесь серы с селитрой: 6KNO3 + 5S = 3K2SO4 + 2SO3↑ + 3N2↑, а выделяющиеся пары серного ангидрида конденсировали. Поглощая влагу, они превращались в олеум. В зависимости от способа приготовления H2SO4 называли купоросным маслом или серным маслом. В 1595 г. алхимик Андреас Либавий установил тождественность обоих веществ.
Долгое время купоросное масло не находило широкого применения. Интерес к нему сильно возрос после того, как в XVIII в. был открыт процесс получения из индиго индигокармина – устойчивого синего красителя. Первую фабрику по производству серной кислоты основали недалеко от Лондона в 1736 г. Процесс осуществляли в свинцовых камерах, на дно которых наливали воду. В верхней части камеры сжигали расплавленную смесь селитры с серой, затем туда запускали воздух. Процедуру повторяли до тех пор, пока на дне ёмкости не образовывалась кислота требуемой концентрации.
В XIX в. способ усовершенствовали: вместо селитры стали использовать азотную кислоту (она при разложении в камере даёт NO2). Чтобы возвращать в систему нитрозные газы были сконструированы специальные башни, которые и дали название всему процессу – башенный процесс. Заводы, работающие по башенному методу, существуют и в наше время.

Серная кислота – это тяжелая маслянистая жидкость без цвета и запаха, гигроскопична; хорошо растворяется в воде. При растворении концентрированной серной кислоты в воде выделяется большое количество тепла, поэтому ее надо осторожно приливать в воду (а не наоборот!) и перемешивать раствор.
Раствор серной кислоты в воде с содержанием H2SO4 менее 70% обычно называют разбавленной серной кислотой, а раствор более 70% — концентрированной серной кислотой.
Химические свойства
Разбавленная серная кислота проявляет все характерные свойства сильных кислот. Она реагирует:
Процесс взаимодействия ионов Ва 2+ с сульфат-ионами SO4 2+ приводит к образованию белого нерастворимого осадка BaSO4. Это качественная реакция на сульфат-ион.
Окислительно – восстановительные свойства
В разбавленной серной кислоте растворяются металлы, которые в электрохимическом ряду напряжений находятся до водорода. При этом образуются сульфаты металлов и выделяется водород:
Металлы, которые в электрохимическом ряду напряжений находятся после водорода, не реагируют с разбавленной серной кислотой:
Концентрированная серная кислота является сильным окислителем, особенно при нагревании. Она окисляет многие металлы, неметаллы и некоторые органические вещества.
При взаимодействии концентрированной серной кислоты с металлами, которые в электрохимическом ряду напряжений находятся после водорода (Cu, Ag, Hg), образуются сульфаты металлов, а также продукт восстановления серной кислоты – SO2.

Более активными металлами (Zn, Al, Mg) концентрированная серная кислота может восстанавливаться до свободной серы или сероводорода. Например, при взаимодействии серной кислоты с цинком, магнием, алюминием в зависимости от концентрации кислоты одновременно могут образовываться различные продукты восстановления серной кислоты – SO2, S, H2S:
На холоде концентрированная серная кислота пассивирует некоторые металлы, например алюминий и железо, поэтому ее перевозят в железных цистернах:
Концентрированная серная кислота окисляет некоторые неметаллы (серу, углерод и др.), восстанавливаясь до оксида серы (IV) SO2:
Получение и применение

В промышленности серную кислоту получают контактным способом. Процесс получения происходит в три стадии:
Полученный олеум перевозят в железных цистернах. Из олеума получают серную кислоту нужной концентрации, приливая его в воду. Это можно выразить схемой:
Серная кислота находит разнообразное применение в самых различных областях народного хозяйства. Ее используют для осушки газов, в производстве других кислот, для получения удобрений, различных красителей и лекарственных средств.
Соли серной кислоты

Большинство сульфатов хорошо растворимы в воде (малорастворим CaSO4, еще менее PbSO4 и практически нерастворим BaSO4). Некоторые сульфаты, содержащие кристаллизационную воду, называются купоросами:
CuSO4 ∙ 5H2O медный купорос
FeSO4 ∙ 7H2O железный купорос
Соли серной кислоты имеют все общие свойства солей. Особенным является их отношение к нагреванию.
Сульфаты активных металлов (Na, K, Ba) не разлагаются даже при 1000 о С, а других (Cu, Al, Fe) – распадаются при небольшом нагревании на оксид металла и SO3:
Скачать:
Скачать бесплатно реферат на тему: «Производство серной кислоты контактным способом» Производство-серной-кислоты-контактным-способом.docx (244 Загрузки)
Скачать рефераты по другим темам можно здесь
*на изображении записи фотография медного купороса
Похожее
Добавить комментарий Отменить ответ
Репетитор по химии. Занятия проходят онлайн по Скайпу. По всем вопросам пишите в Ватсапп: +7 928 285 70 42
Как называется so3 в химии
Качественная реакция на сульфат-ион:
Образование белого осадка BaSO4 (нерастворимого в кислотах) используется для идентификации серной кислоты и растворимых сульфатов.
4. Применение серной кислоты
Самый крупный потребитель серной кислоты — производство минеральных удобрений. На 1 т P₂O₅ фосфорных удобрений расходуется 2,2-3,4 т серной кислоты, а на 1 т (NH₄)₂SO₄ — 0,75 т серной кислоты. Поэтому сернокислотные заводы стремятся строить в комплексе с заводами по производству минеральных удобрений.
Это интересно
История серной кислоты (материал взят с сайта alhimikov.net)
 Джон Робак |
Этот способ использовался в промышленности в течение почти двух столетий. В камерах получали кислоту с концентрацией около 65 %, впоследствии усовершенствовав сам процесс (Это сделали французский химик Гей-Люссак и английский Гловер), концентрацию довели до 78%. Однако этих концентраций для некоторых химических процессов, например, при производстве красителей не хватало.
Лишь в 1831 г. британский торговец уксусной кислотой Перегрин Филипс запатентовал экономичный процесс для производства оксида серы (VI) и концентрированной серной кислоты, который известен нам в настоящее время как контактный способ получения серной кислоты.
В 1864 году стали производить суперфосфат. В восьмидесятые годы XIX века производство серной кислоты достигло в Европе 1 млн. тонн. Основными производителями были Англия и Германия, на долю которых приходилось более 72% от мирового объема производства.
5. Применение солей серной кислоты
Железный купорос FеSО4•7Н2O применяли раньше для лечения чесотки, гельминтоза и опухолей желез, в настоящее время используют для борьбы с сельскохозяйственными вредителями.
Медный купорос CuSO4•5Н2O широко используют в сельском хозяйстве для борьбы с вредителями растений.
«Глауберова соль» (мирабилит) Nа2SO4•10Н2O была получена немецким химиком И. Р. Глаубером при действии серной кислоты на хлорид натрия, в медицине ее используют как слабительное средство.

Гипс СаSO4•2Н2O находит широкое применение в строительном деле, в медицинской практике для накладывания гипсовых повязок, для изготовления гипсовых скульптур.
III. Тренажеры
IV. Задания для закрепления
№1. Осуществите превращения по схеме:
№2. Закончите уравнения практически осуществимых реакций в полном и кратком ионном виде:
№3. Запишите уравнения реакций взаимодействия разбавленной серной кислоты с магнием, гидроксидом железа (III), оксидом алюминия, нитратом бария и сульфитом калия в молекулярном, полном и кратком ионном виде.
Урок №25. Оксид серы (VI). Серная кислота и её соли
Физические свойства
Бесцветная летучая маслянистая жидкость, t°пл. = 17°C; t°кип. = 66°С; на воздухе «дымит», сильно поглощает влагу (хранят в запаянных сосудах).
SO 3 хорошо растворяется в 100%-ной серной кислоте, этот раствор называется олеумом.
Получение
2) Fe 2 (SO 4 ) 3 → Fe 2 O 3 + 3SO 3 (разложение при нагревании)
Химические свойства
Взаимодействие с водой
При растворении в воде дает сильную двухосновную серную кислоту:
Диссоциация протекает ступенчато:
2) Взаимодействие со щелочами
2NaOH + SO 3 → Na 2 SO 4 + H 2 O
NaOH + SO 3 (избыток) → NaHSO 4
3) Взаимодействие с основными оксидами
Na 2 O + SO 3 → Na 2 SO 4
Физические свойства
Тяжелая маслянистая жидкость («купоросное масло»); r = 1,84 г/см 3 ; нелетучая, хорошо растворима в воде – с сильным нагревом; t°пл. = 10,3°C, t°кип. = 296°С, очень гигроскопична, обладает водоотнимающими свойствами (обугливание бумаги, дерева, сахара).
Помните! Кислоту вливать малыми порциями в воду, а не наоборот!
Кислоту вливать малыми порциями в воду, а не наоборот!
Производство серной кислоты
1-я стадия. Печь для обжига колчедана
4FeS 2 + 11O 2 → 2Fe 2 O 3 + 8SO 2 + Q
1) измельчение железного колчедана (пирита)
2) метод «кипящего слоя»
3) 800°С; отвод лишнего тепла
4) увеличение концентрации кислорода в воздухе
2-я стадия. Контактный аппарат
После очистки, осушки и теплообмена сернистый газ поступает в контактный аппарат, где окисляется в серный ангидрид (450°С – 500°С; катализатор V 2 O 5 ):
nSO 3 + H 2 SO 4 (конц) → (H 2 SO 4 • nSO 3 ) (олеум)
Воду использовать нельзя из-за образования сернокислотного тумана. Применяют керамические насадки и принцип противотока.
Химические свойства разбавленной серной кислоты
1) Диссоциация протекает ступенчато:
2) Взаимодействие с металлами:
Разбавленная серная кислота растворяет только металлы, стоящие в ряду напряжений левее водорода:
Zn 0 + H 2 +1 SO 4 (разб) → Zn +2 SO 4 + H 2 0 ↑
Zn 0 + 2H + → Zn 2+ + H 2 0 ↑
3) Взаимодействие с основными и амфотерными оксидами:
CuO + H 2 SO 4 → CuSO 4 + H 2 O
CuO + 2H + → Cu 2+ + H 2 O
4) Взаимодействие с основаниями:
· H 2 SO 4 + 2NaOH → Na 2 SO 4 + 2H 2 O (реакция нейтрализации)
Если кислота в избытке, то образуется кислая соль:
· H 2 SO 4 + Cu(OH) 2 → CuSO 4 + 2H 2 O
2H + + Cu(OH) 2 → Cu 2+ + 2H 2 O
5) Обменные реакции с солями:
BaCl 2 + H 2 SO 4 → BaSO 4 ↓ + 2HCl
Ba 2+ + SO 4 2- → BaSO 4 ↓
Качественная реакция на сульфат-ион
Образование белого осадка BaSO 4 (нерастворимого в кислотах) используется для идентификации серной кислоты и растворимых сульфатов.
MgCO 3 + H 2 SO 4 → MgSO 4 + H 2 O + CO 2 ↑
MgCO 3 + 2H + → Mg 2+ + H 2 O + CO 2 ↑
Применение серной кислоты
в производстве минеральных удобрений;
как электролит в свинцовых аккумуляторах;
для получения различных минеральных кислот и солей;
в производстве химических волокон, красителей, дымообразующих веществ и взрывчатых веществ;
в нефтяной, металлообрабатывающей, текстильной, кожевенной и др. отраслях промышленности;
в пищевой промышленности — зарегистрирована в качестве пищевой добавки E513(эмульгатор);
в промышленном органическом синтезе в реакциях:
дегидратации (получение диэтилового эфира, сложных эфиров);
гидратации (получение этанола);
сульфирования (получение СМС и промежуточные продукты в производстве красителей);
Самый крупный потребитель серной кислоты — производство минеральных удобрений. На 1 т P₂O₅ фосфорных удобрений расходуется 2,2-3,4 т серной кислоты, а на 1 т (NH₄)₂SO₄ — 0,75 т серной кислоты. Поэтому сернокислотные заводы стремятся строить в комплексе с заводами по производству минеральных удобрений.
Применение солей серной кислоты
Железный купорос FеSО 4 •7Н 2 O применяли раньше для лечения чесотки, гельминтоза и опухолей желез, в настоящее время используют для борьбы с сельскохозяйственными вредителями.
Медный купорос CuSO 4 •5Н 2 O широко используют в сельском хозяйстве для борьбы с вредителями растений.
«Глауберова соль» (мирабилит) Nа 2 SO 4 •10Н 2 O была получена немецким химиком И. Р. Глаубером при действии серной кислоты на хлорид натрия, в медицине ее используют как слабительное средство.
«Бариевая каша» BaSO 4 обладает способностью задерживать рентгеновские лучи в значительно большей степени, чем ткани организма. Это позволяет рентгенологам при заполнении «бариевой кашей» полых органов определить в них наличие анатомических изменений.
Гипс СаSO 4 •2Н 2 O находит широкое применение в строительном деле, в медицинской практике для накладывания гипсовых повязок, для изготовления гипсовых скульптур.