Как называется hcn в химии
Циановодород
Циановодород
| Синильная кислота | |
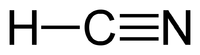 | |
 | |
| Общие | |
|---|---|
| Систематическое наименование | циановодород, синильная кислота |
| Химическая формула | HCN |
| Отн. молек. масса | 27,02 а. е. м. |
| Молярная масса | 27,02 г/моль |
| Физические свойства | |
| Плотность вещества | 0.687 г/см³ |
| Состояние (ст. усл.) | жидкость |
| Термические свойства | |
| Температура плавления | −13,3 °C |
| Температура кипения | 26,7 °C |
| Энтальпия (ст. усл.) | 95 кДж/моль |
| Химические свойства | |
| Растворимость в воде | в любых пропорциях г/100 мл |
| Классификация | |
| номер CAS | [74-90-8] |
Большая стабильность первой структуры обусловлена меньшими значениями эффективных зарядов атомов
Безводная синильная кислота является сильно ионизирующим растворителем, растворенные в нем электролиты хорошо диссоциируют на ионы. Его относительная диэлектрическая проницаемость при 25° С равна 107 (выше, чем у воды). Это обусловлено линейной ассоциацией полярных молекул HCN за счет образования водородных связей.
Синильная кислота содержится в некоторых растениях, коксовом газе, табачном дыме, выделяется при термическом разложении нейлона, полиуретанов.
Содержание
Свойства
Пары синильной кислоты горят на воздухе фиолетовым пламенем с образованием Н2О, СО2 и N2. В смеси кислорода со фтором горит с выделением большого количества тепла:
Синильная кислота широко применяется в органическом синтезе. Она реагирует с карбонильными соединениями, образуя цианогидриды:
С галогеналканами образует нитрилы (реакция Кольбе):
С алкенами и алкинами реагирует, присоединяясь к кратным связям:
Легко полимеризуется в присутствии основания (часто со взрывом). Образует аддукты, напр. HCN-CuCl.
Получение
В настоящий момент есть три наиболее распространенных метода получения синильной кислоты в промышленных масштабах:
Применение
Является сырьём для получения акрилонитрила, метилметакрилата, адипонитрила и других соединений.
В медицине в малых дозах (!) используется как сильное седативное средство.
Соли синильной кислоты называются цианидами. Цианиды подвержены сильному гидролизу. При хранении водных растворов цианидов при доступе диоксида углерода они разлагаются:
Цианиды тяжёлых металлов термически неустойчивы, в воде, кроме цианида ртути Hg(CN)2, нерастворимы. При окислении цианиды образуют цианаты:
Многие металлы при действии избытка цианида калия или цианида натрия дают комплексные соединения, что используется, например, для извлечения золота и серебра из руд:
Биологические свойства
При вдыхании небольших концентраций синильной кислоты наблюдается царапанье в горле, горький вкус во рту, головная боль, тошнота, рвота, боли за грудиной. При нарастании интоксикации уменьшается частота пульса, усиливается одышка, развиваются судороги, наступает потеря сознания. При этом цианоз отсутствует (содержание кислорода в крови достаточное, нарушена его утилизация в тканях).
Боевое отравляющее вещество
Впервые в роли боевого отравляющего вещества синильная кислота была использована французской армией 1 июля 1916 года. Однако по ряду причин, как то:
последующее использование синильной кислоты в этой роли прекратилось.
Отравляющее вещество
Антидот
Для лечения отравлений синильной кислотой известно несколько антидотов, которые могут быть разделены на две группы. Лечебное действие одной группы антидотов основано на их взаимодействии с синильной кислотой с образованием нетоксичных продуктов. К таким препаратам относятся, например, коллоидная сера и различные политионаты, переводящие синильную кислоту в малотоксичную роданистоводородную кислоту, а также альдегиды и кетоны (глюкоза, диоксиацетон и др.), которые химически связывают синильную кислоту с образованием циангидринов. К другой группе антидотов относятся препараты, вызывающие образование в крови метгемоглобина: синильная кислота связывается метгемоглобином и не доходит до цитохромоксидазы. В качестве метгемоглобинообразователей применяют метиленовую синь, а также соли и эфиры азотистой кислоты.
Сравнительная оценка антидотных средств: метиленовая синь предохраняет от двух смертельных доз, тиосульфат натрия и тетратиосульфат натрия — от трех доз, азотистокислый натрий и этилнитрит — от четырех доз, метиленовая синь совместно с тетратиосульфатом — от шести доз, амилнитрит совместно с тиосульфатом — от десяти доз, азотистокислый натрий совместно с тиосульфатом — от двадцати смертельных доз синильной кислоты.
Литература
Полезное
Смотреть что такое «Циановодород» в других словарях:
циановодород — cianido rūgštis statusas T sritis chemija formulė HCN atitikmenys: angl. hydrocyanic acid; hydrogen cyanide; Prussian acid rus. синильная кислота; цианистоводородная кислота; циановодород ryšiai: sinonimas – vandenilio cianidas … Chemijos terminų aiškinamasis žodynas
Синильная кислота — Синильная кислота … Википедия
Зоман — Зоман … Википедия
Цианистый водород — Синильная кислота Общие Систематическое наименование циановодород, синильная кислота Химическая фор … Википедия
ЦИАНИДЫ — (циановодород, HCN), соли или эфиры синильной кислоты. Наиболее важное значение имеют цианид натрия (NaCN) и цианид калия (KCN), которые оба являются смертельными ядами и обладают характерным запахом миндаля. Находят применение во многих отраслях … Научно-технический энциклопедический словарь
ДЕРАТИЗАЦИЯ — крысоистребление. Сейчас термин Д. означает истребление и ряда др. вредных грызунов, приносящих ущерб народному х ву. Д. включает предупредительные и истребительные меры борьбы. Предупредительные меры: поддержание чистоты в дворах, складах,… … Сельскохозяйственный словарь-справочник
Монооксид углерода — Общие Систематическое наименование Монооксид углерода Химическая формула … Википедия
Бериллий — 4 Литий ← Бериллий → Бор … Википедия
Бензпирен — Бензпирен … Википедия
Боевое отравляющее вещество — Отравляющие вещества (ОВ) токсичные химические соединения, предназначенные для поражения живой силы противника. ОВ могут воздействовать на организм через органы дыхания, кожные покровы и пищеварительный тракт. Боевые свойства (боевая… … Википедия
Цианистый водород
Цианистый водород
| Синильная кислота | |
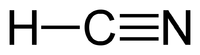 | |
 | |
| Общие | |
|---|---|
| Систематическое наименование | циановодород, синильная кислота |
| Химическая формула | HCN |
| Отн. молек. масса | 27,02 а. е. м. |
| Молярная масса | 27,02 г/моль |
| Физические свойства | |
| Плотность вещества | 0.687 г/см³ |
| Состояние (ст. усл.) | жидкость |
| Термические свойства | |
| Температура плавления | −13,3 °C |
| Температура кипения | 26,7 °C |
| Энтальпия (ст. усл.) | 95 кДж/моль |
| Химические свойства | |
| Растворимость в воде | в любых пропорциях г/100 мл |
| Классификация | |
| номер CAS | [74-90-8] |
Большая стабильность первой структуры обусловлена меньшими значениями эффективных зарядов атомов
Безводная синильная кислота является сильно ионизирующим растворителем, растворенные в нем электролиты хорошо диссоциируют на ионы. Его относительная диэлектрическая проницаемость при 25° С равна 107 (выше, чем у воды). Это обусловлено линейной ассоциацией полярных молекул HCN за счет образования водородных связей.
Синильная кислота содержится в некоторых растениях, коксовом газе, табачном дыме, выделяется при термическом разложении нейлона, полиуретанов.
Содержание
Свойства
Пары синильной кислоты горят на воздухе фиолетовым пламенем с образованием Н2О, СО2 и N2. В смеси кислорода со фтором горит с выделением большого количества тепла:
Синильная кислота широко применяется в органическом синтезе. Она реагирует с карбонильными соединениями, образуя цианогидриды:
С галогеналканами образует нитрилы (реакция Кольбе):
С алкенами и алкинами реагирует, присоединяясь к кратным связям:
Легко полимеризуется в присутствии основания (часто со взрывом). Образует аддукты, напр. HCN-CuCl.
Получение
В настоящий момент есть три наиболее распространенных метода получения синильной кислоты в промышленных масштабах:
Применение
Является сырьём для получения акрилонитрила, метилметакрилата, адипонитрила и других соединений.
В медицине в малых дозах (!) используется как сильное седативное средство.
Соли синильной кислоты называются цианидами. Цианиды подвержены сильному гидролизу. При хранении водных растворов цианидов при доступе диоксида углерода они разлагаются:
Цианиды тяжёлых металлов термически неустойчивы, в воде, кроме цианида ртути Hg(CN)2, нерастворимы. При окислении цианиды образуют цианаты:
Многие металлы при действии избытка цианида калия или цианида натрия дают комплексные соединения, что используется, например, для извлечения золота и серебра из руд:
Биологические свойства
При вдыхании небольших концентраций синильной кислоты наблюдается царапанье в горле, горький вкус во рту, головная боль, тошнота, рвота, боли за грудиной. При нарастании интоксикации уменьшается частота пульса, усиливается одышка, развиваются судороги, наступает потеря сознания. При этом цианоз отсутствует (содержание кислорода в крови достаточное, нарушена его утилизация в тканях).
Боевое отравляющее вещество
Впервые в роли боевого отравляющего вещества синильная кислота была использована французской армией 1 июля 1916 года. Однако по ряду причин, как то:
последующее использование синильной кислоты в этой роли прекратилось.
Отравляющее вещество
Антидот
Для лечения отравлений синильной кислотой известно несколько антидотов, которые могут быть разделены на две группы. Лечебное действие одной группы антидотов основано на их взаимодействии с синильной кислотой с образованием нетоксичных продуктов. К таким препаратам относятся, например, коллоидная сера и различные политионаты, переводящие синильную кислоту в малотоксичную роданистоводородную кислоту, а также альдегиды и кетоны (глюкоза, диоксиацетон и др.), которые химически связывают синильную кислоту с образованием циангидринов. К другой группе антидотов относятся препараты, вызывающие образование в крови метгемоглобина: синильная кислота связывается метгемоглобином и не доходит до цитохромоксидазы. В качестве метгемоглобинообразователей применяют метиленовую синь, а также соли и эфиры азотистой кислоты.
Сравнительная оценка антидотных средств: метиленовая синь предохраняет от двух смертельных доз, тиосульфат натрия и тетратиосульфат натрия — от трех доз, азотистокислый натрий и этилнитрит — от четырех доз, метиленовая синь совместно с тетратиосульфатом — от шести доз, амилнитрит совместно с тиосульфатом — от десяти доз, азотистокислый натрий совместно с тиосульфатом — от двадцати смертельных доз синильной кислоты.
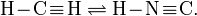
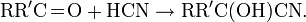
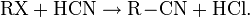
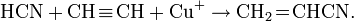
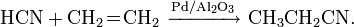
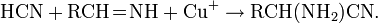
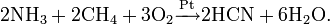
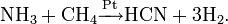
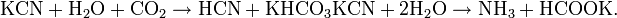
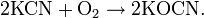
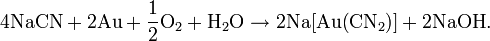
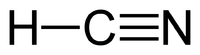



 кДж.
кДж.










