гистиоцитоз код по мкб 10 у детей
Другие уточненные заболевания с вовлечением лимфоретикулярной ткани и ретикулогистиоцитарной системы (D76)
Гистиоцитоз X (хронический)
Семейный гемофагоцитарный ретикулез
Гистиоцитозы из мононуклеарных фагоцитов
При необходимости идентифицировать инфекционный возбудитель или болезнь используют дополнительный код.
Синусный гистиоцитоз с массивной лимфаденопатией
Алфавитные указатели МКБ-10
Внешние причины травм — термины в этом разделе представляют собой не медицинские диагнозы, а описание обстоятельств, при которых произошло событие (Класс XX. Внешние причины заболеваемости и смертности. Коды рубрик V01-Y98).
Лекарственные средства и химические вещества — таблица лекарственных средств и химических веществ, вызвавших отравление или другие неблагоприятные реакции.
В России Международная классификация болезней 10-го пересмотра (МКБ-10) принята как единый нормативный документ для учета заболеваемости, причин обращений населения в медицинские учреждения всех ведомств, причин смерти.
МКБ-10 внедрена в практику здравоохранения на всей территории РФ в 1999 году приказом Минздрава России от 27.05.97 г. №170
Выход в свет нового пересмотра (МКБ-11) планируется ВОЗ в 2022 году.
Сокращения и условные обозначения в Международой классификации болезней 10-го пересмотра
БДУ — без дополнительных уточнений.
НКДР — не классифицированный(ая)(ое) в других рубриках.
† — код основной болезни. Главный код в системе двойного кодирования, содержит информацию основной генерализованной болезни.
* — факультативный код. Дополнительный код в системе двойного кодирования, содержит информацию о проявлении основной генерализованной болезни в отдельном органе или области тела.
Гистиоцитоз Х – это системное заболевание, характеризующееся образованием специфических клеточных гранулем в различных органах и тканях. Наиболее типичные клинические проявления включают кожные высыпания, кашель, односторонний экзофтальм. Также наблюдаются выпадение зубов, увеличение периферических лимфатических узлов, признаки несахарного диабета (полиурия, полидипсия). Диагноз верифицируется путем гистологического исследования кожи, легких или лимфатических узлов. В качестве лечения применяются противовоспалительные препараты (глюкокортикостероиды), химиотерапевтические средства. В случае выраженного поражения легких производится трансплантация органа.
МКБ-10
Общие сведения
Гистиоцитоз Х (гистиоцитоз из клеток Лангерганса, легочная эозинофильная гранулема) – системная патология, при которой происходит активная пролиферация клеток Лангерганса в тканях легких, костей, центральной нервной системы, ретикуло-эндотелиальной системы (в печени, селезенке, лимфатических узлах). Течение заболевания варьирует в зависимости от формы и может быть доброкачественным со спонтанной ремиссией или быстропрогрессирующим с высокой вероятностью летального исхода. Распространенность гистиоцитоза составляет 5 на 1 000 000 человек. Преимущественно страдают дети, подростки, взрослые в возрасте 20-30 лет. Гистиоцитоз встречается только у представителей белой расы, чаще у мужчин (соотношение с женщинами 2:1).
Причины
На сегодняшний день точная причина гистиоцитоза неизвестна. Предполагается роль иммунной аутоагрессии, вызванной инфицированием вируса герпеса 6-го типа. До сих пор ведутся научные дебаты о наследственной природе заболевания. У 50% пациентов в патологических клетках Лангерганса была обнаружена соматическая мутация гена V600E, кодирующего внутриклеточный сигнальный белок BRAF. Табакокурение рассматривается как один из основных факторов риска (более 90% больных являются курильщиками). Подтверждением этого служит тот факт, что симптоматика уменьшается после прекращения курения даже без применения какого-либо лечения.
Патогенез
Механизм развития гистиоцитоза изучен недостаточно. Основным звеном патогенеза считается накопление в тканях дендритных клеток (клеток Лангерганса, или гистиоцитов). Дендритные клетки синтезируются в костном мозге и мигрируют в дерму, паренхиму легких, ретикулоэндотелиальную систему и т.д. Их основная функция заключается в поглощении антигенов, поступающих из окружающей среды, и презентации Т и В-лимфоцитам для формирования иммунного ответа. После контакта с гистиоцитами лимфоциты начинают выделять провоспалительные цитокины и медиаторы, повышающие активность гистиоцитов и придающие им высокую подвижность.
При гистиоцитозе по неизвестным причинам у дендритных клеток нарушается процесс апоптоза (запрограммированной клеточной гибели). В сочетании с выделяемыми лимфоцитами факторами роста это приводит к их интенсивной пролиферации с последующим слиянием с эозинофилами. В результате образуются гигантоклеточные гранулемы, которые постепенно начинают замещать нормально функционирующую ткань того или иного органа. Присутствие большого количества Т-лимфоцитов в гранулемах позволяет предположить наличие специфического антигена.
Классификация
По локализации очагов выделяют моносистемную форму с единичным или множественным поражением одной анатомической области и мультисистемную форму с признаками нарушения функции органов или без них. Традиционно различают следующие клинические формы:
Симптомы гистиоцитоза
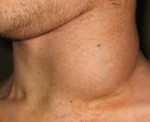
Клиническая картина крайне разнообразна. Заболевание начинается с появления общей слабости, повышения температуры тела, которая в основном бывает субфебрильной, но может достигать 40°С. Возможны диспепсические нарушения – тошнота, рвота, диарея. Кожа покрывается зудящими очагами гиперемии с чешуйками или корочками. Иногда наблюдаются геморрагические элементы, длительно незаживающие язвы. Высыпания присутствуют на коже головы, наружного слухового прохода, в области естественных складок (паховой, подмышечной). Увеличиваются лимфатические узлы по всему телу.
Возникает одышка, упорный сухой кашель и боли в грудной клетке. Затруднение дыхания может беспокоить только во время физической нагрузки или присутствовать даже в покое. Присоединяются тупые боли или тяжесть в правом подреберье из-за увеличения печени (гепатомегалии). При выраженном поражении печени кожа приобретает желтушный оттенок. Увеличение селезенки сопровождается болью в левом подреберье. Некоторые пациенты испытывают боль в костях. Деструкция костей глазницы ведет к образованию экзофтальма, чаще одностороннего. Боль в ухе ошибочно диагностируется как бактериальный или грибковый отит и безуспешно лечится антибактериальными и противогрибковыми препаратами. Остеолизис нижней челюсти приводит к периодонтитам и выпадению зубов.
При длительном течении гистиоцитоза больной начинает терять вес. В тяжелых случаях встречаются признаки костномозговой недостаточности – анемический синдром (бледность кожи, головокружение, учащенное сердцебиение), склонность к кровотечениям, сниженная сопротивляемость к инфекциям. Формирование гистиоцитарных гранулем в задней доле гипофиза вызывает угнетение выработки антидиуретического гормона. В результате развивается симптоматика несахарного диабета – сухость во рту, постоянная жажда (полидипсия) и повышенное мочеотделение (полиурия).
Осложнения
Широкая вариативность клинической картины при гистиоцитозе обусловливает разнообразие осложнений. Наиболее характерными считаются патологические переломы костей, особенно компрессионный перелом позвоночника. Типичные осложнения со стороны легких – легочная артериальная гипертензия вследствие диффузного фиброза легочной ткани, спонтанный пневмоторакс из-за разрыва тонкостенных булл. Массивная инфильтрация печени вызывает цирроз с печеночно-клеточной недостаточностью. К редким осложнениям относятся неблагоприятные последствия дефицита антидиуретического гормона (несахарного диабета) в виде гиперосмолярной гипогидратации, проявляющейся двигательным беспокойством, мышечными судорогами, нарушением сознания, вплоть до глубокой комы.
Диагностика
Пациентами с гистиоцитозом занимаются различные врачи – гематологи, пульмонологи, педиатры. Профиль специальности зависит от возраста больного и преимущественно пораженного органа. При общем осмотре отмечаются цианоз (синюшность) губ, участие в дыхании вспомогательной мускулатуры (при дыхательной недостаточности). При аускультации легких выслушивается жесткое дыхание, сухие хрипы по всем легочным полям. Дополнительное обследование включает:
Дифференциальный ряд включает большое количество нозологий и зависит от клинических симптомов гистиоцитоза. Кожные высыпания нужно дифференцировать с экземой, псориазом, атопическим дерматитом. Поражение легких следует отличать от туберкулеза, саркоидоза, лимфогранулематоза. Генерализованный гистиоцитоз дифференцируют с гематологическими заболеваниями (гемофагоцитарный синдром, острый лейкоз). Очаги деструкции костей требуют исключения гиперпаратиреоза, множественной миеломы, остеомиелита.
Лечение гистиоцитоза
Пациенты обязательно должны быть госпитализированы в стационар. При тяжелой дыхательной недостаточности показаны ингаляции кислорода или перевод на искусственную вентиляцию легких. При наличии признаков костномозговой недостаточности прибегают к переливанию компонентов крови и применению гранулоцитарного колониестимулирующего фактора.
Этиотропной терапии гистиоцитоза Х не существует. Наиболее важный этап в лечении – отказ от курения. Прекращение курения вызывает улучшение клинической, лабораторной, рентгенологической картины. В качестве патогенетической терапии используют глюкокортикостероиды (преднизолон, метилпреднизолон), химиотерапевтические средства (винбластин, меркаптопурин, этопозид).
Для лечения несахарного диабета назначается заместительная гормональная терапия аналогами вазопрессина (десмопрессин) в виде интраназального спрея или в таблетированной форме. При небольших остеолитических очагах выполняют кюретаж, при выраженной инфильтрации костей – резекцию или дистанционную гамма-терапию. При массивном деструктивном процессе в легочной ткани проводится трансплантация легких.
Прогноз и профилактика
Гистиоцитоз из клеток Лангерганса у детей. Клинические рекомендации.
Гистиоцитоз из клеток Лангерганса у детей
Оглавление
Ключевые слова
гистиоцитоз из клеток Лангерганса
Список сокращений
ГКЛ– гистиоцитоз из клеток Лангерганса
ПКЛ – патологическая клетка Лангерганса
АЛТ- аланиновая аминотрансфераза
АСТ – аспарагиновая аминотрансфераза
КТ – компьютерная томография
МРТ – магнитно-резонансная томография
УЗИ – ультразвуковое исследование
ВИЧ – вирус иммунодефицита человека
ПЦР – полимеразная цепная реакция
ЭБВ – вирус Эпштейн-Барр
МСОР+- мультисистемная форма ГКЛ с вовлечением «органов риска»
МСОР- мультисистемная форма ГКЛ без вовлечения «органов риска»
НАЗ – неактивное заболевание
АЗ – активное заболевание
Термины и определения
Гистиоцитоз из клеток Лангерганса – опухоль миелоидной природы, морфологическим субстратом которой являются патологические клетки Лангерганса, фенотипически сходные с эпидермальными клетками Лангерганса
Неактивное заболевание (НАЗ) – статус заболевания, при котором все обратимые очаги поражения претерпели обратное развитие
Активное заболевание (АЗ) – статус заболевания, при котором сохраняются исходные или выявляются новые очаги поражения
Реактивация заболевания – появление новых очагов поражения после достижения статуса НАЗ
Органы риска – органы (печень, селезенка, костный мозг), вовлечение которых в патологический процесс ассоциировано с плохим прогнозом заболевания
Перманентные осложнения (ПО) – необратимые изменения структуры и/или функции органов в исходе поражения при ГКЛ.
Критерии ответа на терапию
1. Краткая информация
1.1 Определение
Гистиоцитоз из клеток Лангерганса – новообразование миелоидного гистогенеза с вариабельным клиническим течением, в основе которого лежит активация сигнального пути MEK-ERK в клетках-предшественниках дендритных клеток. Локализация патологических очагов вариабельна: наиболее распространены поражения скелета, кожи, задней доли гипофиза, лимфатических узлов, печени, селезенки, костного мозга, легких и центральной нервной системы.
1.2 Этиология и патогенез
Гистиоцитоз из клеток Лангерганса развивается в результате неопластической трансформации предшественников дендритных клеток. Наиболее подробно расшифрованным и распространенным трансформирующим молекулярным событием является соматическая миссенс-мутация в гене BRAF, приводящая к замене валина на глутамин в 600 положении (обозначается как BRAF V600E) и выявляемая у 50-60% пациентов. Описаны также альтернативные трансформирующие механизмы, как то мутации в гене MAP2K1, ARAF, редкие делеции/инсерции в гене Показано, что все идентифицированные трансформирующие события приводят к активации сигнального пути MEK-ERK. Является ли активация этого сигнального пути достаточным механизмом для формирования клинического фенотипа, или существуют дополнительные модифицирующие генетические или эпигенетические факторы, определяющие течение болезни, остается предметом изучения. Фенотип предшественников, в которых происходит трансформирующее событие или события, также остается предметом исследований. Согласно одной из теорий, трансформация резидентных тканевых ДК формирует фенотип локализованных форм ГКЛ, в то время как трансформация костномозговых предшественников ДК ведет к развитию диссеминированных форм болезни. Для ГКЛ характерен инфильтрирующий рост с формированием в очагах поражения характерного клеточного сообщества, состоящего, помимо собственно опухолевых клеток, из полиморфного пула лейкоцитов. Состав инфильтрата варьирует и может включать эозинофилы, Т лимфоциты, гигантские многоядерные клетки и макрофаги.[1,2]
1.3 Эпидемиология
Данные о заболеваемости и распространенности ГКЛ в России ограничены, экстраполяция международных данных дает заболеваемость 5-7 на 106 детского населения в год. Соотношение полов составляет 2:1 (м:д).
1.4 Кодирование по МКБ-10
D76.0 – гистиоцитоз из клеток Лангерганса, не классифицированный в
С96.0 – болезнь Леттерера-Зиве
1.5 Классификация
Гистиоцитоз из клеток Лангерганса отнесен к группе “L” в современной классификации гистиоцитозов. В зависимости от локализации поражения выделяют моносистемную форму ГКЛ, мультисистемную форму ГКЛ с поражением «органов риска», мультисистемную форму ГКЛ без поражения «органов риска» и изолированный легочный ГКЛ. К органам риска относят печень, селезенку и костный мозг. При формулировке диагноза, помимо формы заболевания, принято указывать анатомическую локализацию очагов поражения. [3]
2. Диагностика
Диагностика ГКЛ включает три этапа: 1) установление клиничкеского диагноза и гистологическая верификация ГКЛ; 2) определение распространенности/стадирование; 3) верификация природы трансформирующего события 5;
На первом этапе на основании характерных клинических проявлений (жалоб, физикального и первичного лабораторного и инструментального обследования) устанавливают клинический диагноз ГКЛ. Верификация диагноза возможна только на основании иммуногистохимического исследования биопсийного материала, полученного из очага поражения. Выбор зоны биопсии осуществляется исходя из принципа минимальной инвазии. Строго противопоказаны радикальные хирургические вмешательства, направленные на радикальное удаление опухоли. Диагноз считается подтвержденным, если при характерной морфологии клеточного инфильтрата на патологических клеточных элементах выявляется экспрессия CD1a или лангерин (CD207). На основании систематического обследования определяют распространенность заболевания. На основании молекулярно-генетического исследования устанавливают наличие или отсутствие мутации BRAF V600E. Пример формулировки диагноза: гистиоцитоз из клеток Лангерганса, мультисистемная форма с поражением кожи, скелета и легких, BRAF V600E-позитивный.
2.1 Жалобы и анамнез
Клиническая презентация ГКЛ разнообразна и отражает распространенность процесса. Моносистемные формы, особенно унифокальное поражение скелета малосимптомны. Жалобы и симптомы при мультисистемной форме ГКЛ соответствуют локусам поражения.
2.2 Физикальное обследование
Физикальное обследование, помимо оценки тяжести состояния, физического и психического развития, должно быть сконцентрировано на выявлении характерных признаков поражения при ГКЛ
2.3 Лабораторная диагностика
Пациентам с подозрением на гистиоцитоз из клеток Лангерганса рекомендовано выполнение:
Уровень убедительности рекомендаций В (уровень достоверности доказательств – 3)
2.4 Инструментальная диагностика
Пациентам с подозрением на гистиоцитоз из клеток Лангерганса рекомендовано проведение:
Уровень убедительности рекомендаций В (уровень достоверности доказательств – 3)
2.5 Иная диагностика
Пациентам с подозрением на гистиоцитоз из клеток Лангерганса рекомендовано выполнение:
Уровень убедительности рекомендаций В (уровень достоверности доказательств – 3)
3. Лечение
3.1 Консервативное лечение
Цели консервативного лечения при ГКЛ – излечение пациента, предотвращение реактивации (рецидива) заболевания и предотвращение формирования перманентных осложнений. План терапии зависит от распространенности поражения. При моносистемном унифокальном поражении проводят локальную или топическую терапию. При мультифокальном поражении и мультисистемных формах ГКЛ необходимо проведение программной химиотерапии. При реактивации заболевания проводят терапию второй линии, состав которой определяется локализацией поражения и вовлечением «органов риска».
унифокальное поражение скелета
кюретаж остеолитического очага
иньекция кортикостероидов в очаг поражения (доза 2 мг/кг массы тела по преднизолону)
унифокальное поражение лимфатического узла
эксцизионная биопсия пораженного лимфатического узла
моносистемное поражение кожи
топическая терапия кортикостероидами высокой эффективности
мультисистемная форма или моносистемное мультифокальное поражение скелета
Уровень убедительности рекомендаций В (уровень достоверности доказательств – 2)
Фазу инициальной терапии №1 рекомендовано проводить по схеме:
винбластин в дозе 6 мг/м2 внутривенно капельно в дни 1,8,15,22,29,36
преднизолон в дозе 40 мг/м2 внутрь или внутривенно в дни 1-28, в дозе 20 мг/м2 в дни 28-35, в дозе 10 мг/м2 в дни 36-42.
Уровень убедительности рекомендаций В (уровень достоверности доказательств – 2)
Фазу инициальной терапии №2 рекомендовано проводить по схеме:
винбластин в дозе 6 мг/м2 внутривенно капельно в дни 1,8,15,22,29,36
преднизолон в дозе 40 мг/м2 внутрь или внутривенно в дни 1-3, 8-10, 15-17, 22-24, 29-31, 36-38.
Уровень убедительности рекомендаций В (уровень достоверности доказательств – 2)
Комментарий: при достижении статуса неактивного заболевания (НАЗ) после фазы инициальной терапии №1 следует начать поддерживающую терапию. При достижении ответа после фазы инициальной терапии №1 АЗ-промежуточный или АЗ-улучшение следует выполнить фазу инициальной терапии №2. При отсутствии ответа на фазу инициальной терапии №1 (АЗ-ухудшение) следует начать выполнение терапии второй линии.
Фазу поддерживающей терапии рекомендовано проводить по схеме:
винбластин в дозе 6 мг/м2 внутривенно капельно в день 1 цикла
преднизолон в дозе 40 мг/м2 внутрь или внутривенно в дни 1-5 цикла
циклы поддерживающей терапии проводятся с интервалом в 21 день в течение 40-46 недель (суммарная длительность терапии 52 недели)
Уровень убедительности рекомендаций В (уровень достоверности доказательств – 2)
Терапию второй линии при реактивации ГКЛ без вовлечения «органов риска» рекомендовано проводить по схеме:
Рекомендовано повторить терапию первой линии
Терапию второй линии при вовлечении «органов риска» рекомендовано проводить по схеме:
интенсивная фаза (3 цикла)
2-хлордезоксиаденозин (2-CdA) в дозе 9мг/м2/сутки в дни 1-5
цитозина арабинозид (AraC) в дозе 500 мг/м2/сутки в дни 1-5
метилпреднизолон 2 мг/кг/сутки в дни 1-5
Поддерживающая терапия фаза 1 (3 цикла)
2-хлордезоксиаденозин (2-CdA) в дозе 5 мг/м2/сутки в дни 1-5
Поддерживающая терапия фаза 2
винбластин в дозе 6 мг/м2 внутривенно капельно в день 1 цикла
преднизолон в дозе 40 мг/м2 внутрь или внутривенно в дни 1-5 цикла
циклы винбластин/преднизолон проводятся с интервалом в 21 день до окончания лечения (суммарная длительность терапии составляет 52 недели)
Уровень убедительности рекомендаций В (уровень достоверности доказательств – 2)
Комментарий: комбинированная высокодозная химиотерапия 2-CdA и AraC ассоциирована с продленной аплазией кроветворения и дефицитом клеточного иммунитета. Проведение данной программы требует интенсивной сопроводительной терапии, которая включает, но не исчерпывается следующими компонентами:
Пациентам с гистиоцитозом из клеток Лангерганса рекомендованопроведение трансфузии облученных компонентов крови
Пациентам с гистиоцитозом из клеток Лангерганса рекомендованопроведение противогрибковой терапии, включающей препараты для внутривенного и энтерального введения, активные в отношении плесневых грибов
Пациентам с гистиоцитозом из клеток Лангерганса рекомендовано обеспечение доступа к отделению реанимации и интенсивной терапии, включая технологии почечно-заместительной терапии. Проведение данной терапии в клинике, не имеющей доступа к указанным технологиям, не рекомендовано
Пересчет доз химиопрепаратов для пациентов с массой тела менее 10 кг
винбластин 6 мг/м2 = 0,2 мг/кг
преднизолон 40 мг/м2 = 1,3 мг/кг
2-CdA 9 мг/м2 = 0,3 мг/кг
2-CdA 5 мг/м2 = 0,15 мг/кг
Терапия в особых клинических ситуациях
Пациентам с гистиоцитозом из клеток Лангерганса с нейродегенеративным поражением ЦНС рекомендовано проведение терапии по схеме:
Два варианта терапии на выбор лечащего врача
цитозина арабинозид (AraC) в дозе 150 мг/м2/сутки в дни 1-5, 12 циклов с интервалом 28 дней
Иммуноглобулин для внутривенного введения в дозе 0,5 мг/кг/курс, 12 циклов с интервалом 28 дней
Пациентам с гистиоцитозом из клеток Лангерганса с туморозным поражением ЦНС рекомендовано проведение терапии по схеме:
2-хлордезоксиаденозин (2-CdA) в дозе 5мг/м2/сутки в дни 1-5, 6 циклов с интервалом 28 дней
Уровень убедительности рекомендаций В (уровень достоверности доказательств – 2)
3.2 Хирургическое лечение
Хирургическое пособие при ГКЛ выполняется на этапе диагностики. Биопсия пораженного органа/ткани выполняется в объеме, необходимом для выполнения морфологического, иммуногистохимического и молекулярно-биологического исследования. При унифокальном моносистемном поражении скелета выполняют кюретаж образования с введением в очаг преднизолона в дозе 2 мг/кг.
3.3 Иное лечение
Сопроводительная антимикробная и трансфузионная терапия проводятся в соответствии с действующими клиническими рекомендациями
4. Реабилитация
Подход к реабилитация и диспансерное наблюдение пациентов с ГКЛ. Диспансерное наблюдение включает систематические осмотры и целенаправленное лабораторное и инструментальное обследование, направленное на оценку статуса исходных очагов поражения и выявление новых зон поражения. Объем обследования и рекомендуемые интервалы приведены ниже.
Клинический осмотр 1 раз в три месяца
Антропометрия 1 раз в три месяца
Оценка полового развития 1 раз в год
Клинический анализ крови 1 раз в три месяца
Биохимический анализ крови 1 раз в три месяца
Рентгенография пораженных участков скелета по показаниям
КТ легких (при исходном вовлечении) 1 раз в год
УЗИ печени с эластографией 1 раз в год
(при исходном вовлечении)
МРТ головного мозга 1 раз в год
(пациенты с исходным поражением ЦНС, несахарным диабетом)
Консультация невролога 1 раз в шесть месяцев
Консультация эндокринолога 1 раз в год
5. Профилактика и диспансерное наблюдение
Первичная профилактика ГКЛ невозможна в связи с низкой базовой заболеваемостью и неустановленными причинами болезни.
Уровень убедительности рекомендаций В (уровень достоверности доказательств – 3)
Профилактика реактивации заболевания и развития перманентных осложнений основана на полном выполнении протокола терапии первой линии
Уровень убедительности рекомендаций В (уровень достоверности доказательств – 3)
Вторичная профилактика прогрессии перманентных последствий включает исключение экспозиции к дополнительным повреждающим факторам, таким как курение при фиброзе легких и инфицирование вирусами гепатита (А, В, С) при фиброзе печени.
Уровень убедительности рекомендаций В (уровень достоверности доказательств – 3)
Критерии оценки качества медицинской помощи
Критерии качества
Уровень достоверности доказательств
Уровень убедительности рекомендаций
Выполнении биопсии пораженного органа/ткани на этапе первичной диагностики ГКЛ
Выполнение иммуногистохимического исследования биоптата с окраской на CD1a и лангерин (CD207)
Выполнение стадирующих исследований в течение не более 7 дней от установления клинического диагноза
Начало программной химиотерапии в течение не более 7 дней от верификации диагноза ГКЛ
Список литературы
Приложение А1. Состав рабочей группы
Румянцев А.Г, д.м.н., академик РАН, генеральный директор ФГБУ ФНКЦ ДГОИ им. Дмитрия Рогачева, профессор кафедры гематологии, онкологии и лучевой терапии педиатрического факультета РНИМУ им. Н.И.Пирогова
Конфликт интересов отсутствует
Приложение А2. Методология разработки клинических рекомендаций
Целевая аудитория данных клинических рекомендаций:
Педиатрия 31.08.19
Таблица П1 – Уровни достоверности доказательств
Уровень достоверности
Источник доказательств
Проспективные рандомизированные контролируемые исследования
Достаточное количество исследований с достаточной мощностью, с участием большого количества пациентов и получением большого количества данных
Как минимум одно хорошо организованное рандомизированное контролируемое исследование
Репрезентативная выборка пациентов
II (2)
Проспективные с рандомизацией или без исследования с ограниченным количеством данных
Несколько исследований с небольшим количеством пациентов
Хорошо организованное проспективное исследование когорты
Мета-анализы ограничены, но проведены на хорошем уровне
Результаты не презентативны в отношении целевой популяции
Хорошо организованные исследования «случай-контроль»
III (3)
Нерандомизированные контролируемые исследования
Исследования с недостаточным контролем
Рандомизированные клинические исследования с как минимум 1 значительной или как минимум 3 незначительными методологическими ошибками
Ретроспективные или наблюдательные исследования
Серия клинических наблюдений
Противоречивые данные, не позволяющие сформировать окончательную рекомендацию
IV (4)
Мнение эксперта/данные из отчета экспертной комиссии, экспериментально подтвержденные и теоретически обоснованные
Таблица П2 – Уровни убедительности рекомендаций
Уровень убедительности
Описание
Расшифровка
Рекомендация основана на высоком уровне доказательности (как минимум 1 убедительная публикация I уровня доказательности, показывающая значительное превосходство пользы над риском)
Метод/терапия первой линии; либо в сочетании со стандартной методикой/терапией
Рекомендация основана на среднем уровне доказательности (как минимум 1 убедительная публикация II уровня доказательности, показывающая значительное превосходство пользы над риском)
Метод/терапия второй линии; либо при отказе, противопоказании, или неэффективности стандартной методики/терапии. Рекомендуется мониторирование побочных явлений
Рекомендация основана на слабом уровне доказательности (но как минимум 1 убедительная публикация III уровня доказательности, показывающая значительное превосходство пользы над риском) или
нет убедительных данных ни о пользе, ни о риске)
Нет возражений против данного метода/терапии или нет возражений против продолжения данного метода/терапии
Рекомендовано при отказе, противопоказании, или неэффективности стандартной методики/терапии, при условии отсутствия побочных эффектов
Отсутствие убедительных публикаций I, II или III уровня доказательности, показывающих значительное превосходство пользы над риском, либо убедительные публикации I, II или III уровня доказательности, показывающие значительное превосходство риска над пользой
Порядок обновления клинических рекомендаций – пересмотр 1 раз в год.
Приложение Б. Алгоритмы ведения пациента
Алгоритм выбора терапии при мультисистемной форме гистиоцитоза из клеток Лангерганса с вовлечением «органов риска»
Приложение В. Информация для пациентов
Гистиоцитоз из клеток Лангерганса – редкое заболевание, причиной которого является мутация в одном из видов лейкоцитов – дендритных клетках. Эта мутация не является наследственной, происходит в процессе развития клеток костного мозга в организме пациента и приводит к появлению у мутантной клетки и ее потомков новых свойств: «неправильные» дендритные клетки могут мигрировать в различные органы и вызывать их повреждение. Основные типы поражения приведены ниже.
Поражение скелета: в костях образуются очаги разрушения, от единственного до множественных. Иногда в месте разрушения может случится перелом.
Поражение кожи: распространенная коричневая сыпь с чешуйками, часто располагается в складках кожи и на волосистой части гожи головы
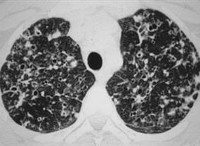
Поражение легких: в легких образуются маленькие участки воспаления, которые превращаются в пустоты, похожие на пузыри.
Костный мозг: в результате поражения костный мозг плохо вырабатывает клетки крови, в результате в анализе крови снижаются показатели гемоглобина, лейкоцитов и тромбоцитов.
Печень: в результате поражения печени нарушается ее функция, появляются изменения в биохимическом анализе крови, желтуха из-за повышения содержания билирубина и отеки из-за снижения выработки альбумина.
Задняя доля гипофиза: нарушается выработка антидиуретического гормона – регулятора баланса жидкости в организме, в результате появляется резко усиленное выделение мочи (диабет) и жажда. Такое поражение называется «несахарный диабет».
Головной мозг: при поражении головного мозга может нарушаться походка, память, другие нервные процессы, в зависимости от участка головного мозга, в котором произошло поражение
Заболевание может протекать легко, при локализованном поражении возможно спонтанное выздоровление. При распространенном поражении нарушения функции органов создают угрозу жизни пациента. Особенно тяжело протекают формы заболевания, при которых поражены так называемые «органы риска» – печень, селезенка и костный мозг. При любых формах болезни в результате поражения органа иногда может сформироваться постоянное нарушение его функции, которое нельзя исправить. К таким поражениям относят фиброз легких и печени, а также несахарный диабет.
Для установления диагноза необходимо выполнение большого количества исследований крови, пункции костного мозга, рентгеновских и томографических исследований. Обязательно выполнение биопсии пораженного органа. Чаще всего делают биопсию кожи, кости или лимфатического узла. Без результатов биопсии диагноз гистиоцитоза из клеток Лангерганса не может быть подтвержден и терапия не может быть назначена.
Целью терапии является излечение болезни, предотвращение рецидивов и поздних осложнений. Суммарная длительность терапии составляет 1 год. Сокращение длительности терапии может привести к увеличению риска рецидива болезни. При терапии в соответствии с современными программами лечения вероятность выздоровления составляет около 90%, но у 25-40% пациентов после выздоровления остаются осложнения, наиболее частое – несахарный диабет.