дисплазия соединительной ткани код по мкб 10 у взрослых
Недифференцированные дисплазии соединительной ткани (проект клинических рекомендаций)
Публикуемый проект второго пересмотра клинических рекомендаций по ведению пациентов с недифференцированными дисплазиями соединительной ткани продиктован наличием обоснованных дополнений/замечаний к ранее утвержденным (в 2018 г.) клиническим рекомендациям.
1. ТЕРМИНЫ И ОПРЕДЕЛЕНИЯ
Дисплазия (dysplasia; греч. dys- + plasis формирование, образование; син. дисгенезия) – неправильное развитие тканей и органов независимо от времени и причины их возникновения [1]. Новые и узко направленные профессиональные термины в настоящих клинических рекомендациях не используются.
1.1. Определение
Недифференцированные дисплазии соединительной ткани (НДСТ; код по МКБ-10 – М35.8) – это генетически детерминированные состояния, характеризующиеся дефектами волокнистых структур и основного вещества соединительной ткани, приводящие к нарушению формообразования органов и систем, имеющие прогредиентное течение, определяющие особенности ассоциированной патологии, а также фармакокинетики и фармакодинамики лекарственных средств [2–4].
Комментарии: генетический дефект может проявляться в любом возрасте в соответствии с временными закономерностями генной экспрессии. Реализация генетических детерминант либо в наибольшей степени определяется внешними условиями, как в случае недифференцированных дисплазий соединительной ткани (несиндромных формах дисплазии соединительной ткани, неспецифических нарушений соединительной ткани), либо мало зависит от внешних условий, как в случае наследственных нарушений соединительной ткани (дифференцированной дисплазии соединительной ткани, синдромных форм дисплазии соединительной ткани) [2–7].
1.2. Этиология и патогенез
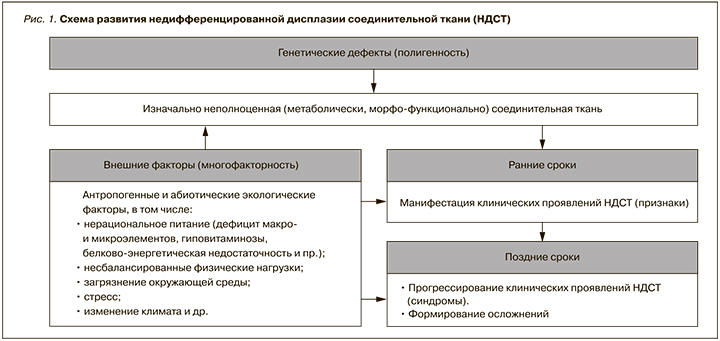
В основе развития дисплазий соединительной ткани (ДСТ) лежат мутации генов, ответственных за синтез/катаболизм структурных белков соединительной ткани или ферментов, участвующих в этих процессах [2–5] (рис. 1).
1.3. Эпидемиология
Распространенность НДСТ – 1:5. Отдельные внешние проявления дисморфогенеза соединительной ткани среди молодых – 85,4% [2–4].
Критическим периодом проявлений НДСТ является подростковый возраст, когда объем соединительной ткани увеличивается пропорционально росту и развитию организма. Как правило, у абсолютного большинства пациентов с НДСТ в возрасте старше 35 лет основную проблему составляют осложнения клинических синдромов, определяющие инвалидизацию пациентов и летальные потери в группе [2–4, 8, 9].
1.4. Кодирование по МКБ-10
1.5. Классификация
В практической работе используется Международная классификация болезней 10-го пересмотра (МКБ-10) [10]. В научных исследованиях можно пользоваться классификацией, предложенной Нью-Йоркской ассоциацией кардиологов, с выделением в нозологическую форму соединительнотканной дисплазии сердца, а также каталогом генов и генетических нарушений человека Mendelian Inheritance in Man (MIM), созданном и редактируемом McKusick V.A. et al., в который вошли такие состояния, как MASS syndrome (Mitral valve prolapse, Aortic root diameter at upper limits of normal for body size, Stretch marks of the skin, Skeletal conditions similar to Marfan syndrome, MIM 604308), Mitral valve prolapse, familial (MIM 157700), Mitral valve prolapse, myxomatous 2, 3 (MIM 607829,610840) и ряд других [2–6].
1.6. Клиническая картина
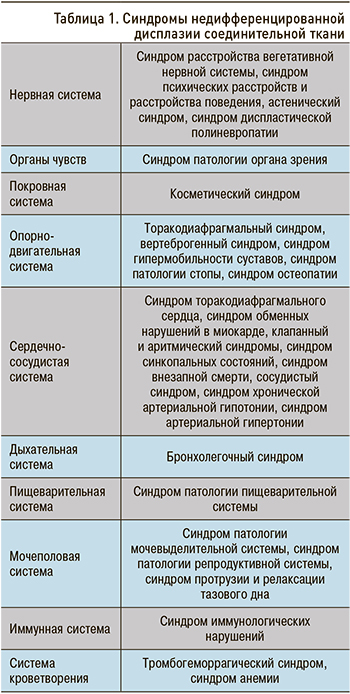
Клинические проявления НДСТ во многом связаны с ведущим клиническим синдромом, затрагивающим ту или иную систему организма (табл. 1). На сегодняшний день выделено 28 синдромов при НДСТ [3].
2. ДИАГНОСТИКА НЕДИФФЕРЕНЦИРОВАННЫХ ДИСПЛАЗИЙ СОЕДИНИТЕЛЬНОЙ ТКАНИ
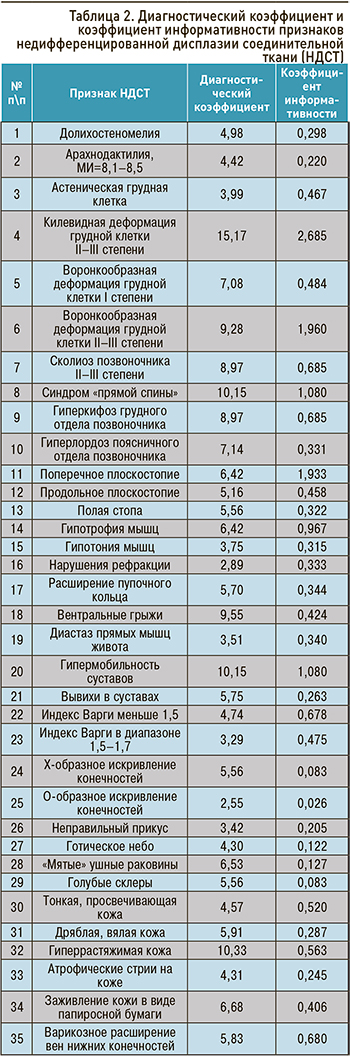
Профессором В.М. Яковлевым и его учениками для верификации диагноза было предложено трактовать клинические проявления пациентов как НДСТ при вовлечении в процесс не менее двух систем (опорно-двигательной, сердечно-сосудистой, бронхолегочной, пищеварительной, нервной, органа зрения и т.д.) с использованием процедуры последовательного распознавания Вальда: на основании диагностических коэффициентов и коэффициентов информативности для определения «диагностического вклада» каждого выявленного у пациента признака (табл. 2, 3) [2–4, 13].
Дисплазия соединительной ткани у детей и взрослых
Весь контент iLive проверяется медицинскими экспертами, чтобы обеспечить максимально возможную точность и соответствие фактам.
У нас есть строгие правила по выбору источников информации и мы ссылаемся только на авторитетные сайты, академические исследовательские институты и, по возможности, доказанные медицинские исследования. Обратите внимание, что цифры в скобках ([1], [2] и т. д.) являются интерактивными ссылками на такие исследования.
Если вы считаете, что какой-либо из наших материалов является неточным, устаревшим или иным образом сомнительным, выберите его и нажмите Ctrl + Enter.
О таком синдроме, как дисплазия соединительной ткани, говорят тогда, когда организм человека с рождения склонен к нарушениям формирования хрящевой ткани суставов, а также прочих тканей. Малыша, страдающего дисплазией, выявить относительно легко: он отличается необычной гибкостью, его суставы без проблем прогибаются в разные стороны.
У пациентов с дисплазией соединительной ткани уже в молодом возрасте развивается ранний остеохондроз, отмечаются нарушения зрения, пороки клапанов сердца. Соответственно, такие люди быстро обретают разные проблемы со здоровьем – в частности, с опорно-двигательным аппаратом.
Код по МКБ-10
Эпидемиология
О дисплазии соединительной ткани говорят в случаях, когда имеются признаки нарушенного соединительнотканного развития на эмбриональном и постнатальном этапе, и эти нарушения вызывают сбой гомеостаза. Расстройство происходит на уровне тканей, органов и всего организма в целом: отмечаются всевозможные морфофункциональные патологии.
Распространенность и частота заболеваний соединительной ткани, о которых сообщают, весьма различны, в зависимости от различий в методологии исследования. [1] Проблема недифференцированной дисплазии соединительной ткани (нДСТ) является актуальной по причине значительной частоты встречаемости данной патологии в популяции взрослого населения в целом, и в частности, среди женщин репродуктивного возраста (7-8%). [2] За помощью медиков пациенты с дисплазией обращаются в шесть раз чаще, нежели больные другими заболеваниями.
Заболеваемость не связана с половой и расовой принадлежностью пациентов.
Причины дисплазии соединительной ткани
Дисплазия соединительной ткани – это синдром, который включает в себя обширный ряд патологий. Причинами выступают расстройства, связанные с генетическими нарушениями построения коллагеновых соединительнотканных волокон. Процесс преимущественно захватывает костную ткань, связочный и сухожильный аппарат и кожные покровы.
Базовым механизмом соединительнотканных нарушений являются генные мутации. Особую роль играют изменения в генах, ответственных за продукцию основного белкового вещества, составляющего соединительную ткань – речь идет о коллагене (иногда – о фибриллине). Когда в ходе формирования белковых волокон происходят болезненные изменения, то они становятся менее прочными, неспособными выдержать нагрузку. Дополнительным фактором развития синдрома может стать недостача магния в организме.
Факторы риска
Учеными доказано, что развитию дисплазии соединительной ткани у ребенка способствуют такие факторы:
Патогенез
Гетерозиготные мутации в гене коллагена типа II (COL2A1) приводят к группе скелетных дисплазий, известных как коллагенопатия типа II (COL2pathy). [3], [4], [5] Цепи proα1 (I) и proα2 (I) коллагена 1 кодируются генами COL1A1 и COL1A2 соответственно; Количественные или качественные дефекты синтеза коллагена I типа обычно проявляются в виде коллагенопатии I типа и несовершенного остеогенеза. Большинство пациентов (около 90%) с клиническим диагнозом несовершенного остеогенеза имеют мутацию в генах COL1A1 или COL1A2 с аутосомно-доминантным типом наследования. Шесть других генов, CRTAP, LEPRE1, FKBP10, PP1B, SP7 / Osterix (OSX) и SERPINH1, связаны с аутосомно-рецессивными формами. [6], [7], [8]
Базовый механизм развития дисплазии соединительной ткани, равно как и недифференцированной формы заболевания, обусловлен генной мутацией, с вовлечением генов, отвечающих за выработку и диссимиляцию строительных белковых компонентов соединительной ткани, либо ферментных веществ, принимающих участие в указанных процессах. Изменяется количественное формирование качественных составляющих экстрацеллюлярного матрикса, расстраивается фибриллогенез. Генетические детерминанты осуществляются в зависимости от внешних факторов, или практически не зависят от них: это отмечается при дисплазии и недифференцированной дисплазии соответственно. Для соединительнотканной дисплазии присуща полигенность и мультифакторность (патология с генетической предрасположенностью): речь идет о мутации сразу многих генов, а случайное перераспределение отцовских и материнских аллелей постоянно влечет за собой образование следующего единственного в своем роде генотипа.
Факторы при рождении – например, витаминная или макро и микроэлементарная недостача – становятся базовыми причинами, создающими предпосылки для развития дисплазии соединительной ткани. Витамины B-группы стабилизируют обмен белков, аскорбиновая кислота с токоферолом потенцируют адекватную выработку коллагена, а также выступают в роли антиоксидантов. Микро и макроэлементы – медь, бор, цинк и кремний, фтор и кальций, марганец и магний, ванадий, фосфор и селен – выступают кофакторами ферментных веществ, стимулирующих выработку коллагена и насыщение костей минералами. Немаловажно и их участие в электролитном обмене и поддержании кислотно-щелочного равновесия. Калиевые, магниевые и цинк-ионы поддерживают костный рост и усиливают минеральную концентрацию ткани кости. В развитии заболевания любой из указанных факторов имеет первостепенное значение. [9]
Симптомы дисплазии соединительной ткани
Первые признаки дисплазии соединительной ткани проявляются ещё в раннем детском возрасте. Это может быть, как чрезмерная гибкость и гиперподвижность, так и ограниченная мобильность суставов по типу контрактур. Случаются также физические дефекты развития (карликовость), связочная слабость, хрупкие костные ткани, различные искривления позвоночника, плоскостопие, деформированная грудная клетка и пр.
Признаки дисплазии отмечаются и по отношению к другим органам: болезнь может поражать сердце, сосудистую сеть, глаза.
Часто страдает позвоночный столб: позвонки смещаются настолько, что при малейшем движении происходит сдавливание сосудов, ущемляются нервные окончания, возникают боли, нарушается сознание. [10]
Клиническая картина заболевания поражает своим разнообразием, и в этом заключается огромный «минус», поскольку идентифицировать патологию становится очень сложно. Поэтому врачи вынуждены прибегать сразу к нескольким методам лабораторной диагностики, а также к инструментальным видам исследования.
Фенотипические признаки при дисплазии соединительной ткани не всегда присутствуют с рождения и могут проявляться на протяжении всего жизненного периода. Со временем, через годы, чаще всего – под воздействием определенных неблагоприятных условий численность диспластических симптомов и их выраженность увеличивается и усиливается, поскольку первичные нарушения гомеостаза нарастают. В данном случае неблагоприятными условиями могут стать неправильное питание, плохая экология, регулярные интеркуррентные патологии, частые стрессы и пр. Первоочередно затрагивается постоянство присутствия микро и макроэлементов, которые непосредственно участвуют в процессах коллагеновой выработки, а также в регуляции ферментной активности, необходимой для быстрого и качественного синтеза.
В общем, указанные процессы преимущественно зависимы от равновесия содержания кальция и магния в организме. Например, недостача магния на фоне нормы или превышения уровня кальция приводит к повышению активности протеолитических ферментных веществ, которые вызывают коллагеновую деградацию. Как следствие – тяжелая клиническая картина дисплазии соединительной ткани.
Магний регулирует утилизацию кальция в организме. При дефиците магния кальций откладывается в костных и мягких тканях разных органов. При избытке магния кальций начинает плохо усваиваться и выводиться из организма.
Длительный недостаток магния может вызывать признаки ангиоспазма, повышения артериального давления, миокардиальной дистрофии, тахикардии, аритмии, повышенного тромбообразования. Возможны психоневрологические расстройства: невнимательность, депрессия, фобии или тревожные состояния, вегетативные нарушения, головные боли и головокружения, бессонница, онемения конечностей. Висцеральные признаки могут обнаруживаться в виде бронхо или ларингоспазмов, спастических запоров или гиперкинетических поносов, диспепсии, дискинезий желчного пузыря, болей в животе.
Хроническая магниевая недостача дополнительно проявляется пониженным тонусом мускулатуры, малой плотностью костной ткани.
Морфометрическая характеристика черепа при дисплазии соединительной ткани может изменяться из-за особенностей гемостаза. У больных зачастую диагностируются аортальные аневризмы, сопровождающиеся развитием хронического диссеминированного внутрисосудистого свертывания крови, как результата застоя в аневризменной полости и создания турбулентного тока в аорте. Возможно формирование ишемических поражений мозга, субарахноидальные, паренхиматозные кровоизлияния.
На сегодняшний день специалисты определили ряд фенотипических признаков дисплазии СТ. Их условно можно поделить на визуальные (те, которые можно заметить внешне) и на такие, которые обнаруживаются только по результатам тщательного внутреннего обследования.
У большинства пациентов наблюдается:
Более чем у 30% пациентов наблюдается так называемое «готическое небо», нарушения прикуса, гиперподвижность суставов, преждевременное старение лица, плоскостопие.
Боли при дисплазии соединительной ткани беспокоят в зависимости от того, какой орган поражен более других. Так, часто могут беспокоить периодические и недлительные боли в сердце, за грудиной и в области подреберья, спастические боли по ходу кишечника, головная боль. Неприятные болезненные ощущения в суставах появляются на этапе присоединения остеохондроза. Если имеются деформации грудной клетки или позвоночного столба, то боли в спине и груди возникают при продолжительном стоянии, ходьбе, либо даже в сидячем положении.
Страдают ли зубы при дисплазии соединительной ткани? Было проведено немало исследований, поскольку ученые пытались связать изменение качества зубной эмали с дисплазией соединительной ткани, что позволило бы более точно устанавливать диагноз заболевания. По итогам таких работ были обнаружены нарушения минерализации и формирования эмали зубов у пациентов с признаками соединительнотканной дисплазии. Это обусловлено недостаточной плотностью упаковки эмалевых призм на единицу объема. Кроме этого, призмы хаотично расположены, а органический матрикс слабо организован и минерализован. Склонность к неправильному развитию зубов и вероятность связанных с этим патологий определяется индивидуально, поскольку проявляется не у всех больных данным заболеванием.
Стадии
Течение соединительнотканной дисплазии подразделяют по следующим стадиям, или степеням, согласно 4-х балльной шкале:
Патологические признаки оценивают по 2-х балльной шкале:
Сильная дисплазия соединительной ткани определяется не только степенью выраженности тех или иных клинических симптомов, но и характером их сочетаний. Например, только лишь гиперподвижность, частые вывихи и подвывихи суставов не всегда выступают признаками значительно выраженной дисплазии. А вот сочетание искривления позвоночника с суставным хрустом, гиперподвижностью, асимметрией, с нарушениями психической сферы и выраженным косметическим синдромом позволяют поставить диагноз крайней степени заболевания.
Формы
Единого мнения специалистов по поводу классификации соединительнотканной дисплазии пока нет. Однако синдром было решено подразделять на несколько групп согласно патологическим процессам, в которые вовлечен белок коллаген. Наиболее достоверной на данный момент признана такая систематизация:
Дифференцированная дисплазия СТ может проявляться в виде синдрома Элерса-Данлоса, [12] Стиклера, [13] Марфана. [14]
Недифференцированная форма может сопровождаться клиническими признаками, не входящими в структурный ряд наследственных патологий. Наиболее часто встречаются такие варианты внесиндромной дисплазии, как марфаноидный, элерсовидный и MASS-фенотип. [15]
Симптомы генерализованной соединительнотканной дисплазии, астеническое сложение тела, арахнодактилия, клапанные сердечные патологии, расстройства зрительной функции, долихостеномелия.
Сочетание симптомов генерализованной соединительнотканной дисплазии со склонностью к чрезмерной растяжимости кожных покровов и повышенной суставной подвижностью.
Симптомы генерализованной соединительнотканной дисплазии, сердечные патологии, дефекты опорно-двигательной системы, истончение или субатрофия кожных покровов.
Несмотря на четкость классификации, специалисты указывают на отсутствие универсальных признаков, формирующих конкретную фенотипическую принадлежность. Каждый пациент обладает сугубо своими, уникальными дефектами. Поэтому зачастую врачи используют собственный вариант симптоматического обособления, связывая те или иные патологические изменения с дисплазией соединительной ткани.
Ливедо при дисплазии соединительной ткани – это ещё один признак, который обнаруживается при сосудистых поражениях. Он представляет собой сосудистый невроз спастического атонического типа, который проявляется нарушением кровотока в капиллярной сети. Для ливедо характерна синеватая окраска кожных покровов, что вызвано своеобразным рисунком просвечивающих сквозь кожу сосудов. Проблема чаще проявляется в области голеней и бедер, иногда – на запястьях. Может протекать в виде самостоятельной патологии, либо становится частью синдрома – в частности, при нейрогормональном расстройстве или дисплазии соединительной ткани.
Дисплазия соединительной ткани у взрослых
Взрослые пациенты могут обнаруживать у себя появление болезненных симптомов уже в молодом возрасте – примерно в 20-24 года. Поражение сопровождается такими признаками:
Дисплазия соединительной ткани у женщин
Женщины и мужчины в равной степени подвержены развитию данного заболевания, однако особую обеспокоенность пациентки выражают по поводу возможности забеременеть, выносить и родить здорового ребенка. Ученые изучали этот вопрос и наблюдали за всеми изменениями в женском организме на фоне недифференцированной формы дисплазии.
Согласно результативной оценке, было обнаружено достаточно много сопутствующих соматических патологий. Так, дисплазия соединительной ткани и беременность сопровождались увеличением частоты сердечно-сосудистых и нейроэндокринных патологий. Отмечалась также железодефицитная анемия.
У будущих мам чаще обострялись хронические экстрагенитарные проблемы, преимущественно патологии дыхательной системы и ЛОР-органов, а также болезни мочевыделительного тракта. При своевременной идентификации расстройств формирования соединительнотканных структур важно заранее принимать меры профилактики у беременных обострений хронических процессов, предупреждать развитие плацентарной недостаточности.
Дисплазия соединительной ткани у детей
Если диагноз дисплазии соединительной ткани устанавливается в детском возрасте, то обычно внимание привлекают такие симптоматические проявления:
Врожденная дисплазия соединительной ткани
Врожденный синдром может проявлять себя разными типами симптомокомплексов. Наиболее часто встречаются такие:
Осложнения и последствия
Неблагоприятные последствия заболевания могут проявляться в зависимости от степени поражения соединительной ткани. С годами у пациента развиваются следующие патологии:
Чем опасна дисплазия соединительной ткани? Наибольшую опасность представляет поражение сердечно-сосудистой и респираторной системы, поскольку оно часто сопровождается развитием состояний, представляющих угрозу жизни больного. К примеру, изменения со стороны сердца и сосудов зачастую определяют патогенез внезапного смертельного исхода: речь идет о клапанном, сосудистом, аритмическом синдромах.
Диагностика дисплазии соединительной ткани
Диагностические мероприятия для выявления дисплазии соединительной ткани не всегда одинаковы и требуют применения разных врачебных подходов. Обязательным моментом должны стать клинико-генетические исследования, поскольку патология является наследственно-обусловленной. В качестве дополнения доктор практикует такие принципы диагностики:
Также следует проводить диагностику по критериям Smolnova (2003) (Большие и маленькие диагностические критерии), которые включают: повышенную растяжимость кожи, гипермобильность суставов (растяжение связок, вывих и подвывих, плоскостопие), мышечную гипотонию, наследственная предрасположенность к заболеванию, оценка признаков гипермобильности суставов (критерии Бейтона). [17]
Лабораторные анализы включают в себя исследование мочевой жидкости: особенно важен уровень оксипролина и гликозаминогликанов – это компоненты, которые образуются входе коллагенового распада. Кроме этого, актуален анализ крови, исследование частых мутаций в гене PLOD, а также общий биохимический анализ (развернутая оценка состава венозной крови). Кроме этого, выполняют анализы на качество обмена веществ в соединительной ткани, определяют маркеры минерального и гормонального обмена.
Генетическая консультация при дисплазии соединительной ткани назначается с целью оценки риска развития тяжелой генетической патологии у ребенка, определение способов предотвращения заболевания. Консультация необходима, если кто-либо из супругов болен дисплазией, если имеются подозрительные результаты анализов или внешние болезненные проявления. В качестве консультантов обычно выступают:
При необходимости может быть рекомендован генетический анализ, который помогает оценить состояние определенных генов в молекуле ДНК и дает информацию о том, насколько человек предрасположен к тому или иному заболеванию – в частности, к развитию дисплазии соединительной ткани. Генетический анализ признан научной основой для подсчета генетической нагрузки.
Инструментальная диагностика заключается в проведении ультразвуковой эхографии, магнитно-резонансной и компьютерной томографии, электромиографии (оценка электрической активности мускулатуры), рентгенологического исследования.
Дифференциальная диагностика
Дифференциальная диагностика проводится со следующими патологиями:
Дисплазия соединительной ткани: основные клинические синдромы, формулировка диагноза, лечение
Дисплазия соединительной ткани (ДСТ) (dis — нарушения, рlasia — развитие, образование) — нарушение развития соединительной ткани в эмбриональном и постнатальном периодах, генетически детерминированное состояние, характеризующееся дефектами волокнистых стр
Дисплазия соединительной ткани (ДСТ) (dis — нарушения, рlasia — развитие, образование) — нарушение развития соединительной ткани в эмбриональном и постнатальном периодах, генетически детерминированное состояние, характеризующееся дефектами волокнистых структур и основного вещества соединительной ткани, приводящее к расстройству гомеостаза на тканевом, органном и организменном уровнях в виде различных морфофункциональных нарушений висцеральных и локомоторных органов с прогредиентным течением, определяющее особенности ассоциированной патологии, а также фармакокинетики и фармакодинамики лекарств [15, 24].
Данные о распространенности собственно ДСТ разноречивы [5, 14, 17], что обусловлено различными классификационными и диагностическими подходами. Распространенность отдельных признаков ДСТ имеет половозрастные различия [3]. По самым скромным данным показатели распространенности ДСТ, по меньшей мере, соотносятся с распространенностью основных социально значимых неинфекционных заболеваний.
ДСТ морфологически характеризуется изменениями коллагеновых, эластических фибрилл, гликопротеидов, протеогликанов и фибробластов, в основе которых лежат наследуемые мутации генов, кодирующих синтез и пространственную организацию коллагена, структурных белков и белково-углеводных комплексов, а также мутации генов ферментов и кофакторов к ним [1, 12, 23]. Некоторые исследователи, основываясь на выявляемом в 46,6–72,0% наблюдений при ДСТ дефиците магния в различных субстратах (волосы, эритроциты, ротовая жидкость), допускают патогенетическое значение гипомагниемии.
Одна из основополагающих характеристик дисплазии соединительной ткани как дисморфогенетического феномена — фенотипические признаки ДСТ могут отсутствовать при рождении или иметь очень незначительную выраженность (даже в случаях дифференцированных форм ДСТ) и, подобно изображению на фотобумаге, проявляться в течение жизни. С годами количество признаков ДСТ и их выраженность нарастает прогредиентно.
Классификация ДСТ — один из самых дискутабельных научных вопросов. Отсутствие единой, общепринятой классификации ДСТ отражает разногласие мнений исследователей по данной проблеме в целом. ДСТ может классифицироваться с учетом генетического дефекта в периоде синтеза, созревания или распада коллагена [1, 12]. Это перспективный классификационный подход, который дает возможность обосновать генетически дифференцированную диагностику ДСТ [23], однако на сегодняшний день данный подход ограничен наследственными синдромами ДСТ.
Т. И.Кадурина (2000 г.) выделяет MASS-фенотип, марфаноидный и элерсоподобный фенотипы, отмечая, что именно эти три фенотипа являются наиболее частыми формами несиндромной ДСТ. Это предложение является очень заманчивым, благодаря своей простоте и исходной идее, что несиндромные формы ДСТ являются «фенотипическими» копиями известных синдромов. Так, «марфаноидный фенотип» характеризуется сочетанием «признаков генерализованной дисплазии соединительной ткани с астеническим телосложением, долихостеномелией, арахнодактилией, поражением клапанного аппарата сердца (а порой и аорты), нарушением зрения». При «элерсоподобном фенотипе» отмечается «сочетание признаков генерализованной дисплазии соединительной ткани с тенденцией к гиперрастяжимости кожи и разной степенью выраженности гипермобильности суставов». «MASS-подобному фенотипу» присущи «признаки генерализованной дисплазии соединительной ткани, ряд нарушений со стороны сердца, скелетные аномалии, а также кожные изменения в виде истончения или наличия участков субатрофии». На основе этой классификации предлагается формулировать диагноз ДСТ [12].
Учитывая, что классификация любой патологии несет важный «прикладной» смысл — используется как основа для формулировки диагноза, решение классификационных вопросов являются очень важным с точки зрения клинической практики.
Универсальных патологических повреждений соединительной ткани, которые бы формировали конкретный фенотип, не существует. Каждый дефект у каждого больного в своем роде уникален. При этом всеобъемлющее распространение в организме соединительной ткани определяет полиорганность поражений при ДСТ. В связи с этим предлагается классификационный подход с обособлением синдромов, связанных с диспластикозависимыми изменениями и патологическими состояниями [15, 24].
Синдром неврологических нарушений: синдром вегетативной дисфункции (вегетососудистая дистония, панические атаки и др.), гемикрания.
Синдром вегетативной дисфункции формируется у значительного числа пациентов с ДСТ одним из самых первых — уже в раннем детском возрасте и рассматривается как обязательный компонент диспластического фенотипа [11, 12, 14, 15, 17]. У большинства пациентов выявляется симпатикотония, реже встречается смешанная форма, в малом проценте случаев — ваготония [9, 23]. Выраженность клинических проявлений синдрома нарастает параллельно тяжести ДСТ [11, 23]. Вегетативная дисфункция отмечается в 97% случаев наследственных синдромов, при недифференцированной форме ДСТ — у 78% пациентов. В формировании вегетативных нарушений у пациентов с ДСТ, несомненно, имеют значение генетические факторы, лежащие в основе нарушения биохимизма обменных процессов в соединительной ткани и формировании морфологических субстратов, приводящих к изменению функции гипоталамуса, гипофиза, половых желез, симпатико-адреналовой системы.
Астенический синдром: снижение работоспособности, ухудшение переносимости физических и психоэмоциональных нагрузок, повышенная утомляемость.
Астенический синдром выявляется в дошкольном и особенно ярко — в школьном, подростковом и молодом возрасте, сопровождая пациентов с ДСТ на протяжении всей жизни. Отмечается зависимость выраженности клинических проявлений астении от возраста больных: чем старше пациенты, тем больше субъективных жалоб.
Клапанный синдром: изолированные и комбинированные пролапсы клапанов сердца, миксоматозная дегенерация клапанов.
Чаще он представлен пролапсом митрального клапана (ПМК) (до 70%), реже — пролапсами трикуспидального или аортального клапанов, расширением корня аорты и легочного ствола; аневризмами синусов Вальсальвы. В части случаев выявленные изменения сопровождаются явлениями регургитации, что отражается на показателях контрактильности миокарда и объемных параметрах сердца. Durlach J. (1994) предположил, что причиной ПМК при ДСТ может быть дефицит магния.
Клапанный синдром начинает формироваться также в детском возрасте (4–5 лет). Аускультативные признаки ПМК выявляются в различном возрасте: от 4 до 34 лет, однако наиболее часто — в возрасте 12–14 лет. Следует отметить, что эхокардиографические данные находятся в динамическом состоянии: более выраженные изменения отмечаются при последующих осмотрах, что отражает влияние возраста на состояние клапанного аппарата. Кроме того, на выраженность клапанных изменений влияет степень тяжести ДСТ и объем желудочков.
Торакодиафрагмальный синдром: астеническая форма грудной клетки, деформации грудной клетки (воронкообразная, килевидная), деформации позвоночника (сколиозы, кифосколиозы, гиперкифозы, гиперлордозы и др.), изменения стояния и экскурсии диафрагмы.
Среди пациентов с ДСТ наиболее часто встречается воронкообразная деформация грудной клетки, на втором месте по частоте — килевидная деформация и наиболее редко выявляется астеническая форма грудной клетки.
Начало формирование торакодиафрагмального синдрома приходится на ранний школьный возраст, отчетливость проявлений — на возраст 10–12 лет, максимальная выраженность — на период 14–15 лет. Во всех случаях воронкообразная деформация отмечается врачами и родителями на 2–3 года раньше, чем килевидная.
Наличие торакодиафрагмального синдрома определяет уменьшение дыхательной поверхности легких, деформацию просвета трахеи и бронхов; смещение и ротацию сердца, «перекрут» основных сосудистых стволов. Качественные (вариант деформации) и количественные (степень деформации) характеристики торакодиафрагмального синдрома определяют характер и выраженность изменений морфофункциональных параметров сердца и легких. Деформации грудины, ребер, позвоночника и связанное с ними высокое стояние диафрагмы приводят к уменьшению грудной полости, повышению внутригрудного давления, нарушают приток и отток крови, способствуют возникновению аритмий сердца [13, 15]. Наличие торакодиафрагмального синдрома может повлечь за собой повышение давления в системе малого круга кровообращения [23, 27].
Сосудистый синдром: поражение артерий эластического типа: идиопатическое расширение стенки с формированием мешотчатой аневризмы; поражение артерий мышечного и смешанного типов: бифуркационно-гемодинамические аневризмы, долихоэктазии удлиненных и локальных расширений артерий, патологическая извитость вплоть до петлеобразования; поражение вен (патологическая извитость, варикозное расширение вен верхних и нижних конечностей, геморроидальных и др. вен); телеангиоэктазии; эндотелиальная дисфункция.
Изменения сосудов сопровождаются повышением тонуса в системе крупных, мелких артерий и артериол, уменьшением объема и скорости наполнения артериального русла, снижением венозного тонуса и избыточным депонированием крови в периферических венах.
Сосудистый синдром, как правило, манифестирует в подростковом и молодом возрасте, прогрессируя с увеличением возраста пациентов.
Изменения артериального давления: идиопатическая артериальная гипотензия.
Торакодиафрагмальное сердце: астенический, констриктивный, ложностенотический, псевдодилатационный варианты, торакодиафрагмальное легочное сердце.
Формирование торакодиафрагмального сердца происходит параллельно манифестации и прогрессированию деформации грудной клетки и позвоночника, на фоне клапанного и сосудистого синдромов. Варианты торакодиафрагмального сердца служат отражением нарушения гармоничности взаимоотношений веса и объема сердца, веса и объема всего тела, объема сердца и объема больших артериальных стволов на фоне диспластикозависимой дезорганизации роста тканевых структур самого миокарда, в частности, его мышечных и нервных элементов.
У пациентов с типичной астенической конституцией формируется астенический вариант торакодиафрагмального сердца, характеризующийся уменьшением размеров камер сердца при «нормальной» систолической и диастолической толщине стенок и межжелудочковой перегородки, «нормальных» показателях миокардиальной массы, — формирование истинного малого сердца. Сократительный процесс в данной ситуации сопровождается увеличением циркулярного стресса и внутримиокардиального напряжения в циркулярном направлении в систолу, что свидетельствовало о гиперреактивности компенсаторных механизмов на фоне преобладавших симпатических влияний. Установлено, что определяющими факторами в изменении морфометрических, объемных, контрактильных и фазовых параметров сердца являются форма грудной клетки и уровень физического развития костно-мышечного аппарата [15].
У части больных с выраженной формой ДСТ и различными вариантами деформации грудной клетки (воронкообразная деформация I, II степени) в условиях уменьшения объема грудной полости наблюдается «перикардитоподобная» ситуация с развитием диспластикозависимого констриктивного сердца. Уменьшение максимальных размеров сердца с изменением геометрии полостей при этом носит гемодинамически неблагоприятный характер, сопровождаясь уменьшением толщины стенок миокарда в систолу. При уменьшении ударного объема сердца происходит компенсаторное повышение общего периферического сопротивления.
У ряда пациентов с деформацией грудной клетки (воронкообразная деформация III степени, килевидная деформация) при смещении сердца, когда оно «уходит» от механических воздействий костяка грудной клетки, ротируя и сопровождаясь «перекрутом» основных сосудистых стволов, формируется ложностенотический вариант торакодиафрагмального сердца. «Синдром стеноза» выхода из желудочков сопровождается увеличением напряжения миокардиальных структур в меридиональном и циркулярном направлениях, ростом систолического напряжения миокардиальной стенки с увеличением длительности подготовительного периода к изгнанию, увеличением давления в легочной артерии.
У пациентов с килевидной деформацией грудной клетки II и III степени выявляется увеличение устьев аорты и легочной артерии, связанное со снижением упругости сосудов и зависящее от степени тяжести деформации. Изменения геометрии сердца характеризуются компенсаторным увеличением размеров левого желудочка в диастолу либо в систолу, в результате чего полость приобретает шаровидную форму. Сходные процессы наблюдаются со стороны правых отделов сердца и устья легочной артерии. Формируется псевдодилятационный вариант торакодиафрагмального сердца.
В группе пациентов с дифференцированной ДСТ (синдромами Марфана, Элерса–Данлоса, Стиклера, несовершенного остеогенеза), а также у пациентов с недифференцированной ДСТ, имеющих сочетание выраженных деформаций грудной клетки и позвоночника, морфометрические изменения правого и левого желудочков сердца совпадают: уменьшается длинная ось и площади полостей желудочков, особенно в конце диастолы, отражая снижение сократительной способности миокарда; снижаются конечно- и среднедиастолические объемы. Наблюдается компенсаторное снижение общего периферического сосудистого сопротивления, зависящее от степени снижения сократимости миокарда, выраженности деформаций грудной клетки и позвоночника. Неуклонный рост легочного сосудистого сопротивления приводит в данном случае к формированию торакодиафрагмального легочного сердца.
Метаболическая кардиомиопатия: кардиалгии, аритмии сердца, нарушения процессов реполяризации (I степень: увеличение амплитуды Т V2-V3, синдром Т V2 > Т V3; II степень: инверсия Т, смещение ST V2-V3 вниз на 0,5–1,0 мм; III степень: инверсия Т, косовосходящее смещение ST до 2,0 мм).
Развитие метаболической кардиомиопатии определяется влиянием кардиальных факторов (клапанный синдром, варианты торакодиафрагмального сердца) и экстракардиальных условий (торакодиафрагмальный синдром, синдром вегетативной дисфункции, сосудистый синдром, дефицит микро- и макроэлементов). Кардиомиопатия при ДСТ не имеет специфических субъективных симптомов и клинических проявлений, вместе с тем потенциально определяет повышенный риск внезапной смерти в молодом возрасте с преобладающей ролью в танатогенезе аритмического синдрома.
Аритмический синдром: желудочковая экстрасистолия различных градаций; многофокусная, мономорфная, реже полиморфная, монофокусная предсердная экстрасистолия; пароксизмальные тахиаритмии; миграция водителя ритма; атриовентрикулярные и внутрижелудочковые блокады; аномалии проведения импульса по дополнительным путям; синдром предвозбуждения желудочков; синдром удлинения интервала Q-T.
Частота выявления аритмического синдрома — около 64%. Источником нарушения ритма сердца может быть очаг нарушенного метаболизма в миокарде. При нарушении структуры и функции соединительной ткани всегда присутствует подобный субстрат биохимического генеза. Причиной нарушений сердечного ритма при ДСТ может служить клапанный синдром. Возникновение аритмий при этом может быть обусловлено сильным натяжением митральных створок, содержащих мышечные волокна, способные к диастолической деполяризации с формированием биоэлектрической нестабильности миокарда [29]. Кроме того, появлению аритмий может способствовать резкий сброс крови в левый желудочек с пролонгированной диастолической деполяризацией. Изменения геометрии камер сердца также могут иметь значение в возникновении аритмий при формировании диспластического сердца, особенно торакодиафрагмального варианта легочного сердца. Кроме кардиальных причин происхождения аритмий при ДСТ существуют и экстракардиальные, обусловленные нарушением функционального состояния симпатического и блуждающего нервов, механического раздражения сердечной сорочки деформированным костяком грудной клетки. Одним из аритмогенных факторов может быть дефицит магния, выявляемый у пациентов с ДСТ. В предшествующих исследованиях российских и зарубежных авторов получены убедительные данные о причинной взаимосвязи между желудочковыми и предсердными аритмиями и внутриклеточным содержанием магния [19, 22, 25, 26]. Предполагают, что гипомагниемия может способствовать развитию гипокалиемии. При этом увеличивается мембранный потенциал покоя, нарушаются процессы деполяризации и реполяризации, снижается возбудимость клетки. Замедляется проводимость электрического импульса, что способствует развитию аритмий. С другой стороны, внутриклеточный дефицит магния повышает активность синусового узла, снижает абсолютную и удлиняет относительную рефрактерность [19, 22, 26].
Бронхолегочный синдром: трахеобронхиальная дискинезия, трахеобронхомаляция, трахеобронхомегалия, вентиляционные нарушения (обструктивные, рестриктивные, смешанные нарушения), спонтанный пневмоторакс.
Бронхолегочные нарушения при ДСТ современные авторы описывают как генетически обусловленные нарушения архитектоники легочной ткани в виде деструкции межальвеолярных перегородок и недоразвития эластических и мышечных волокон в мелких бронхах и бронхиолах, ведущие к повышенной растяжимости и сниженной эластичности легочной ткани [12, 15, 23]. Следует отметить, что согласно классификации болезней органов дыхания у детей, принятой на Совещании педиатров-пульмонологов РФ (Москва, 1995), такие «частные» случаи ДСТ органов дыхания, как трахеобронхомегалия, трахеобронхомаляция, бронхоэктатическая эмфизема, а также синдром Вильямса–Кемпбелла, на сегодняшний день трактуются как пороки развития трахеи, бронхов, легких [18].
Изменение функциональных параметров дыхательной системы при ДСТ зависит от наличия и степени деформации грудной клетки, позвоночника и чаще характеризуется рестриктивным типом вентиляционных нарушений со снижением общей емкости легких (ОЕЛ) [18, 23]. Остаточный объем легких (ООЛ) у многих пациентов с ДСТ не меняется или слегка повышается без изменения соотношения объема форсированного выдоха в первую секунду (ОФВ1) и форсированной жизненной емкости легких (ФЖЕЛ) [23]. У некоторых пациентов выявляются обструктивные нарушения, феномен гиперреактивности бронхов, что пока не нашло однозначного объяснения [2, 10, 23]. Пациенты с ДСТ представляют собой группу с высоким риском возникновения ассоциированной патологии, в частности, туберкулеза легких [32].
Синдром иммунологических нарушений: синдром иммунодефицита, аутоиммунный синдром, аллергический синдром.
Функциональное состояние иммунной системы при ДСТ характеризуется как активацией иммунных механизмов, обеспечивающих поддержание гомеостаза, так и их недостаточностью, ведущей к нарушению способности адекватно освобождать организм от чужеродных частиц и, следовательно, к развитию рецидивирующих инфекционно-воспалительных заболеваний бронхолегочной системы. Иммунологические нарушения у части пациентов с ДСТ включают повышение в крови уровня иммуноглобулина Е [4]. В целом, литературные данные о нарушениях в иммунной системе при различных клинических вариантах ДСТ носят неоднозначный, нередко противоречивый характер, что требует дальнейшего их изучения. До сих пор остаются практически неизученными механизмы формирования иммунных нарушений при ДСТ. Наличие иммунных нарушений, сопутствующее бронхолегочному и висцеральному синдромам ДСТ, повышает риск возникновения ассоциированной патологии соответствующих органов и систем.
Висцеральный синдром: нефроптоз и дистопии почек, птозы органов желудочно-кишечного тракта, органов малого таза, дискинезии органов желудочно-кишечного тракта, дуоденогастральные и гастроэзофагеальные рефлюксы, несостоятельность сфинктеров, дивертикулы пищевода, грыжи пищеводного отверстия диафрагмы; птозы половых органов у женщин.
Синдром патологии органа зрения: миопия, астигматизм, гиперметропия, косоглазие, нистагм, отслойка сетчатки, вывих и подвывих хрусталика.
Нарушения аккомодации проявляется в различные периоды жизни, у большинства обследованных — в школьные годы (8–15 лет) и прогрессирует до 20–25 лет.
Геморрагические гематомезенхимальные дисплазии: гемоглобинопатии, синдром Рандю–Ослера–Вебера, рецидивирующие геморрагические (наследственная дисфункция тромбоцитов, синдром Виллебранда, комбинированные варианты) и тромботические (гиперагрегация тромбоцитов, первичный антифосфолипидный синдром, гипергомоцистеинемия, резистентность фактора Vа к активированному протеину С) синдромы [20].
Синдром патологии стопы: косолапость, плоскостопие (продольное, поперечное), полая стопа.
Синдром патологии стопы является одним из самым ранних проявлений несостоятельности соединительнотканных структур. Наиболее часто встречается поперечно-распластанная стопа (поперечное плоскостопие), в части случаев сочетающаяся с отклонением 1 пальца наружу (hallus valgus) и продольное плоскостопие с пронацией стопы (плосковальгусная стопа). Наличие синдрома патологии стопы еще больше уменьшает возможность физического развития пациентов с ДСТ, формирует определенный стереотип жизни, усугубляет психосоциальные проблемы.
Синдром гипермобильности суставов: нестабильность суставов, вывихи и подвывихи суставов.
Синдром гипермобильности суставов в большинстве случаев определяется уже в раннем детском возрасте. Максимальная гипермобильность суставов наблюдается в возрасте 13–14 лет, к 25–30 годам распространенность снижается в 3–5 раз. Частота встречаемости гипермобильности суставов достоверно выше среди пациентов с выраженной ДСТ.
Вертеброгенный синдром: ювенильный остеохондроз позвоночника, нестабильность, межпозвонковые грыжи, вертебробазиллярная недостаточность; спондилолистез.
Развиваясь параллельно развитию торакодиафрагмального синдрома и синдрома гипермобильности, вертеброгенный синдром существенно усугубляет их последствия.
Косметический синдром: диспластикозависимые дисморфии челюстно-лицевой области (аномалии прикуса, готическое небо, выраженные асимметрии лица); О- и Х-образные деформации конечностей; изменения кожных покровов (тонкая просвечивающаяся и легко ранимая кожа, повышенная растяжимость кожи, шов в виде «папиросной бумаги»).
Косметический синдром ДСТ значительно усугубляется наличием малых аномалий развития, выявляемых у абсолютного большинства пациентов с ДСТ. При этом подавляющее большинство пациентов имеет 1–5 микроаномалий (гипертелоризм, гипотелоризм, «мятые» ушные раковины, большие торчащие уши, низкий рост волос на лбу и шее, кривошея, диастема, неправильный рост зубов и др.).
Нарушения психической сферы: невротические расстройства, депрессии, тревожность, ипохондрия, обсессивно-фобические расстройства, нервная анорексия.
Известно, что пациенты с ДСТ формируют группу повышенного психологического риска, характеризующуюся сниженной субъективной оценкой собственных возможностей, уровнем претензий, эмоциональной устойчивости и работоспособности, повышенным уровнем тревожности, ранимостью, депрессивностью, конформизмом [3, 9]. Наличие диспластикозависимых косметических изменений в сочетании с астенией формируют психологические особенности этих больных: сниженное настроение, потеря ощущения удовольствия и интереса к деятельности, эмоциональная лабильность, пессимистическая оценка будущего, нередко с идеями самобичевания и суицидальными мыслями [23]. Закономерным следствием психологического дистресса является ограничение социальной активности, ухудшение качества жизни и значительное снижение социальной адаптации [12, 3, 23], наиболее актуальные в подростковом и молодом возрасте.
Поскольку фенотипические проявления ДСТ чрезвычайно многообразны и практически не поддаются какой-либо унификации, а их клиническое и прогностическое значение определяется не только степенью выраженности того или иного клинического признака, но и характером «комбинаций» диспластикозависимых изменений, с нашей точки зрения, наиболее оптимально использовать термины «недифференцированная дисплазия соединительной ткани», определяющий вариант ДСТ с клиническими проявлениями, не укладывающимися в структуру наследственных синдромов, и «дифференцированная дисплазия соединительной ткани, или синдромная форма ДСТ». Практически все клинические проявления ДСТ имеют свое место в Международном классификаторе болезней (МКБ 10). Таким образом, у практического врача есть возможность определить шифр ведущего на момент обращения проявления (синдрома) ДСТ.При этом в случае недифференцированной формы ДСТ при формулировке диагноза следует указывать все имеющиеся у пациента синдромы ДСТ, формируя таким образом «портрет» пациента, понятный любому врачу последующего контакта.
Варианты формулировки диагноза.
1. Основное заболевание. Синдром Вольфа–Паркинсона–Вайта (синдром WPW) (I 45.6), ассоциированный с ДСТ. Пароксизмальная мерцательная аритмия.
Фоновое заболевание. ДСТ:
Осложнения: хроническая сердечная недостаточность (ХСН) IIА, ФК II.
2. Основное заболевание. Пролапс митрального клапана II степени с регургитацией (I 34.1), ассоциированный с малой аномалией развития сердца — аномально расположенной хордой левого желудочка.
Фоновое заболевание. ДСТ:
Осложнения основного: ХСН, ФК II, дыхательная недостаточность (ДН 0).
3. Основное заболевание. Хронический гнойно-обструктивный бронхит (J 44.0), ассоциированный с диспластикозависимой трахеобронхомаляцией, обострение.
Фоновое заболевание. ДСТ:
Осложнения: эмфизема легких, пневмосклероз, адгезивный двухсторонний плеврит, ДН II ст., ХСН IIА, ФК IV.
Вопросы тактики ведения пациентов с ДСТ также являются открытыми. Единых общепризнанных подходов к лечению пациентов с ДСТ на сегодняшний день не существует. Учитывая, что в настоящее время медицине недоступна генная терапия, врачу необходимо использовать любые способы, которые помогут остановить прогредиентность течения заболевания. Наиболее приемлем синдромальный подход к выбору терапевтических вмешательств: коррекция синдрома вегетативных нарушений, аритмического, сосудистого, астенического и др. синдромов.
Ведущим компонентом терапии должны быть немедикаментозные воздействия, направленные на улучшения гемодинамики (лечебная физкультура, дозированные нагрузки, аэробный режим). Однако нередко существенным фактором, ограничивающим достижения целевого уровня физических нагрузок у пациентов с ДСТ, оказывается плохая субъективная переносимость тренировок (обилие астенических, вегетативных жалоб, эпизоды гипотонии), что снижает приверженность пациентов к этому виду реабилитационных мероприятий. Так, по нашим наблюдениям до 63% пациентов имеют низкую толерантность к физической нагрузке по данным велоэргометрии, большинство из этих пациентов отказываются от продолжения курса лечебной физкультуры (ЛФК). В связи с этим представляется перспективным применение в комплексе с ЛФК вегетотропных средств, препаратов метаболического действия. Целесообразным является назначение препаратов магния. Многогранность метаболических эффектов магния, его способность повышать энергетический потенциал миокардиоцитов, участие магния в регуляции гликолиза, синтезе белков, жирных кислот и липидов, вазодилятационные свойства магния широко отражены в многочисленных экспериментальных и клинических исследованиях [6, 7, 22, 26, 30, 31]. В ряде работ, проведенных к настоящему времени, показана принципиальная возможность устранения характерной кардиальной симптоматики и ультразвуковых изменений у больных с ДСТ в результате лечения препаратами магния [7, 22, 25, 26].
Нами проводилось изучение эффективности поэтапного лечения пациентов, имеющих признаки ДСТ: на первом этапе больным проводилась терапия препаратом «Магнерот», на втором к медикаментозному лечению добавляли комплекс лечебной физкультуры. В исследование были включены 120 пациентов с недифференцированной формой ДСТ, имеющих низкую толерантность к физической нагрузке (по данным велоэргометрии) в возрасте от 18 до 42 лет (средний возраст 30,30 ± 2,12 года), мужчин — 66, женщин — 54. Торакодиафрагмальный синдром проявлялся воронкообразной деформацией грудной клетки различной степени (46 человек), килевидной деформацией грудной клетки (49 пациентов), астенической формой грудной клетки (7 пациентов), комбинированными изменениями позвоночного столба (85,8%). Клапанный синдром был представлен: пролапсом митрального клапана (I степени — 80,0%; II степени — 20,0%) с регургитацией (91,7%) или без таковой. У 8 человек было выявлено расширение корня аорты. В качестве группы контроля были обследованы 30 практически здоровых добровольцев, соответствующих по полу и возрасту.
По данным ЭКГ у всех пациентов с ДСТ выявлялись изменения конечной части желудочкового комплекса: I степень нарушения процессов реполяризации выявлялась у 59 пациентов; II степень — у 48 пациентов, III степень определялась реже — в 10,8 % случаев (13 человек). Анализ вариабельности сердечного ритма пациентов с ДСТ по сравнению с группой контроля продемонстрировал статистически значимо более высокие значения среднесуточных показателей — SDNN, SDNNi, RMSSD. При сопоставлении показателей вариабельности сердечного ритма с тяжестью вегетативной дисфункции у пациентов с ДСТ была выявлена обратная зависимость — чем выраженнее вегетативная дисфункция, тем ниже показатели вариабельности сердечного ритма.
На первом этапе комплексной терапии назначался Магнерот по следующей схеме: 2 таблетки 3 раза в день первые 7 дней, затем по 1 таблетке 3 раза в день в течение 4 недель.
В результате проведенного лечения была отмечена отчетливая положительная динамика частоты кардиальных, астенических и разнообразных вегетативных жалоб, предъявляемых пациентами. Позитивная динамика ЭКГ-изменений проявилась в снижении частоты встречаемости нарушений процессов реполяризации I степени (р
Г. И. Нечаева, доктор медицинских наук, профессор
В. М. Яковлев, доктор медицинских наук, профессор
В. П. Конев, доктор медицинских наук, профессор
И. В. Друк, кандидат медицинских наук
С. Л. Морозов
ОмГМА Росздрава, Омск
СГМА Росздрава, Ставрополь