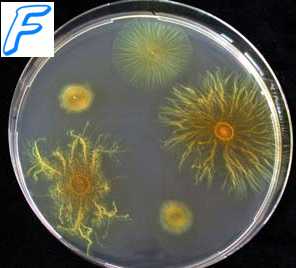
колонии бактерий какие бывают
Колонии бактерий какие бывают
При достаточном содержании патогенных бактерий в образце проводят посев на плотные питательные среды (для получения изолированных колоний). Если в исследуемом материале бактерий мало, то посев проводят на жидкие среды обогащения. На практике выделение относительно неприхотливых бактерий обычно проводят на простых средах (например, на КА, агаре Плоскирева, тиогликолевом бульоне, агаре Сабуро и т.д.).
Для выделения прихотливых видов бактерий в среды вносят питательные вещества (кровь, сыворотку, дрожжевой экстракт и др.), а также поглотители токсических метаболитов, образующихся при росте бактерий (например, древесный уголь). Для посевов применяют микробиологические петли, реже иглы и шпатели.
Получение изолированных колоний бактерий
Для получения изолированных колоний бактерий на практике наиболее часто используют модификацию рассева по Дригальски. Для этого материал наносят на поверхность плотной питательной среды ближе к краю и делают «бляшку». Затем из неё материал распределяют по четырём квадратам, проводя петлёй штрихи, как показано на рис. 11-12, обжигая петлю после засева каждого квадрата. Подобный метод позволяет получить изолированные колонии и изучать их.
Исключение составляет техника посева при бактериологическом исследовании мочи (техника штрихового засева показана на рис. 11-13). Указанные методы пригодны для посева аэробных и факультативно анаэробных бактерий, а также нестрогих анаэробов.
Температура культивирования бактерий
Патогенные бактерии вариабельны в отношении температур, оптимальных для их роста, но большинство из них неплохо развивается при 35-37 °С. Исключение составляют некоторые атипичные микобактерии, возбудитель чумы, листерии и лептоспиры (температурный оптимум 20-30 °С), а также Campylobacter jejuni (температурный оптимум 42 °С).
КОЛОНИЯ БАКТЕРИАЛЬНАЯ
Рис. 1. Морфологическое и структурное разнообразие колоний.
Рис. 1. Морфологическое и структурное разнообразие колоний:
1 формы выпуклости колоний над поверхностью питательной среды;
2 очертания колоний;
3 характер края колоний;
4 внутренняя структура колоний.
коло́ния бактериа́льная, изолированное скопление клеток бактерий одного вида, формирующееся на поверхности или внутри плотных и полужидких питательных сред в результате размножения одной или нескольких бактериальных клеток. Внешний вид и строение колоний большинства видов бактерий имеют свои особенности и могут служить ориентировочным признаком для их идентификации. Описывая колонии различных бактерий, учитывают ряд общих критериев (рис. 1, 2). Макроскопически определяют величину К. б. (крупные 46 мм, средние 24 мм, точечные менее 1 мм), форму (правильная круглая, эллипсоидная, розеткообразная, ризоидная и т. д.), цвет (бесцветные, окрашенные), прозрачность (прозрачные, непрозрачные), рельеф (плоский, плосковыпуклый, выпуклый, куполообразный, с приподнятой серединой или вдавлением в центре), характер поверхности (гладкая, морщинистая, блестящая, матовая, влажная, сухая, слизистая и т. д.), консистенцию (плотная, мягкая, слизистая, хрупкая, мучнистая и т. д.). Микроскопически (при помощи лупы или микроскопа с малым увеличением) исследуют структуру К. б.; последняя может быть гомогенной (однородной), зернистой, аморфной, неоднородной (различной в центре и по периферии колонии); характер поверхности различный (гладкая, шероховатая), края колонии ровные, волнистые, бахромчатые, локонообразные, фистончатые и т. д. В отдельных случаях прибегают к изучению расположения клеток внутри К. б. путём микроскопии мазков-отпечатков или микротомных срезов фиксированных колоний. Первичнооднородная популяция бактерий в последующем может образовывать на плотных питательных средах различные по форме К. б. (см. Диссоциация бактерий).
Литература:
Практические занятия по ветеринарной микробиологии, 2 изд., М.Л., 1959.
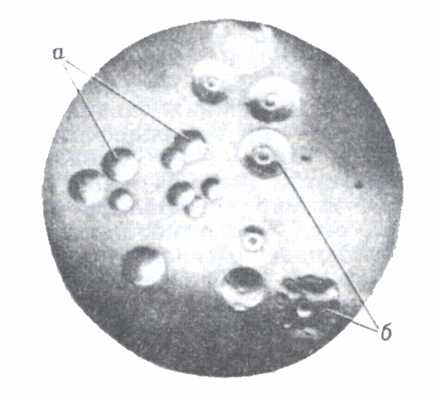
Рис. 2. Поверхность колоний.
Рис. 2. Поверхность колоний:
а гладкая;
б бугристая.
Полезное
Смотреть что такое «КОЛОНИЯ БАКТЕРИАЛЬНАЯ» в других словарях:
КОЛОНИЯ БАКТЕРИАЛЬНАЯ — скопление микроорганизмов в процессе их роста, размножения на поверхности пищевых продуктов, почвы, при посеве в лабораторных условиях на различных питательных средах. Экологический энциклопедический словарь. Кишинев: Главная редакция Молдавской… … Экологический словарь
колония бактериальная — видимое невооруженным глазом образование на плотной питательной среде, имеющее характерные размеры, форму, структуру, цвет и т. д., представляющее собой популяцию бактерий, происшедшую из одной бактериальной клетки … Большой медицинский словарь
БАКТЕРИИ — (от греч, bakterion палочка), большая группа в осн. одноклеточных микроорганизмов, составляющих царство прокариот (Procaryotae). Для Б. характерно отсутствие мембраны между цитоплазмой и нуклеоплазмой, последняя содержит геном в виде одной… … Ветеринарный энциклопедический словарь
Клубеньковые бактерии бобовых — Данные палеонтологии свидетельствуют о том, что самыми древними бобовыми культурами, имевшими клубеньки, были некоторые растения, принадлежащие к группе Eucaesalpinioideae. У современных видов бобовых растений клубеньки обнаружены … Биологическая энциклопедия
Индонезия — Республика Индонезия Republik Indonesia … Википедия
Соединённые Штаты Америки — (США) (United States of America, USA). I. Общие сведения США государство в Северной Америке. Площадь 9,4 млн. км2. Население 216 млн. чел. (1976, оценка). Столица г. Вашингтон. В административном отношении территория США … Большая советская энциклопедия
Эритрея — Сюда перенаправляется запрос «Экономика Эритреи». На эту тему нужна отдельная статья. Государство Эритрея ሃገረ ኤርትራ (тигр.) دولة إرتري … Википедия
Флеминг, Александр — В Википедии есть статьи о других людях с такой фамилией, см. Флеминг. Александр Флеминг англ. Sir Alexander Fleming … Википедия
Посев (микробиология) — У этого термина существуют и другие значения, см. Посев. Культура микобактерий на яичной среде Левенштейна Йенсена … Википедия
Признаки колоний микроорганизмов
к колонии бакпетлёй)
непрозрачные (стафилококки, бациллы)
полупрозрачные (энтеробактерии, бактероиды)
прозрачные как «капельки росы» (гонококки, вибрионы)
Способность бактерий образовывать на питательных средах окрашенные колонии определяется одним из двух факторов:
а) цветом пигмента, продуцируемого микроорганизмами. По химическому строению различают каратиноидные, меланиновые и другие пигменты, которые могут быть красного, оранжевого, жёлтого, коричневого, чёрного, синего или зелёного цвета. Пигментообразование детерминируется генетически. Пигменты обычно находятся в ЦПМ и защищают микробные клетки от эффектов фотоокисления, поэтому пигментообразование больше характерно для воздушной микрофлоры и служит фактором защиты от УФ. Чаще пигменты нерастворимы в питательных средах и окрашивают только колонии. Некоторые пигменты растворимы в воде (например, пиоцианин у псевдомонад) и потому диффундируют в среду, окрашивая её.
Примеры микроорганизмов, продуцирующих пигменты:
Staphylococcus aureus оранжево-желтый каротиноидный пигмент;
Prevotella melaninogenica, Peptostreptococcus niger – коричнево-черный пигмент.
б) составом среды, на которой культивируют микроорганизмы. В состав селективных или дифференциально-диагностических сред могут входить:
– индикатор рН, цвет которого меняется при разложении углеводов в составе среды;
– красители, которые могут избирательно накапливаться в колониях ферментирующих углеводы микроорганизмов. Например, Escherichia coli разлагают лактозу и образуют на среде Эндо колонии малиново-красного цвета, а на среде Левина – фиолетового, колонии Salmonella spp. и Shigella spp., не разлагающих лактозу, на этих средах бесцветны или слабо-розовые.
– соли двухвалентных металлов, которые окрашивают колонии сероводородпродуцирующих микроорганизмов в серый или черный цвет (черные или серые колонии образуют сальмонеллы на висмут-сульфитном агаре, коринебактерий дифтерии на телуритовом агаре).
Рис. 19. Колонии микроорганизмов: а – микобактерий, б – бацилл сибирской язвы, в – нокардий, г – бактероидов, д – клостридий, е – бордетелл коклюша
Несмотря на множество признаков, которыми различаются колонии, большинство микроорганизмов образуют на средах один из четырех морфотипов колоний:
– слизистые, или мукоидные, или М-колонии (от англ. mucus – слизистый) – у клебсиелл, имеющих выраженную полисахаридную макрокапсулу;
– карликовые, или D-колонии – у микоплазм и L-форм; видны только под малым увеличением микроскопа.
Под действием ряда факторов может происходить переход бактерий из S- в R-формы, называемый диссоциацией. Явление диссоциации у патогенных микробов наблюдается:
а) под действием химиопрепаратов;
б) под действием факторов иммунитета;
в) при попадании микроба во внешнюю среду.
При обилии в засеваемом материале микробов они растут в виде плёнки, покрывающей всю поверхность плотной питательной среды. Такой характер микробного роста получил название газонного. Посев газоном производят, когда нужно получить большие количества чистой микробной культуры (например, при определении чувствительности её к антибиотикам).
Стадии (фазы) роста бактериальной культуры на питательной среде (рис. 20).
Каждая фаза роста культуры в питательной среде характеризуется определённым размером клеток, скоростью размножения и потребления субстрата, синтезом метаболитов.
Логарифм количества жизнеспособных клеток
Рис. 20.Фазы роста бактериальной культуры в питательной среде:
B– период положительного ускорения;
D– фаза отрицательного ускорения;
E– стационарная фаза;
A – фаза задержки роста (начальная стационарная), или лаг-фаза (от англ. lag – отставание), в среднем длится 1–2 ч. Начало лаг-фазы связано с адаптацией клеток к среде обитания. Важную роль играет «предыстория» выращивания посевной культуры. Если использован инокулят из культуры с резко отличающимися условиями выращивания, то клеткам требуется время на синтез новых рибосом, РНК и адаптивных ферментов. В этом периоде увеличивается размер клеток, в 8–12 раз повышается содержание РНК. Деления клеток при этом почти не происходит. Полноценная среда, физиологически активная посевная культура, которая подготовлена к синхронному делению, способствуют короткой лаг-фазе (или её отсутствию) и переходу ко II фазе. Синхронизации можно достичь с помощью пониженной температуры, ограничения питательных веществ, фильтрации, обеспечивающей пропускание клеток определенного размера. Синхронизация длится 2–4 генерации, а далее наступает асинхронный рост.
B – короткий период положительного ускорения между фазами A и B, когда начинается деление бактерии.
C – фаза логарифмического (экспоненциального) роста начинается, когда скорость роста клеток всей популяции достигает постоянной величины, средняя продолжительность её 5–6 ч. Скорость деления клеток максимальная, но клетки имеют наименьший размер. Популяция бактериальной культуры состоит из делящихся клеток и достаточно стандартна по своим свойствам (содержание белка, НК, наиболее выраженные видовые признаки), поэтому эта фаза удобна для определения многих параметров популяции (плотность бактерий, скорости роста и потребления субстрата, содержание биополимеров клетки). В этот период отмечено снижение резистентности к агрессивным веществам.
Несмотря на постоянную скорость роста популяции бактерий в логарифмической фазе, отдельные клетки все же находятся в разных стадиях деления. Иногда важно синхронизировать рост всех клеток популяции, то есть получить синхронную культуру. Простыми методами синхронизации являются изменение температурных условий или культивирование в условиях недостатка питательных веществ. Вначале культуру помещают в неоптимальные условия, затем сменяют их оптимальными. При этом у всех клеток популяции синхронизируется цикл деления, но синхронное деление клеток происходит обычно не более 3-4 циклов.
D – фаза замедления скорости роста (отрицательного ускорения) длится около 2 ч. Количество питательных веществ существенно уменьшается (отмечается воздействие на бактерии лимитирующих факторов), в культуральной жидкости накапливаются метаболиты, в том числе токсичные для бактерий (отмечается ингибирующее воздействие) и скорость деления клеток снижается.
E – стационарная фаза, или фаза максимальной концентрации (М-концентрация). Клетки перестают делиться. Однако, количество живых клеток постоянно, так как количество жизнеспособных бактерий соизмеримо с количеством отмирающих. В этот период клетки переходят на эндогенные субстраты (окисляют запасные вещества, белки, углеводы, липиды). Длительность стационарной фазы различается у разных микроорганизмов. Напр., у Escherichia coli она наступает через 18–24 ч, у Azotobacter – через 72 ч с момента внесения инокулята в питательную среду.
F – фаза отмирания, характеризуется массовой гибелью бактерий. В бактериальной популяции отмечается образование инволюционных форм, аутолиз под действием собственных ферментов. У бактерий меняются морфологические и биохимические свойства. Гибель может наступить через несколько дней, недель, месяцев.
В эту фазу различают периоды ускоренной гибели (количество живых клеток начинает снижаться с увеличивающейся скоростью), логарифмической гибели (количество живых клеток убывает с максимальной скоростью), уменьшения скорости гибели (количество живых клеток убывает с уменьшающейся скоростью) и стационарную фазу минимума (количество живых клеток минимально).
Управляемое культивирование микроорганизмов.
Промышленное использование микроорганизмов требует получения значительного количества микробного продукта (биомассы микроорганизмов, продуцируемых ими антибиотиков, токсинов и др.). Для этого используют методы управляемого культивирования микроорганизмов. Управляемое культивирование проводят в специальном оборудовании биореакторах, которые позволяют создавать благоприятные и равномерные условия для роста и размножения микроорганизмов, что повышает накопление их биомассы и метаболитов, сокращает время культивирования. Управляемое культивирование может быть периодическим или непрерывным, аэробным или анаэробным, поверхностным или глубинным (во всей толще жидкой питательной среды), защищенным (асептическим) или незащищенным.
Периодическое культивирование микроорганизмов – выращивание микроорганизмов в стационарных условиях (в питательной среде без непрерывного поступления нутриентов извне). В таких условиях по мере роста микроорганизмов происходит снижение количества белковых и углеводных субстратов, снижение окислительно-восстановительного потенциала и рН, что приводит к гибели культуры. Для периодического культивирования используют специальное оборудование ферментеры, в которых осуществляют постоянное перемешивание и аэрацию (барботаж) среды. Периодически ферментер опорожняют, производят выделение и очистку продукта, после чего начинают новый цикл. Существует несколько вариантов периодического культивирования:
продлённое периодическое культивирование, или культивирование с дробным дозированием субстрата подпитывают культуру периодически добавляя питательные вещества;
многоциклическое культивирование часть культуры предыдущего цикла переносят в новую среду;
отъемно-доливное культивирование в середине экспоненциальной фазы роста отбирают половину культуральной жидкости, а вместо неё вносят свежую питательную среду.
Непрерывное культивирование микроорганизмов выращивание микроорганизмов в динамических условиях (в постоянно обновляемой питательной среде). Проводят в специальных биореакторах хемостатах или турбистатах, которые снабжены устройствами для поддержания температуры и рН на постоянном уровне, а также для автоматической подачи свежей питательной среды и удаления культуральной жидкости с продуктами метаболизма. Микробная популяция тем самым поддерживается необходимое время в логарифмической фазе роста. Управление скоростью поступления питательных веществ в проточных биореакторах осуществляется двумя способами турбидостатным и хемостатным.
В турбидистате управление культивированием проводят путем измерения мутности выходящего потока с использованием фотоэлектрического элемента. Скорость разбавления свежей средой устанавливают в зависимости от требуемой плотности выходящей из турбидистата культуры.
В хемостатах управление культивированием проводят путем лимитирования концентрации одного из ростовых факторов в поступающей в хемостат среде (например, концентрацию глюкозы, фосфора, серы), тем самым изменяют плотность микробных клеток в единице объёма среды.
Алгоритм описания колоний
Бактерии и их свойства: описание видов и штаммов
Описывая разновидности бактерий, ученые указывают их морфологические, биохимические, культуральные и серологические свойства.
Культуральные характеристики
Культуральную характеристику роста бактериальных колоний на питательной среде дают после их визуального осмотра. Они могут иметь массу морфологических и культуральных различий, кроме того, способны меняться с течением времени. Молодые и старые колонии бактерий всегда описывают по культуральным свойствам отдельно:
Для чего используют колонии
Обычно они используются для получения чистых культур. Чистая культура – это популяция микроорганизмов одного вида, выращенная с использованием благоприятной среды. Много видов микроорганизмов различают по какому-то специфическому признаку. Их объединяют по разным критериям на биовары (то есть биологические варианты). На фото, сделанном с применением электронного микроскопа, возможно определение многих видов микробов:
Все разновидности таких микроорганизмов можно рассмотреть на фото.
Общие критерии для определения колоний
Современная микробиология использует такие общие критерии для определения той или иной бактериальной совокупности, оценки ее структуры:
По всем этим признакам все совокупности микроорганизмов подлежат всестороннему исследованию. Такие признаки хорошо видны на фото, которые сделаны с использованием электронного микроскопа и других приборов.









Изучение микрофлоры молока
Определение бактерий имеет значение в практической деятельности человека, например, в пищевой промышленности. Так, бактериальная обсемененность молока является основным показателем санитарных условий его получения. В случае превышения порогового количества микроорганизмов в молоке, сортность продукта снижается.
С 1987 г. страны ЕЭС приняли единые стандарты по степени бактериальной обсемененности молока, подразделяя продукт на три категории:
В данном случае числа указывают на максимально возможное количество микроорганизмов в 1 мл молока (обсемененность).
Наличие в молоке соматических клеток является важным критерием качества. Эти клетки являются частичками биомассы животного. Они образуются в вымени и отражают естественные процессы старения и обновления организма.
Число соматических клеток в молоке возрастает при наличии у животных травм, заболеваний ЖКТ или других патологий, что приводит к росту показателя бактериальной обсемененности молока.
Как получают культуры
В любой микробиологической лаборатории проводится выделение культур микробов. Их необходимо иметь для правильного определения возбудителя инфекционного заболевания больного и выбрать соответствующее лечение. Врачи должны правильно определить название возбудителей, вызвавших болезнь. Без колоний от бактерий сделать это очень трудно, а иногда и невозможно.









Получить нужный штамм микробов можно при помощи посевов. Их обычно делают на жидкие питательные составы. Посев лучше всего делать в чашке Петри. Чашка Петри – это прозрачная стеклянная посуда в виде цилиндра невысокого размера. Он закрывается крышкой таких же размеров. Чашка Петри широко используется в микробиологии. Микроорганизмы, получаемые в таких сосудах, хорошо видны на фото. В чашку Петри добавляют питательное вещество и опускают биоматериал.
В чашке Петри можно также производить посев на плотную среду. В таком случае биологический материал размещают возле ее краев.
Как происходит посев в чашке Петри
В чашку Петри материал, необходимый для получения культуры, наносится петлей, пипеткой или тампоном возле ее края. Шпатель быстро (на счет «раз») проносится через пламя
Очень осторожно биоматериал распределяется по всей поверхности чашки
В чашке Петри возможен также посев при помощи укола в толщу питательного состава. При этом получается чистая совокупность микробов, и это хорошо видно на фото, сделанном с использованием микроскопа.









В прибор для получения колоний от бактерий можно также производить посев в толщу питательного раствора.
Другие способы получения бактериальных колоний
Возможно разведение колоний микробов по Коху. При этом материал, необходимый для определения, последовательно разводят (как правило, счет разведений доходит до четырех). На последнем этапе размножения в приборе, используемом для инкубации бактерий, появляются изолированные группы микробов, хорошо заметные на фото. Все такие колонии происходят из материнской клетки.
Подобная форма получения штаммов используется тогда, когда материал, подготовленный для определения, разводится в пробирке при помощи стерильного питательного бульона. Одна капля материала вносится в первую по счету чашку. Ее распределяют по всему сосуду. Далее по нему проводят стерильным шпателем, и в такой же форме делается посев во второй чашке. Эта форма существования колоний микроорганизмов позволяет получить самые чистые их штаммы, хорошо заметные на фото.
Выделение колоний в специальных приборах
Иногда для получения чистых совокупностей бактерий применяют специальные приборы. Они облегчают определение анаэробных бактерий. В таких приборах можно создать все необходимые условия для их развития.
Чаще всего используют микроманипулятор. Это прибор, который позволяет извлекать всего лишь одну клетку из суспензии при помощи микропетли. На предметном столике микроскопа устанавливается влажная камера, в которой помещен прибор «висячая капля». В таком приборе определение бактерий, их размеров, форм производится с точностью до микрона. Исследователь же может легко определить клетки, переместить их в пробирку, где имеется уже стерильная питательная жидкость. В ней получается чистый штамм той или иной бактерии.
Виды сред для выращивания бактерий
Методы выращивания бактерий с целью выявления их культуральных свойств часто требуют применения субстратов различной плотности. Различают жидкие, полужидкие и плотные питательные среды:
В зависимости от состава их делят на среды с определенным составом или синтетические, приготовленные в промышленных или лабораторных условиях из известных компонентов и те, состав которых не может быть определен точно – это растительные и животные природные субстраты (например, картофель, морковь, молоко или экстракты, полученные из них).
С точки зрения целей использования различают общие (общеупотребительные), селективные, обогащенные, специальные и дифференциально-диагностические среды:
Кипячение субстратов позволяет удалить из них кислород. Часто применяется метод выращивания анаэробов в толще питательных сред, что необходимо для выявления культуральных свойств бактерий.