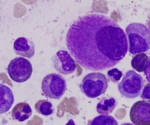
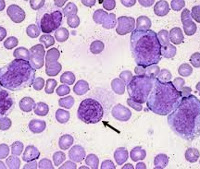
код по мкб 10 сублейкемический миелоз
Сублейкемический миелоз
Сублейкемический миелоз относится к лейкозам, проявляющимся несколько повышенной полиморфно-клеточной миелопролиферацией типа панмиелоза или миеломегакариоцитарного миелоза, прогрессирующим миелофиброзом и остеомиелосклерозом, спленомегалией, гепатомегалией с трехростковой миелоидной метаплазией в этих и, значительно реже, в других органах и тканях.
Что провоцирует / Причины Сублейкемического миелоза:
В литературе не встретились данные о структуре заболеваемости сублейкемическим миелозом.
Патогенез (что происходит?) во время Сублейкемического миелоза:
Некоторые исследователи полагают, что при сублейкемическом миелозе первично нарушается процесс кроветворения на уровне клетки-предшественницы миелопоэза. Принадлежность его к гемобластозам и вторичный характер миелофиброза основываются на исследованиях типов Г-6-ФД в клетках крови и фибробластах костного мозга и кожи у мулаток, гетерозиготных по этому ферменту. Согласно одной из концепций, миелофиброз при этой форме лейкоза обусловлен мегакариоцитами и тромбоцитами, продуцирующими ростковый фактор, усиливающий пролиферацию фибробластов. Топография миелофиброза соответствует участкам скопления мегакариоцитов. Сторонники принадлежности сублейкемического миелоза к лейкозам указывают на миелоидную метаплазию в селезенке и других органах, финальное обострение процесса по типу бластного криза, наличие злокачественной формы заболевания и чувствительность таких больных к цитостатической терапии.
Симптомы Сублейкемического миелоза:
При доброкачественном варианте сублейкемического миелоза развернутой клинической картине предшествует длительный бессимптомный период. Продолжительность жизни от момента установления диагноза колеблется от 1,5 до 5 лет, встречаются случаи более длительного течения заболевания (15-20 и более лет).
Злокачественные формы сублейкемического миелоза характеризуются острым (подострым) или молниеносным течением, ранним возникновением бластного криза, глубокой тромбоцитопенией и выраженным геморрагическим синдромом, приводящим к смерти. Часто присоединяются инфекционные осложнения, сердечная и печеночная недостаточность и тромбозы. В 10-17% случаев диагностируется портальная гипертензия с варикозным расширением вен пищевода.
Примерная формулировка диагноза:
Сублейкемический миелоз чаще обнаруживается у лиц старше 40 лет. Иногда в течение многих лет больные не отмечают никаких признаков болезни, обращаются к врачу с жалобами на похудание, периодически возникающую лихорадку, боли в костях и в области селезенки. На фоне несостоятельности гемостаза и тромбоцитопении возникают кровоизлияния в кожу, суставы, нередки кровотечения из вен пищевода и желудка. Анемия чаще носит нормохромный, редко мегалобластный или гемолитический характер. В отдельных случаях выявляются эритроцитоз и увеличение эритропоэза в костном мозге. В гемограмме количество лейкоцитов увеличено, иногда снижено, отмечается нейтрофилез со сдвигом влево. Количество тромбоцитов увеличено или нормально, они функционально неполноценны. В миелограмме — мегакариоцитоз (незрелые формы). В костном мозге — сужение полостей, заполненных фиброзной тканью. В увеличенной селезенке, печени и других органах и тканях очаги внекостномозгового кроветворения полиморфного состава.
Диагностика Сублейкемического миелоза:
Диагноз сублейкемического миелоза устанавливают на основании клинических данных и результатов исследования состояния гемопоэза (гемограммы, миелограммы, биоптата костного мозга).
Сублейкемический миелоз дифференцируют от хронического миелолейкоза, протекающего с сублейкемическим лейкоцитозом. Обнаружение Ph’-хромосомы служит веским аргументом в пользу миелолейкоза.
Дифференциальную диагностику следует проводить также между сублейкемическим миелозом и вторичным миелофиброзом, который может развиваться при злокачественных новообразованиях, длительных инфекциях (туберкулез), а также при токсических воздействиях (бензол и его производные и др.).
Лечение Сублейкемического миелоза:
На ранних стадиях сублейкемического миелоза при умеренной анемии и спленомегалии, не вызывающей абдоминального дискомфорта, цито-статическое лечение применять не следует; можно ограничиться общеукрепляющей терапией. Показаниями к назначению цитостатиков является спленомегалия с компрессионным синдромом и явлениями гиперспленизма, тромбоцитемия с угрозой возникновения тромбозов, прогрессирующая бластемия, плетора.
Основные клинико-гематологические и рентгенологические изменения при сублейкемическом миелозе
Размеры селезенки, печени
Спленомегалия, нередко нижний край селезенки достигает малого таза, гепатомегалия у 50% больных (эти симптомы могут отсутствовать), явления абдоминального дискомфорта
Анемня, чаще нормохромная, иногда мегалобластного или гемолитического характера (снижение продолжительности жизни эритроцитов, повышение уровня свободного билирубина в сыворотке крови); в отдельных случаях эритроцитоз, часто анизо- и пойкилоцитоз, мишеневидные и грушевидные формы эритроцитов, эритро- и нормобласты, ретикулоцитоз; в костном мозге эритропоэз иногда бывает усилен
В гемограмме количество лейкоцитов увеличено, но не существенно, редко снижено; нейтрофилез со сдвигом влево, иногда встречаются миелобласты. В костном мозге увеличено количество незрелых форм нейтрофилов
Количество тромбоцитов увеличено у 50% больных, они функционально неполноценны (снижены ретракция кровяного сгустка, уровень фактора 3, адгезивность тромбоцитов, увеличено время кровотечения); в костном мозге увеличено число мегакариоцитов включая незрелые формы
Экстра медуллярный гемопоэз
Характерно наличие очагов трехросткового кроветворения, состоящих из клеток различной степени зрелости, в селезенке, печени, других органах
Массивное разрастание костной ткани с уменьшением объема деятельного костного мозга и с сужением его полостей, заполненных фиброзной тканью, жировыми клетками; костные балки утолщены, неправильной формы вследствие напластования атипичной костной ткани, остеоида
На рентгенограммах костей (таз, позвонки, ребра, череп, длинные трубчатые) кортикальный слой утолщен, утрачена нормальная трабекулярная структура, может выявляться облитерация костномозговых полостей
Лучевая терапия на область резко увеличенной селезенки вызывает кратковременный положительный эффект, купируя явления абдоминального дискомфорта, однако возможно развитие глубокой цитопении.
Спленэктомия показана в основном в случаях глубоких гемолитических кризов, не поддающихся медикаментозной терапии, при угрозе разрыва селезенки и рецидивирующих ее инфарктах, при выраженном геморрагическом тромбоцитопеническом синдроме. Спленэктомия противопоказана в терминальной стадии, при тромбоцитозе и гиперкоагуляции.
Глюкокортикоидные гормоны назначают при анемии гемолитического характера, цитопениях, длительной лихорадке неинфекционного происхождения, артралгиях. Анаболические гормоны (неробол, ретаболил) показаны при анемии, обусловленной недостаточностью эритропоэза, длительном лечении глюкокортикоидными гормонами. При глубокой анемии применяют трансфузии эритроцитной массы; тромбоцитопенический геморрагический синдром служит показанием для переливаний тромбоконцентрата. При железодефицитной анемии назначают препараты железа.
К каким докторам следует обращаться если у Вас Сублейкемический миелоз:
Вас что-то беспокоит? Вы хотите узнать более детальную информацию о Сублейкемического миелоза, ее причинах, симптомах, методах лечения и профилактики, ходе течения болезни и соблюдении диеты после нее? Или же Вам необходим осмотр? Вы можете записаться на прием к доктору – клиника Euro lab всегда к Вашим услугам! Лучшие врачи осмотрят Вас, изучат внешние признаки и помогут определить болезнь по симптомам, проконсультируют Вас и окажут необходимую помощь и поставят диагноз. Вы также можете вызвать врача на дом. Клиника Euro lab открыта для Вас круглосуточно.
Как обратиться в клинику:
Телефон нашей клиники в Киеве: (+38 044) 206-20-00 (многоканальный). Секретарь клиники подберет Вам удобный день и час визита к врачу. Наши координаты и схема проезда указаны здесь. Посмотрите детальнее о всех услугах клиники на ее персональной странице.
Если Вами ранее были выполнены какие-либо исследования, обязательно возьмите их результаты на консультацию к врачу. Если исследования выполнены не были, мы сделаем все необходимое в нашей клинике или у наших коллег в других клиниках.
Если Вы хотите задать вопрос врачу – воспользуйтесь разделом онлайн консультации, возможно Вы найдете там ответы на свои вопросы и прочитаете советы по уходу за собой. Если Вас интересуют отзывы о клиниках и врачах – попробуйте найти нужную Вам информацию в разделе Вся медицина. Также зарегистрируйтесь на медицинском портале Euro lab, чтобы быть постоянно в курсе последних новостей и обновлений информации на сайте, которые будут автоматически высылаться Вам на почту.
Миелофиброз – это хроническое гематологическое заболевание, характеризующееся опухолевой пролиферацией гемопоэтических стволовых клеток и фиброзом костного мозга. Основные клинические проявления включают симптомы опухолевой интоксикации и анемического синдрома (прогрессирующую слабость, бледность кожи и слизистых оболочек, потерю веса), а также увеличение селезенки (спленомегалию). Диагноз устанавливается на основании молекулярно-генетических исследований, изучения гистологической картины костного мозга. Лечение проводится с помощью химиотерапевтических препаратов. Хирургические методы лечения подразумевают трансплантацию костного мозга и удаление селезенки.
МКБ-10
Общие сведения
Миелофиброз (агногенная миелоидная метаплазия, сублейкемический миелоз) – злокачественное заболевание, при котором происходит постепенное замещение костного мозга опухолевыми стволовыми клетками и разрастающейся соединительной тканью. Впервые эту патологию описал немецкий врач Г. Хойк в 1879 году. А в 1951 году американским гематологом Уильямом Дамешеком миелофиброз был выделен в самостоятельную нозологическую единицу. При неблагоприятном течении миелофиброз способен трансформироваться в более тяжелую болезнь ‒ острый лейкоз. Распространенность миелофиброза составляет от 0,3 до 0,7 случаев на 100 тыс. населения. Пик заболеваемости приходится на возраст от 50 до 70 лет, но встречаются и молодые пациенты. Чаще страдают мужчины.
Причины миелофиброза
Существует первичный и вторичный сублейкемический миелоз. Точная причина первичного миелофиброза до сих пор не установлена. Наибольшей популярностью среди специалистов в области гематологии пользуется теория влияния генетической мутации. У большинства пациентов выявляются мутации гена тирозинкиназы (JAK2V617F), кальретикулина (CALR), тромбопоэтина (MPL), регулирующих экспрессию белков JAK-STAT сигнального пути. Гены локализуются в локусе хромосомы del3p24.
В качестве этиологического фактора изучается действие большой дозы радиоактивного излучения. Также рассматривается роль персистирующих вирусных инфекций (вируса простого герпеса, Эпштейна-Барра, цитомегаловируса), длительного приема оральных контрацептивов, миелосупрессивных лекарственных препаратов, контакта с различными органическими и неорганическими соединениями (бензолом, мышьяком). Вторичный миелофиброз развивается как исход других хронических миелопролиферативных заболеваний – истинной полицитемии, эссенциальной тромбоцитемии, хронического миелолейкоза.
Патогенез
В результате повышенной экспрессии сигнальных белков в одной из стволовых костномозговых клеток запускается активная пролиферация (опухолевая трансформация). Этот процесс сопровождается вторичным воспалением с выделением цитокинов и факторов роста. Факторы роста фибробластов и эндотелия сосудов индуцируют выработку стромальными клетками костного мозга большого количества коллагена и разрастание соединительной ткани (собственно фиброз). Постепенно нормальная ткань костного мозга замещается опухолью и соединительной тканью.
При массивном поражении опухолью костного мозга клетки крови, не достигнув стадии полного созревания, попадают в системный кровоток. Это приводит к образованию очагов экстрамедуллярного (внекостномозгового) кроветворения, главным образом в печени и селезенке. Распад опухоли ведет к высвобождению мочевой кислоты, которая откладывается в тканях суставов и почечных канальцах.
Симптомы миелофиброза
Длительное время пациент чувствует себя удовлетворительно. Через несколько лет от начала заболевания постепенно появляется опухолевая интоксикация в виде общей слабости, повышения температуры до субфебрильных цифр, потливости, усиливающейся по ночам. У больного снижается аппетит, он стремительно теряет в весе. Присоединяется анемический синдром (бледность кожных покровов, головокружение, учащение сердцебиения). Характерны носовые, десневые кровотечения, геморрагические высыпания на коже. Возникают боли в суставах, кожный зуд, боли в костях.
Пациент ощущает тяжесть и боли в левом подреберье вследствие выраженного увеличения селезенки. На фоне спленомегалии развивается синдром гиперспленизма, который заключается в массивном разрушении клеток крови (в основном эритроцитов) в синусоидах селезенки. В этом случае встречаются признаки гемолиза (желтушность кожи, слизистых оболочек, потемнение мочи).
Редкие симптомы связаны с необычной локализацией очагов экстрамедуллярного кроветворения – в легких (кашель, затруднение дыхания, кровохарканье), желудочно-кишечном тракте (боли в животе, кровавая диарея). При расположении очагов в центральной и периферической нервной системе наблюдаются эпилептические судороги, нарушения чувствительности, слабость движений в конечностях, вплоть до полного паралича.
Осложнения
При миелофиброзе часто образуются тромбы, которые приводят к острому нарушению мозгового кровообращения, инфаркту миокарда, тромбоэмболии легочной артерии. Стойкое снижение уровня лейкоцитов нередко сопряжено с различными инфекциями, приобретающими тяжелое течение. Наиболее неблагоприятным осложнением считается трансформация миелофиброза в миелолейкоз (бластный криз), трудно поддающийся терапии. К нетипичным осложнениям следует отнести патологические переломы из-за деструкции трубчатых костей и портальную гипертензию, причиной которой служит длительная обструкция микротромбами внутрипеченочных вен.
Диагностика
Курацией пациентов с миелофиброзом занимаются врачи-гематологи. При общем осмотре обращает на себя внимание изменение цвета кожных покровов, слизистых (бледность или желтушность), спленомегалия при пальпации и перкуссии селезенки, иногда достигающей гигантских размеров (до лобкового симфиза). Дополнительные методы диагностики включают:
Для достоверной постановки диагноза гематологическим сообществом разработаны специальные критерии. Большие критерии включают повышенную клеточность костного мозга с ретикулярным и коллагеновым фиброзом, наличие мутаций генов JAK2V617F, MPL, CALR. К малым критериям относятся анемия, спленомегалия, лейкоэритробластоз (присутствие в крови незрелых форм лейкоцитов, эритроцитов), а также повышение лактатдегидрогеназы. Диагноз считается подтвержденным, если имеются 2 больших критерия или 1 большой и 3 малых критерия.
Миелофиброз следует дифференцировать в первую очередь с гематологическими заболеваниями, такими как аутоиммунные гемолитические анемии, гемобластозы (лейкозы, лимфомы). Сочетание спленомегалии с симптомами интоксикации (слабостью, субфебрилитетом, ночной потливостью) требует исключения туберкулеза, подострого инфекционного эндокардита.
Лечение миелофиброза
Прогноз и профилактика
Хронический миелолейкоз
Общая информация
Краткое описание
Одобрен
Объединенной комиссией по качеству медицинских услуг
Министерства здравоохранения Республики Казахстан
от «3» октября 2019 года
Протокол №74
Хронический миелолейкоз (ХМЛ) – клональное миелопролиферативное заболевание, развивающийся в результате злокачественной трансформации в ранних гемопоэтических предшественниках. Цитогенетическим маркером ХМЛ является приобретенная хромосомная транслокация t(9;22), которая получила название филадельфийской хромосомы (Ph+). Выявление Ph`-хромосомы происходит в результате обмена генетическим материалом между хромосомами 9 и 22 t (9;22). В результате переноса генетического материала с 9 на 22 хромосому на ней образуется слитный ген BCR—ABL1.
Хронический миелоидный лейкоз (ХМЛ) составляет 15% от общего числа лейкозов у взрослых. Средний возраст начала заболевания составляет 67 лет; однако ХМЛ встречается во всех возрастных группах (статистика SEER).
Код(ы) по МКБ-10:
Дата разработки/пересмотра протокола: 2015 год (пересмотр 2018 г.)
Сокращения, используемые в протоколе:
| АЛТ | – | аланинаминотрансфераза |
| АСТ | – | аспартатаминотрансфераза |
| аллоТКМ | – | аллогенная трансплантация костного мозга |
| БФ | – | бластная фаза |
| БМО | – | большой молекулярный ответ |
| ГСК | – | гемопоэтические стволовые клетки |
| ГГТП | – | гаммаглютамилтранспептидаза |
| Ед | – | единица измерения |
| ИТК | – | ингибиторы тирозинкиназ |
| ИФА | – | иммунноферментный анализ |
| ИФТ | – | иммуннофенотипирование |
| КП | – | клинический протокол |
| КТ | – | компьютерная томография |
| ЛДГ | – | лактатдегидрогеназа |
| Мл | – | миллилитр |
| МЕ | – | международная единица |
| Мг | – | миллиграмм |
| МКБ | – | международная классификация болезней |
| ОАК | – | общий анализ крови |
| ОБП | – | органы брюшной полости |
| ПХТ | – | полихимиотерапия |
| ПЦР | – | полимеразная цепная реакция |
| ПГО | – | полный гематологический ответ |
| ПМО | – | полный молекулярный ответ |
| РКИ | – | рандомизированное клиническое исследование |
| СЦИ | – | стандартное цитогенетическое исследование |
| ТКМ | – | трансплантация костного мозга |
| УД | – | уровень доказательности |
| УЗИ | – | ультразвуковое исследование |
| ЭКГ | – | электрокардиограмма |
| ФА | – | фаза акселерации |
| ХФ | – | хроническая фаза |
| ХМЛ | – | хронический миелолейкоз |
| ЦО | – | цитогенетический ответ |
| BCR/ABL | – | белок с повышенной тирозинкиназногй активностью, продукт гена BCR/ABL |
| EBMT | – | European Group for blood and Marrow |
| ELN | – | Европейская организация по лечению лейкозов |
| ESMO | – | Европейское общество медицинской онкологии |
| NCCN | – | Национальная онкологическая сеть США |
| Ph+ | – | клетки, содержащие филадельфийскую хромосому |
| FISH | – | флуоресцентная гибридизация |
Пользователи протокола: врачи общей практики, терапевты, онкологи, гематологи.
Категория пациентов: взрослые, беременные.
Шкала уровня доказательности [1]:
| А | Высококачественный мета-анализ, систематический обзор РКИ или крупное РКИ с очень низкой вероятностью (++) систематической ошибки результаты которых могут быть распространены на соответствующую популяцию. |
| В | Высококачественный (++) систематический обзор когортных или исследований случай-контроль или Высококачественное (++) когортных или исследований случай-контроль с очень низким риском систематической ошибки или РКИ с невысоким (+) риском систематической ошибки, результаты которых могут быть распространены на соответствующую популяцию. |
| С | Когортное или исследование случай-контроль или контролируемое исследование без рандомизации с невысоким риском систематической ошибки (+). Результаты, которых могут быть распространены на соответствующую популяцию или РКИ с очень низким или невысоким риском систематической ошибки (++ или +), результаты которых не могут быть непосредственно распространены на соответствующую популяцию. |
| D | Описание серии случаев или неконтролируемое исследование или мнение экспертов. |
| GCP | Наилучшая клиническая практика. |
Автоматизация клиники: быстро и недорого!
— Подключено 300 клиник из 4 стран
Автоматизация клиники: быстро и недорого!
Мне интересно! Свяжитесь со мной
Классификация
Классификация 3
В течении ХМЛ выделяют 3 фазы: хроническую, переходную (фазу акселерации) и терминальную фазу (бластной трансформации или бластный криз). 2 Критерии фаз акселерации и бластного криза представлены в таблице.
Фазы ХМЛ по классификации ELN [6]:
| Фаза ХМЛ | Классификация ELN |
| Хроническая | Отсутствие признаков фазы акселерации и бластного криза |
| Акселерации | 15-29% бластных клеток в периферической крови и/или костном мозге; сумма бластов и промиелоцитов ≥30% (при этом бластов |
| Бластный криз | Наличие в периферической крови или костном мозге ≥30% бластных клеток появление экстрамедулярных инфильтратов бластных клеток |
Стратификация пациентов по группам риска ELN 2017.
Группа риска ХМЛ – понятие, применимое только для хронической фазы (ХФ) ХМЛ. Группа риска с этой фазе оценивается только на момент диагностики заболевания, до начала терапии. Она рассчитывается на основании прогностически значимых характеристик: низкий, промежуточный, высокий риск (УД – А).
Таблица 3.
| Шкала | Формула расчета | Группа риска | Конечная точка |
| Eutos | 7 × число базофилов (%) + 4 ×размеры селезенки* (см) | Низкий ( | Полный цитогенетический ответ |
| Euro | 0,6666 × возраст (0-при 50 лет/) +0,0420 × размеры селезенки- (см) +0,0584 × бластных клеток (%) +0,0413 ×число эозинофилов (%) +0,2039 × чило базофилов (0- при 3) +1,0956 × число тромбоцитов (0 – при 1500×109/л) × 1000 | Низкий (≤ 87) Промежуточный (781-1480) Высокий (≥1481) |
Выживаемость |
| ELTS | 0,0025 × (возраст/10)3 +0,0615 × размеры селезенки* (см) +0,1052 × число бластных клеток (%) + 0,4104 × число тромбоцитов × 109/л /1000-0,5 | Низкий (≤ 1,5680) Промежуточный(>1,5680, но ≤ 2,2185 ) Высокий (>2,218) |
ХМЛ-специфическая выживаемость |
Диагностика
МЕТОДЫ, ПОДХОДЫ И ПРОЦЕДУРЫ ДИАГНОСТИКИ 8
Диагностические критерии
Дифференциальный диагноз
Дифференциальный диагноз и обоснование дополнительных исследований:
Диагноз хронического миелолейкоза в классических случаях не представляет затруднений. Трудности обычно возникают в начальном периоде заболевания, когда еще нет четких лейкемических изменений со стороны крови и выраженных признаков системной метаплазии в органах.
Основным патогномоничным признаком заболевания является обнаружение при цитогенетическом исследовании филадельфийской хромосомы (t(9;22)) и химерного гена BCR-ABL1.
Таблица 6.
Лечение (амбулатория)
ТАКТИКА ЛЕЧЕНИЯ НА АМБУЛАТОРНОМ УРОВНЕ [13-15,21,22]
Принципы выбора ИТК
При использовании препаратов ИТК улучшились показатели общей выживаемости, достижение хорошего качества жизни, восстановления нормального кроветворения, путем подавления лейкозного клона.
Эффективность иматиниба доказана положительным опытом применения в клинических исследованиях (IRIS, CML IV). Однако, резистентные к лечению иматинибом и подобными препаратами больные ХМЛ нуждаются в раннем переводе на другую терапию.
Необходимо отметить, что абсолютных противопоказаний к использованию ИТК у пациентов с ХМЛ нет. При выборе конкретного препарата в первую и последующие линии лечения необходимо учитывать фазу ХМЛ, сопутствующие заболевания и риск развития побочных эффектов в процессе терапии, а также мутационный спектр.
Выбор терапии ИТК первой линии у пациента должен основываться на оценке риска, профиле токсичности ИТК, возрасте пациента, способности переносить терапию и наличии сопутствующих заболеваний.
Терапия ИТК первой и второй линии должна быть выбрана с учетом наибольшей эффективности и наименьшего риска побочных явлений. Аллогенная трансплантация гемопоэтических стволовых клеток должна быть обязательно рассмотрена для ХМЛ ХФ с высокой группой риска прогрессии, у больных с неудачей терапии первой линии, а также в продвинутых фазах ХМЛ, но в гематологической ремиссии. Ранняя оценка ответа на лечение, предупреждение развития резистентности и быстрое переключение на максимально эффективную терапию при отсутствии оптимального ответа должны быть основаны принципами современной терапии ХМЛ (УД – А).
Нилотиниб (150 мг, 200мг, таблетка/капсула).
Противоопухолевый препарат, ингибитор протеин-тирозинкиназы. Нилотиниб мощно ингибирует тирозинкиназную активность BCR-ABL1 онкопротеина клеточных линий и первично положительных по филадельфийской хромосоме (Ph-положительных) лейкозных клеток. Оказывает выраженное ингибирующее влияние на BCR-ABL1 онкопротеин дикого типа, а также демонстрирует активность в отношении 32 и 33 основных иматинибрезистентных мутантных форм BCR-ABL1-тирозинкиназы, за исключением Т3151 мутации.
В первой линии терапии показан больным ХФ ХМЛ в начальной дозе 600 мг/сут и в ФА ХМЛ в дозе 800 мг/сут. Во второй линии терапии назначается в дозе 800 мг/сут в ХФ и ФА. Независимо от фазы ХМЛ принимается 2 раза в сутки в равных дозах с интервалом 12 часов. Прием рекомендуется осуществлять натощак или не ранее чем через 2 часа после еды, после приема нилотиниба пищу следует принимать не ранее чем через 1 час. Капсулы запивать достаточным количеством воды. При развитии токсических проявлений доза может быть снижена до 400 мг 1 раз в сутки. При недостаточной эффективности препарата возможно повышение дозы до 800 мг в сутки больным в ХФ.
С осторожностью применять при панкреатите в анамнезе, сахарном диабете, атеросклерозе сосудов, окклюзионной болезни периферических артерий.
Дазатиниб (20 мг, 50 мг, 70 мг, 100 мг, таблетка/капсула).
Противоопухолевое средство, многоцелевой препарат, ингибитор протеинтирозинкиназ: BCR-ABL1, семейство SRC (SRC, LCK, YES, FYN), c-KIT, EPHA2 и PDGFR бета. Связывается со многими формами ABL киназы, активен в лейкозных клеточных линиях, как чувствительных, так и резистентных к иматинибу. Дазатиниб подавляет активность не только ABL-тирозинкиназы, c-Kit- и PDGFR-киназ, но и активность около 30 других различных киназ: семейства SRC (SRC, LCK, YES, FIN), семейства TYR и SER/THR (GAK, MAPK14, MAP3K, MAP3K4), DDR1, EPHA, ZAK и др., может связываться как с активной, так и неактивной конформацией киназного домена ABL. Активен в отношении мутантных форм BCR-ABL-тирозинкиназы, за исключением T315I. Рекомендуемая доза дазатиниба для ХФ составляет 100 мг/сут, а для ФА и БК – 140 мг/сут. При явлениях токсичности доза дазатиниба больным в ХФ может быть снижена до 80 мг 1 раз в сутки, больным в ФА и БК – до 100 мг 1 раз в сутки, при повторных эпизодах токсичности – до 80 мг/сут. При недостаточной эффективности препарата возможно повышение дозы до 140 мг 1 раз в сутки больным в ХФ. С учетом фармакокинетики Дазатиниб характеризуется приемом, вне зависимости от приема пищи. Показана возможность Дазатиниба проникать через гематоэнцефалический барьер.
С осторожностью применять при хронических сердечно-сосудистых заболеваниях, хронических обструктивных заболеваниях легких, бронхиальной астме, пневмонии, травма грудной клетки, хронических заболеваниях ЖКТ с высоким риском развития кровотечений.
Рекомендации по лечению ХМЛ.
| Фаза акселерации | ||
| 2-я другая линия | Отсутствие ответа | Нилотиниб или Дазатиниб Обсудить аллоТКМ |
| Бластный криз | ||
| Лимфоидный вариант | Терапия по программе лечения Ph+ ОЛЛ Дазатиниб 140 мг/сут как этап подготовки к алло-ТГСК Алло-ТГСК (если достигнута 2-я хроническая фаза) с последующим продолжением ИТК (выбор ИТК в зависимости от предшествующего лечения, переносимости, мутационного анализа). Паллиативная терапия |
|
| Миелоидный вариант | Терапия по программе лечения ОМЛ Дазатиниб 140 мг/сут как этап подготовки к алло-ТГСК с последующим продолжением ИТК (выбор ИТК в зависимости от предшествующего лечения, переносимости, мутационного анализа). Паллиативная терапия |
|
4Пациентам с высоким риском в хронической фазе ХМЛ возможно использование нилотиниба и дазатиниба в первой линии терапии (при сумме баллов >1480 по EURO, >87 по EUTOS.
Терапия при неудаче лечения первой и второй линии:
Возможности терапии при неудаче первой и второй линии лечения, а также при прогрессии ХМЛ до продвинутых фаз ограничены. При получении клинико-гематологической ремиссии, достижении редукции опухолевого клона (клинико-гематологического, цитогенетического ответа) при третьей линии терапии вопрос о выполнении аллоТКМ необходимо решать незамедлительно, так как этот метод является единственным, способным в этой ситуации дать шанс на длительную безрецидивную выживаемость (УД – А).
| Мутация | Рекомендации по лечению |
| Y253H, E255K / V или F359V/C/I | Дазатиниб |
| F317L / V / I / C, T315A или V299L | Нилотиниб |
| E255K / V, F317L / V / I / C, F359V / C / I, T315A или Y253H | Бозутиниб |
| T315I | Понатиниб, Омацетаксин, аллогенная ТКМ или клиническое испытание |
Для оценки эффективности терапии необходимо проводить своевременный мониторинг гематологических, цитогенетических и молекулярно-генетических показателей (таб.5)
При выявлении мутации T315I показано прекращение терапии ИТК, рекомендуется проведение HLA- типирования и выполнения аллоТКМ при наличии донора. При невозможности ее проведения в качестве альтернативного лечения назначается гидроксимочевина, курсы малых доз цитарабина, курсы полихимиотерапии, интерферонотерапия при возможности начинать следует с понатиниба или омацетаксина. Препаратом, при применении которого показана возможность получения цитогенетических и молекулярных ремиссий у пациентов с ХМЛ с мутацией T315I, является недавно одобренный к применению в США понатиниб [21], однако в настоящее время препарат не доступен в Казахстане (нет регистрации).
В зависимости от степени подавления опухолевого клона выделяют различные варианты ответа (уровень доказательности А) [20]. Эффект терапии первой линии может быть расценен как оптимальный ответ, предупреждение и неудача (УД – А).
Варианты ответа на терапию при хроническом миелолейкозе.
Таблица 9.
| Вариант ответа | Определение | |
| Гематологический | ||
| Полный | Лейкоциты | |
| Цитогенетический | ||
| Полный* Частичный** Малый Минимальный Отсутствие ответа |
Ph-хромосома в метафазах не определяется Ph-хромосома в 1–35 % метафаз Ph-хромосома в 36–65 % метафаз Ph-хромосома в 66–95 % метафаз Ph-хромосома в > 95 % метафаз |
|
| Молекулярный*** | ||
| Большой (МО3.0) | Соотношение BCR-ABL1/ABL ≤ 0,1 и > 0,01 % по шкале IS | |
| Глубокий | МО4.0 | |
| МО 4 | МО 4.5 | МО 5 |
| Минимальная сумма эталонных транскриптов гена независимо от того, обнаружен ли BCR-ABL1 или нет 1 |
уровень BCR-ABL1 для положительных образцов 2
1Количество транскриптов референсного гена в том же объеме кДНК, который тестируется на BCR / ABL1. Минимальное количество в каждом отдельном экземпляре должно быть 10 000 ABL1 или 24000 GUSB
2Минимальные референсные генные копии в строке выше выполнены
Рекомендации по оценке ответа в хронической фазе ХМЛ в зависимости от длительности и характера ответа на предшествующую терапию ИТК в первой линии [21].
Таблица 11.
терапии
аномалии в клетках Ph+
Ph+ ≤ 35 % (ЧЦО)
BCR-ABL1
Факторы риска неудачи:
Ph+ > 65 % (менее МЦО) и BCR-ABL1 ≥ 10 %*
BCR-ABL1
BCR-ABL1 1–10 %
BCR-ABL1 ≥ 10 %
BCR-ABL1 ≤ 0,1 % (БМО)
BCR-ABL1 0,1–1,0 %
BCR-ABL1 ≥ 1 %
Мутации BCR-ABL1
ДХА в клетках Ph+
ДХА — дополнительные хромосомные аномалии; МЦО — малый цитогенетический ответ; ЧЦО — частичный цитогенетический ответ.
* При выполнении только молекулярного анализа рекомендуется повторное исследование в течение 1–2 мес. для подтверждения результата.
** Подтвержденная потеря БМО (уровень BCR-ABL1 > 0,1 % в двух и более последовательных анализах, в одном из которых BCR-ABL1 > 1 %).
Эффект терапии первой линии может быть расценены как оптимальный, неудача терапии, предупреждение (УД – А) [20].
Оптимальный ответ свидетельствует о благоприятном прогнозе, ожидаемой высокой безрецидивной выживаемости и возможности достичь более глубокого ответа вплоть до выздоровления. При оптимальном ответе продолжают лечение тем же препаратом ИТК.
Предупреждение указывает на необходимость тщательного мониторинга и готовность к смене терапии с учетом биологических признаков более агрессивного течения с анализом результатов мутационного статуса.
Неудача терапии служит показанием к смене препарата на следующую линию препарата ИТК. Потеря достигнутой ранее ремиссии, новые мутации, появление ДХА в Ph-позитивных клетках при терапии ИТК также свидетельствуют о неудаче лечения. При констатации неудачи терапии необходимо подтверждение приверженности пациента к ней и возможного лекарственного взаимодействия, целесообразен анализ на мутации BCR-ABL1.
Перечень основных лекарственных средств (имеющих 100% вероятность применения):
Таблица 12
| Фармакотерапевтическая группа | МНН ЛС | Способ применения | Уровень доказательности |
| Антинеопластические и иммуносупрессивные лекарственные средства | Иматиниб | Внутрь | A |
| Нилотиниб | Внутрь | A | |
| Дазатиниб | Внутрь | A | |
| Гидроксимочевина | Внутрь | В |
| Фармакотерапевтическая группа | МНН ЛС | Способ применения | Уровень доказательности |
| Лекарственные средства, ослабляющие токсическое действие противоопухолевых препаратов | Аллопуринол | Внутрь | — |
| Антибактериальные средства | Офлоксацин | Внутривенное введение | С |
| Метронидазол | Внутривенное введение Внутрь |
А | |
| Левофлоксацин | Внутривенное введение Внутрь |
— | |
| Ципрофлоксацин | Внутривенное введение Внутрь |
С | |
| Сульфаметоксазол /триметоприм |
Внутривенное введение Внутрь |
А | |
| Противогрибковые лекарственные средства | Вориконазол | Внутривенное введение Внутрь |
В |
| Итраконазол | Внутрь | В | |
| Флуконазол | Внутривенное введение Внутрь |
С | |
| Позаконазол | Внутрь | В | |
| Противовирусные лекарственные средства | Ацикловир | Внутривенное введение Внутрь |
А |
| Лекарственные средства, влияющие на свертывающую систему крови | Надропарин | Подкожное введение | С |
| Эноксапарин | Подкожное введение | С | |
| Другие лекарственные средства | Бупивакаин, Лидокаин, Прокаин | Местное применение | D |
| Омепразол | Внутривенное введение Внутрь |
А | |
| Фамотидин | Внутривенное введение | А | |
| Амлодипин | Внутрь | В | |
| Каптоприл | Внутрь | В | |
| Лизиноприл | Внутрь | В | |
| Лактулоза | Внутрь | В | |
| Спиронолактон | Внутрь | В | |
| Повидон – йод | Наружное применение | — | |
| Тобрамицин | Внутривенное введение | — | |
| Торасемид | Внутрь | — | |
| Фолиевая кислота | Внутрь | — | |
| Фуросемид | Внутривенное введение Внутрь |
А | |
| Хлоргексидин | Наружное применение | — |
Хирургическое вмешательство: нет.
Дальнейшее введение: перспективой лечения ХМЛ представляется переход от пожизненного приема ИТК к возможности прекращения терапии под динамическим наблюдением. В связи с этим одной из задач терапии ХМЛ можно считать получение глубоких молекулярных ответов (М04 и М04.5). Такая стратегия вполне обоснована, учитывая ожидаемую долгую продолжительность жизни больных ХМЛ и многолетний прием лекарственных средств.
Индикаторы эффективности лечения: см. таб. 8,9.
Лечение (стационар)
ТАКТИКА ЛЕЧЕНИЯ НА СТАЦИОНАРНОМ УРОВНЕ [21,22,24,25]
Рекомендации по лечению ХМЛ
| Фаза акселерации | ||
| 2-я другая линия | Отсутствие ответа | Нилотиниб или Дазатиниб Обсудить аллоТКМ |
| Бластный криз | ||
| Лимфоидный вариант | Терапия по программе лечения Ph+ ОЛЛ Дазатиниб 140 мг/сут как этап подготовки к алло-ТГСК Алло-ТГСК (если достигнута 2-я хроническая фаза) с последующим продолжением ИТК (выбор ИТК в зависимости от предшествующего лечения, переносимости, мутационного анализа). Паллиативная терапия. |
|
| Миелоидный вариант | Терапия по программе лечения ОМЛ Дазатиниб 140 мг/сут как этап подготовки к алло-ТГСК с последующим продолжением ИТК (выбор ИТК в зависимости от предшествующего лечения, переносимости, мутационного анализа). Паллиативная терапия. |
|
| Мутация | Рекомендации по лечению |
| Y253H, E255K / V или F359V/C/I | Дазатиниб |
| F317L / V / I / C, T315A или V299L | Нилотиниб |
| E255K / V, F317L / V / I / C, F359V / C / I, T315A или Y253H | Бозутиниб |
| T315I | Понатиниб, Омацетаксин, аллогенная ТКМ или клиническое испытание |
Для оценки эффективности терапии необходимо проводить своевременный мониторинг гематологических, цитогенетических и молекулярно-генетических показателей (таб.5)
При выявлении мутации T315I показано прекращение терапии ИТК, рекомендуется проведение HLA- типирования и выполнения аллоТКМ при наличии донора. При невозможности ее проведения в качестве альтернативного лечения назначается гидроксимочевина, курсы малых доз цитарабина, курсы полихимиотерапии, интерферонотерапия при возможности начинать следует с понатиниба или омацетаксина [21].
В зависимости от степени подавления опухолевого клона выделяют различные варианты ответа (УД – А) [22]. Эффект терапии первой линии может быть расценен как оптимальный ответ, предупреждение и неудача (УД – А).
Перечень основных лекарственных средств (имеющих 100% вероятность применения):
Таблица 12.
| Фармакотерапевтическая группа | МНН ЛС | Способ применения | Уровень доказательности |
| Антинеопластические и иммуносупрессивные лекарственные средства | Иматиниб | Внутрь | A |
| Нилотиниб | Внутрь | A | |
| Дазатиниб | Внутрь | A | |
| Гидроксимочевина | Внутрь | В |
| Фармакотерапевтическая группа | МНН ЛС | Способ применения | Уровень доказательности |
| Лекарственные средства, ослабляющие токсическое действие противоопухолевых препаратов | Аллопуринол | Внутрь | — |
| Антибактериальные средства | Офлоксацин | Внутривенное введение | С |
| Метронидазол | Внутривенное введение Внутрь |
А | |
| Левофлоксацин | Внутривенное введение Внутрь |
— | |
| Ципрофлоксацин | Внутривенное введение Внутрь |
С | |
| Сульфаметоксазол /триметоприм |
Внутривенное введение Внутрь |
А | |
| Противогрибковые лекарственные средства | Вориконазол | Внутривенное введение Внутрь |
В |
| Итраконазол | Внутрь | В | |
| Флуконазол | Внутривенное введение Внутрь |
С | |
| Позаконазол | Внутрь | В | |
| Противовирусные лекарственные средства | Ацикловир | Внутривенное введение Внутрь |
А |
| Лекарственные средства, влияющие на свертывающую систему крови | Надропарин | Подкожное введение | С |
| Эноксапарин | Подкожное введение | С | |
| Другие лекарственные средства | Бупивакаин, Лидокаин, Прокаин | Местное применение | D |
| Омепразол | Внутривенное введение Внутрь |
А | |
| Фамотидин | Внутривенное введение | А | |
| Амлодипин | Внутрь | В | |
| Каптоприл | Внутрь | В | |
| Лизиноприл | Внутрь | В | |
| Лактулоза | Внутрь | В | |
| Спиронолактон | Внутрь | В | |
| Повидон – йод | Наружное применение | — | |
| Тобрамицин | Внутривенное введение | — | |
| Торасемид | Внутрь | — | |
| Фолиевая кислота | Внутрь | — | |
| Фуросемид | Внутривенное введение Внутрь |
А | |
| Хлоргексидин | Наружное применение | — |
Тактика проведения аллоТКМ при ХМЛ.
Таблица 14.
| Фаза ХМЛ | Клиническая ситуация | Линия ИТК | HLA- типирование доноров | Проведение аллоТКМ |
| Хроническая фаза | Неудача ИТК-1 Имматинибом, высокий риск | Вторая линия ИТК | Да | Нет |
| Неудача терапией Нилотинибом или Дазатинибом | Вторая линия ИТК | Да | Да | |
| Неудача 2-х линий ИТК | Третья линия ИТК | Да | Да | |
| Мутация Т315I | Понатиниб или Омацетаксин | Да | Да | |
| Фаза акселерации | ИТК1 | Вторая линия ИТК ± химиотерапия | Да | Да |
| ИТК 1, без достижения оптимального ответа | Вторая линия ИТК ± химиотерапия | Да | Да | |
| Предлеченность ИТК | Вторая линия ИТК ± химиотерапия | Да | Да | |
| Бластный криз | ИТК1 или предлеченность | Индукционная ХТ + ИТК | Да | Да |
Особенности лечения у беременных.
Основная цель — предотвратить прогрессирование заболевания у матери при минимизации воздействия проводимой терапии на плод.
Учитывая, что до 15-й недели беременности превалирует риск развития внутриутробных аномалий при применении ИТК, до этого срока предусмотрено наблюдение без терапии. Применение ИТК должно быть исключено в I триместре в период органогенеза в связи с тератогенным риском. При этом возможны зачатие на фоне приема ИТК и ранняя отмена ИТК сразу же после подтверждения беременности. После 15 нед. беременности органогенез в основном завершен, плацентарный барьер ограничивает воздействие препаратов на плод. При быстром нарастании уровня BCR-ABL1 следует обсудить вопрос о целесообразности начала терапии.
Планирование беременности у женщин с ХФ ХМЛ целесообразно после терапии длительностью 3 года и более при полной клинико-гематологической ремиссии и подтверждении стабильного глубокого МО (МО4–МО4.5) в течение минимум 2 лет наблюдения.
У женщин с ФА ХМЛ в дебюте заболевания, полной клинико-гематологической ремиссией и стабильным глубоким МО длительностью 3 года и более во время терапии планирование беременности возможно с осторожностью, т. к. нет данных по прерыванию терапии ИТК и безопасному наблюдению без лечения при ФА ХМЛ; данный подход является спорным. При бластном кризе (БК) ХМЛ планирование беременности нецелесообразно, учитывая ожидаемую низкую выживаемость, необходимость проведения курсов химиотерапии в сочетании с ИТК или трансплантации аллогенных гемопоэтических стволовых клеток после достижения ремиссии заболевания.
Диагностированный на ранних сроках беременности БК ХМЛ считается показанием к прерыванию беременности, на поздних сроках беременности это показание к досрочному родоразрешению и немедленному началу терапии.
До получения стабильного глубокого МО всем пациенткам, получающим ИТК, рекомендована контрацепция.
Отсутствие воздействия ИТК в период органогенеза в I триместре — наиболее важный фактор благоприятного исхода беременности.
После 15 нед. беременности, в период, когда уже сформирован плацентарный барьер, ограничивающий проникновение препаратов к плоду, возобновление терапии ИТК целесообразно при значительной опухолевой массе с целью предупредить прогрессирование заболевания.
Уровень BCR/ABL1 > 1 % (потеря МО2) считается оптимальным показанием к возобновлению приема ИТК в интересах матери, поскольку при таком объеме опухолевой массы, соответствующем потере полного цитогенетического ответа, возрастает риск развития гематологического рецидива и появления резистентных клонов. Потеря гематологической ремиссии во время беременности служит показанием к терапии ИТК.
Трансфузионная поддержка.
Показания к проведению трансфузионной терапии определяются в первую очередь клиническими проявлениями индивидуально для каждого пациента с учетом возраста, сопутствующих заболеваний, переносимости химиотерапии и развития осложнений на предыдущих этапах лечения.
Лабораторные показатели для определения показаний имеют вспомогательное значение, в основном для оценки необходимости профилактичесиких трансфузий концентрата тромбоцитов.
Показания к трансфузиям также зависят от времени, после проведения курса химиотерапии – принимаются во внимание, прогнозируемое снижение показателей в ближайшие несколько дней (в фазе бластного криза).
| | Возраст (лет) | | Триггерный уровень Hb (г/л) |
| | | 35-45 | |
| | 25-50 | | 40-50 |
| | 50-70 | | 55 |
| | >70 | | 60 |
Хирургическое вмешательство: при развитии инфекционных осложнений пациентам могут также проводиться вмешательства, направленные на дренирование/устранение инфекционного очага.
Дальнейшее ведение см. Амбулаторный уровень.
Индикаторы эффективности лечения: см. Амбулаторный уровень.
Госпитализация
ПОКАЗАНИЯ ДЛЯ ГОСПИТАЛИЗАЦИИ С УКАЗАНИЕМ ТИПА ГОСПИТАЛИЗАЦИИ
Показания для плановой госпитализации: