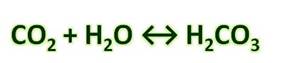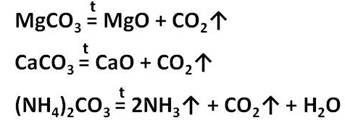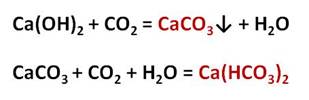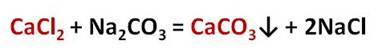карбонаты это соли какой кислоты
Что такое карбонаты
Карбонаты (минералы)
Карбонаты — многочисленная группа минералов, которые имеют широкое распространение. К минералам класса карбонатов относятся соли угольной кислоты, чаще всего это соли кальция, магния, натрия, меди. Всего в этом классе известно около 100 минералов. Некоторые из них очень широко распространены в природе, например кальцит и доломит.
В структурном отношении все карбонаты относятся к одному основному типу — анионы [CO3]2-представляют собой изолированные радикалы в форме плоских треугольников.
Большинство карбонатов безводные простые соединения, главным образом Ca, Mg и Fe с комплексным анионом [CO3]2-.
Менее распространены сложные карбонаты, содержащие добавочные анионы (OH)-, F-и Cl-.
Карбонаты природные
Среди наиболее распространённых безводных карбонатов различают карбонаты тригональной и ромбической сингоний. Карбонаты обычно имеют светлую окраску: белую, розовую, серую и т.д., исключение представляют карбонаты меди, имеющие зелёную или синюю окраску. Твёрдость карбонатов около 3-4.5; плотность невелика, за исключением карбонатов Zn, Pb и Ba.
Важным диагностическим признаком является действие на карбонаты кислот (HCl и HNO3), от которых они в той или иной степени вскипают с выделением углекислого газа.
По происхождению карбонаты осадочные (биохимические или химические осадки) или осадочно-метаморфические минералы; выделяются также поверхностные, характерные для зоны окисления и иногда низкотемпературные гидротермальные карбонаты.
Главные минералы-карбонаты
| Группа | Минерал | Сингония | Твердость |
| Кальцита | Кальцит СаСОз | Триг. | 3 |
| Родохрозит МпСОз | 3,5-4,5 | ||
| Магнезит MgCOз | 4-4,5 | ||
| Сидерит РеСОз | » | 3,5-4,5 | |
| Смитсонит ZnCO3 | 5 | ||
| Доломита | Доломит CaMg(COз)2 | » | 3,5-4 |
| Арагонита | Арагонит СаСОз | Ромб. | 3,5-4 |
| Витерит ВаСОз | 3 — 3,5 | ||
| Стронцианит SrCO3 | 3,5-4 | ||
| Церуссит · 10H2O | Мон. | — | |
| Нахколит NaHCO3 | » | 2,5 | |
| Натрон | 1 — 1,5 | ||
| Шортита | Шортит | Ромб. | 3 |
| Ниеререита | НиеререитNa2Ca(CO3)2 | » | 3 |
Многие из широко распространенных карбонатов, в особенности же кальцит, магнезит, сидерит, доломит, имеют сходные черты морфологии кристаллов, близкие физические свойства, встречаются в одинаковых агрегатах и часто имеют переменный химический состав.
Поэтому бывает трудно, а порой невозможно различить их по внешним признакам, твердости, спайности. Издавна используется простой прием диагностики карбонатов по характеру их реакции с соляной кислотой.
Для этого наносят каплю разбавленной (1 : 10) кислоты на зерно карбоната.
Кальцит реагирует активно, и капля раствора вскипает от выделяющихся пузырьков СО2, доломит реагирует слабо, только в порошке, а магнезит — при нагревании.
Более надежные результаты дают следующие лабораторные исследования: точное определение их показателей преломления; проведение микрохимических реакций на отполированных пластинках пород с реактивами, красящими разные минералы в различные цвета; термический анализ (определение температуры разложения минерала, у каждого карбоната она своя); рентгеновские исследования.

Карбонатовые отложения
Самым распространённым карбонатом является кальцит.
Прозрачный кальцит называют исландским шпатом, непрозрачный известковым шпатом. Кальцит формирует такие породы, как известняк и мел.
Подавляющее количество кальцита сформировалось за счёт биогенного его накопления. В то же время известен и кальцит гидротермального происхождения. В почвах кальцит накапливается в результате реакции кальция, высвободившегося при выветривании, с углекислым газом почвенного воздуха; особенно часто богаты кальцитом почвы засушливых областей. Кальцит и доломит формируют мрамор.
Сидерит типичный минерал болотных руд; достаточно редко отмечается его эндогенное происхождение. Малахит красивый поделочный камень; как и близкий к нему по составу и свойствам минерал азурит Сu3(СО3)2(ОН)2, он образуется на поверхности Земли в результате окисления сульфидов меди.
Применение карбонатов
Карбонаты кальция, магния, бария и др. применяют в строительном деле, в химической промышленности, оптике и др. В технике, промышленности и быту широко применяется сода (Na2CO3 и NaHCO3): при производстве стекла, мыла, бумаги, как моющее средство, при заправке огнетушителей, в кондитерском деле.
Кислые карбонаты выполняют важную физиологическую роль, являясь буферными веществами, регулирующими постоянство реакции крови.
Класс карбонатов
Карбонатами называются соли угольной кислоты (Н2СО3). Класс карбонатов насчитывает около 80 представителей.
Эти минералы очень широко распространены в верхней части литосферы. Их среднее содержание в земной коре составляет 1,5 мае. %.
Кальцит СаСО3, или известковый шпат. Название произошло от латинского calcis — известь. Содержит примеси Мg, Мn, Fе, иногда Zn, Cо, Sг, Рb и др. Водяно-прозрачная, бесцветная разновидность кальцита с сильным двупреломлением называется исландский шпат, или оптический кальцит.
Полосчатые выделения кальцита называют кальцитовым, или мраморным, ониксом.
Форма выделения — кристаллы призматической, таблитчатой, реже пластинчатой, иногда дисковидной формы, ромбоэдры и скаленоэдры.
Могут образовывать двойники, щетки, друзы. Агрегаты зернистые, а также в виде мелко- и скрытокристаллических натечных форм — корок, почек, желваков, сталактитов, сталагмитов и т.д., могут образовывать конкреции и оолиты, секреции и миндалины.
Цвет — чаще всего белый и желтовато-белый, но в зависимости от примесей может быть разных цветов, вплоть до черного (от примеси битума).
Черта — белая, светлая.
Блеск — стеклянный, более яркий на поверхностях спайности, чем на гранях.
Прозрачность — минерал от прозрачного (исландский шпат) до просвечивающего по тонкому краю.
Спайность — совершенная в трех направлениях по ромбоэдру.
Излом — как правило, по спайности, ровный, ступенчатый.
Плотность — 2,6 — 2,8 г/см3.
Особые свойства — бурно реагирует с соляной кислотой.
1. Осадочное, биогенное и хемогенное, главным образом в виде известняков, мергеля и мела. 2. Гидротермальное, в жилах.
3. Магматическое, в карбонатитах. 4. Контактово-метаморфическое, в скарнах. Кальцитовые породы, известняки, мел и мергели широко развиты в пределах Русской плиты, особенно в Центральных районах России, месторождения мрамора известны на Урале, исландский шпат добывается в бассейне реки Нижняя Тунгуска.
Применение — как сырье для производства строительного камня, извести, цемента; метаморфически измененные известняки — мраморы — прекрасный облицовочный материал; в металлургической промышленности в качестве флюсов; в химической промышленности для производства соды; в сельском хозяйстве для известкования почв; исландский шпат используют в оптических приборах; выделения кальцита с красивым оттенком или рисунком применяется в ювелирном и камнерезном деле.
Доломит СаМg(СO3)2.Назван в честь французского инженера и минералога Доломье (1750—1801), впервые описавшего доломитовые отложения.
Часто содержит примесь двухвалентного Fе, Мg, Мn.
Форма выделения — чаще всего пористые землистые массы, реже почковидные, оолитовые агрегаты. Также встречается в виде кристаллических зернистых агрегатов.
Цвет — в землистых массах обычно грязно-белый, желтоватый и буроватый.
В кристаллических агрегатах — серовато-белый, голубовато-белый, реже с зеленоватым оттенком.
Черта — белая, светло-желтая или светло-серая.
Блеск — стеклянный по граням кристаллов.
В землистом агрегате матовый.
Прозрачность — минерал от просвечивающегося до непрозрачного.
Спайность — совершенная по ромбоэдру.
Излом — обычно по спайности, косо ступенчатый.
Плотность — 2,8 — 2,9 г/см3.
Особые свойства — с соляной кислотой реагирует в порошке.
Реакция не бурная, что служит основным отличием от кальцита.
Происхождение. 1. В основном осадочное.
2. Может быть гидротермальным, в жилах, и гидротермально-метасоматическим за счет преобразования известняков. Широко распространен на Русской платформе, Урале, Сибири.
Применение — для производства строительных материалов, цемента, огнеупорных изделий; как флюс в металлургии, в химической промышленности и сельском хозяйстве.
Магнезит МgСО3, магнезитовый шпат, горький шпат.
Назван по области Магнезиа в Фессалии (Греция). Содержит примесь двухвалентного железа и никеля.
Форма выделения — кристаллы ромбоэдрические, редко призматические.
Встречается в виде кристаллических зернистых агрегатов и скрытокристаллических фарфоровидных масс.
Черта — белая, бесцветная.
Прозрачность — прозрачный по тонкому краю, непрозрачный минерал.
Спайность — совершенная в трех направлениях по ромбоэдру.
Излом — по спайности ступенчатый. У фарфоровидных выделений излом раковистый, неровный.
У фарфоровидного до 7 за счет примеси опала.
Особые свойства — в соляной кислоте разлагается только в порошке и при нагревании.
Происхождение — эндогенное, гидротермальное, гидротермально-матасоматическое и экзогенное, при изменении богатых магнием ультраосновных пород.
Крупнейшие в России месторождения — Саткинское вблизи города Златоуст на Урале и Савинское в Иркутской области.
Применение — для производства различных огнеупоров, магнезиального цемента; в металлургии, химической и фармацевтической промышленности, а также при производстве керамики и бумаги.
Сидерит FеСО3, железный шпат.
Название произошло от греческого sideros — железо. Часто содержит примеси Мn, Мg, Са.
Форма выделения — кристаллы в виде уплощенных ромбоэдров. Грани кристаллов часто линзовидно изогнуты. Реже встречаются таблитчатые и призматические кристаллы.
Агрегаты зернистые, землистые, плотные, иногда слагают шаровидные конкреции (сферосидерит).
Цвет — от светло-желтого до бурого, коричневого и черного.
Черта — бесцветная. У измененных (лимонитизированных) выделений — бурая, ржаво-бурая.
Блеск — сильный стеклянный, иногда с буроватой побежалостью.
Прозрачность — от просвечивающего по краю до непрозрачного.
Спайность — совершенная по ромбоэдру.
Излом — ступенчатый по спайности, зернистый.
Плотность — 3,7 — 3,9 г/см3.
Особые свойства — растворяется в подогретой соляной кислоте, кислота при этом желтеет.
1. Гидротермальное, в жилах и линзах вместе с сульфидами полиметаллов; гидротермально-метасоматическое при замещении известняков и доломитов (Байкальское месторождение на Южном Урале). 2. Осадочным путем, слои и линзы, конкреционные и оолитовые выделения. 3. Метаморфическое — при метаморфизме месторождений магнетитовых и силикатных железных руд.
Применение — как важная руда на железо для производства мягких сортов стали.
Карбонат-ион
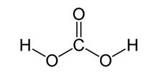
Карбонат-ион является анионом угольной кислоты. Эта кислота в свободном состоянии неизвестна, так как почти полностью распадается на С02 и воду. Угольная кислота очень слабая кислота и ее соли щелочных металлов в значительной степени подвергаются гидролизу.
1. Хлорид бария ВаС12 из растворов карбонатов осаждает на холоду белый осадок карбоната бария:
ВаС12 + Na2C03 = BaC03J + 2NaCI, Ва2+ + СО§- = BaC03|.
Осадок легко растворим в разбавленных соляной и азотной кислотах и в уксусной кислоте.
При кипячении или при стоянии он становится кристаллическим и значительно более плотным.
К 5 каплям раствора карбоната натрия добавляют раствор хлорида бария и наблюдают растворение осадка в разбавленных кислотах.
2. Кислоты разлагают все карбонаты с бурным выделением диоксида углерода:
Na2C03 + 2НС1 == 2NaCl + C02f + Н20.
Эта реакция очень характерна для карбонатов, так как выделение S02 при разложении сульфитов кислотами протекает не так бурно.
Выполнение реакции. К 2 каплям раствора Na2C03 прибавляют по каплям разбавленную соляную или какую либо другую кислоту.
Наблюдают бурное выделение газа.
3. Нитрат серебра AgN03 из растворов карбонатов
осаждает карбонат серебра — осадок белого цвета.
2AgN03 + Na2C03 = Ag2C03J + 2NaN03, 2Ag+ + CO!- = Ag2C03|.
Карбонат серебра легко растворим в разбавленной азотной кислоте и растворе аммиака вследствие реакции комплексообразования.
При растворении в кислоте наблюдается интенсивное выделение диоксида углерода.
При нагревании происходит почти полный гидролиз карбоната серебра:
В осадке остается оксид серебра (грязно-коричневого цвета).
К 5 каплям раствора карбоната натрия Na2C03 прибавляют 5 капель раствора нитрата серебра AgN03. Полученный раствор с осадком делят на три части и наблюдают характер растворения осадка в аммиаке и разбавленной HN03, а также гидролиз осадка при нагревании.
Карбонаты
В случае необходимости обсуждения целесообразности объединения, замените этот шаблон на шаблон <<к объединению>> и добавьте соответствующую запись на странице ВП:КОБ.
Карбона́ты и ги́дрокарбонаты — соли и эфиры угольной кислоты (H2CO3). Среди солей известны нормальные карбонаты (с анионом СО3 2− ) и кислые или гидрокарбонаты (с анионом НСО3 − ).
Содержание
Растворимость
Из нормальных карбонатов в воде растворимы только соли щелочных металлов, аммония и таллия. Вследствие гидролиза растворы их показывают щелочную реакцию. Малорастворимы нормальные карбонаты кальция, бария, стронция и свинца. Все кислые карбонаты хорошо растворимы в воде; кислые карбонаты сильных щелочей также имеют слабощелочную реакцию.
Химические свойства
Распространение в природе
Нормальные карбонаты широко распространены в природе, например: кальцит СаСО3, доломит CaMg(CO3)2, магнезит MgCO3, сидерит FeCO3, витерит ВаСО3, баритокальцит BaCa(CO3)2 и др. Существуют и минералы, представляющие собой основные карбонаты, например, малахит CuCO3·Cu(ОН)2.
Гидрокарбонаты натрия, кальция и магния встречаются в растворённом виде в минеральных водах, а также, в небольшой концентрации, во всех природных водах, кроме атмосферных осадков и ледников. Гидрокарбонаты кальция и магния обуславливают так называемую временную жёсткость воды. При сильном нагревании воды (выше 60 °C) гидрокарбонаты кальция и магния разлагаются на углекислый газ и малорастворимые карбонаты, которые выпадают в осадок на нагревательных элементах, дне и стенках посуды, внутренних поверхностях баков, бойлеров, труб, запорной арматуры и т. д., образуя накипь.
Применение
Карбонаты кальция, магния, бария и др. применяют в строительном деле, в химической промышленности, оптике и др. В технике, промышленности и быту широко применяется сода (Na2CO3 и NaHCO3): при производстве стекла, мыла, бумаги, как моющее средство, при заправке огнетушителей, в кондитерском деле. Кислые карбонаты выполняют важную физиологическую роль, являясь буферными веществами, регулирующими постоянство реакции крови.
Карбонаты органические
Литература
Примечания
См. также
Полезное
Смотреть что такое «Карбонаты» в других словарях:
КАРБОНАТЫ — соли и эфиры угольной кислоты Н2СО3. Различают нормальные (средние) соли с анионом CO32 (напр., К2СО3) и кислые (гидрокарбонаты) с анионом НСО3 (напр., КНСО3). Природные карбонаты нормальные соли. Из синтетических карбонатов в технике широко… … Большой Энциклопедический словарь
КАРБОНАТЫ — [от лат. carbo (carbonis) уголь], класс минералов (около 80), природные соли угольной кислоты (Н2СО3); слагают штольни осадочных (известняки, доломиты и др.) и метаморфич. (мраморы) пород. Широко распространены в коре выветривания в зоне… … Экологический словарь
Карбонаты — – соли угольной кислоты. В строительной практике широко используются карбонаты кальция и магния (СаCO3, MgCO3 ). [Пантилеенко, В. Н. Строительные материалы [Текст] : учеб. пособие / В. Н. Пантилеенко, Л. А. Ерохина, Е. М. Веряскина. – 2 е изд.,… … Энциклопедия терминов, определений и пояснений строительных материалов
КАРБОНАТЫ — КАРБОНАТЫ, соли угольной кислоты H2CO3. Широко распространены в виде минералов (известно свыше 120), играют большую роль в круговороте углекислого газа CO2 в природе. Смотри, например, Кальция карбонат … Современная энциклопедия
КАРБОНАТЫ — КАРБОНАТЫ, соли УГЛЕКИСЛОТЫ (Н2СО3), образующиеся при растворении диоксида углерода (углекислого газа, СО2) в воде, например, при выпадении дождя. Углекислота является очень слабой кислотой, и она сама, и многие ее соли неустойчивы и легко… … Научно-технический энциклопедический словарь
карбонаты — Соли угольной кислоты Н2СО3: норм. к. с анионом С032 (напр., KjCO.,), кислые к. с анионом НСО3 (напр., КНСО3) и осн. к. (напр., Сu2(ОН)2СО3 — минерал малахит). Нек рые природные, нормальные и осн. к. — весьма ценные металлич. руды: к … Справочник технического переводчика
карбонаты — – соли угольной кислоты. Словарь по аналитической химии [3] … Химические термины
Карбонаты — КАРБОНАТЫ, соли угольной кислоты H2CO3. Широко распространены в виде минералов (известно свыше 120), играют большую роль в круговороте углекислого газа CO2 в природе. Смотри, например, Кальция карбонат. … Иллюстрированный энциклопедический словарь
Карбонаты — [carbonates] соли угольной кислоты H2СO3: нормальные карбонаты с анионом СО32 (например, K2CO3,), кислые карбонаты с анионом НCO3 (например, КНСO3) и основные карбонаты (например, Cu2(ОН)2CO3 минерал малахит). Некоторые природные, нормальные и… … Энциклопедический словарь по металлургии
Угольная кислота. Карбонаты. Жёсткость воды
Урок 27. Химия 9 класс ФГОС
В данный момент вы не можете посмотреть или раздать видеоурок ученикам
Чтобы получить доступ к этому и другим видеоурокам комплекта, вам нужно добавить его в личный кабинет, приобрев в каталоге.
Получите невероятные возможности
Конспект урока «Угольная кислота. Карбонаты. Жёсткость воды»
Угольная кислота. Карбонаты. Жёсткость воды
Угольная кислота образуется при растворении оксида углерода (IV) в воде. Эта кислота нестойкая и почти сразу распадается на исходные вещества – углекислый газ и воду.
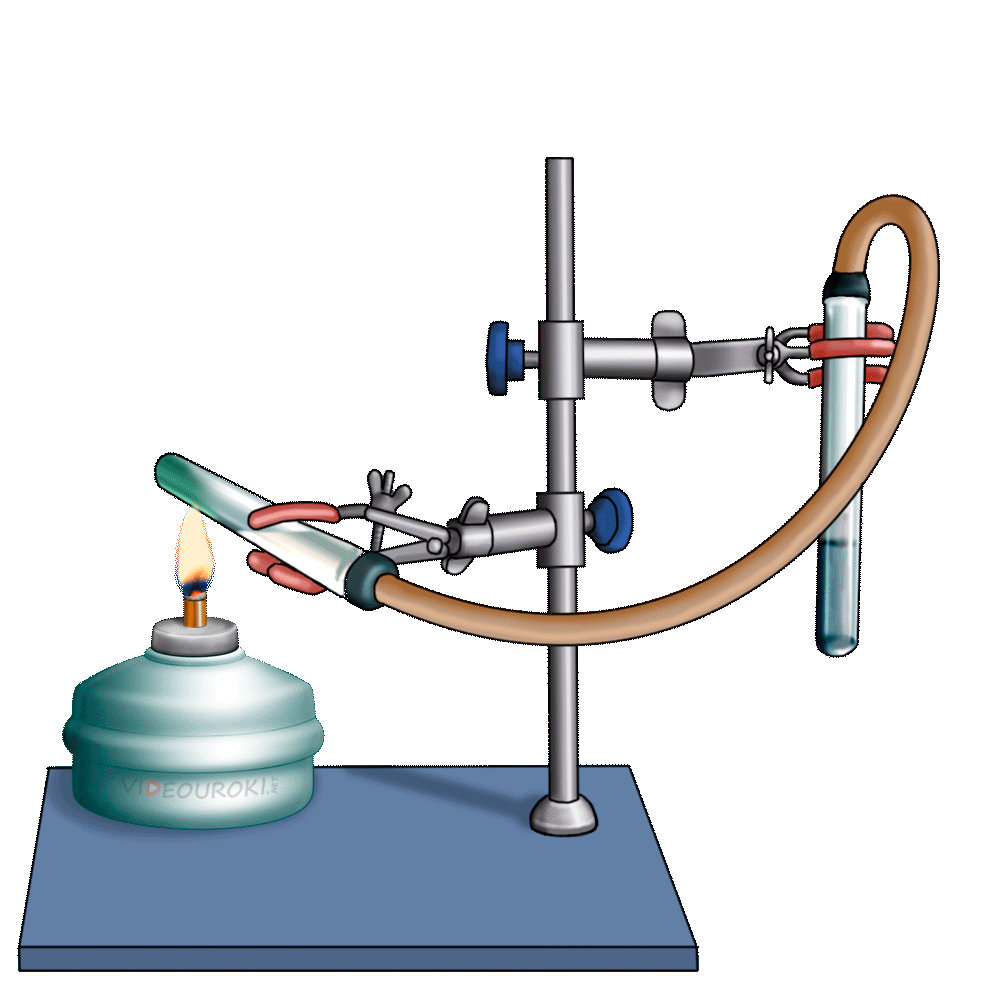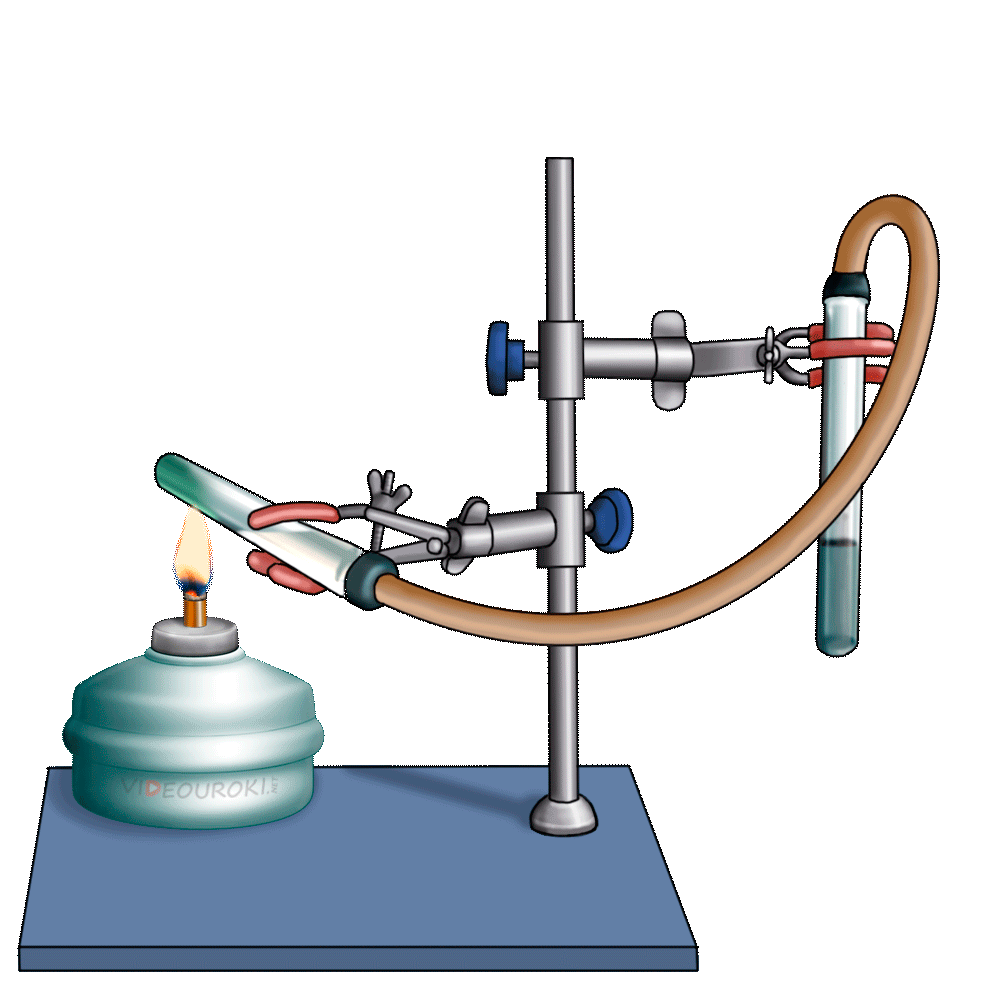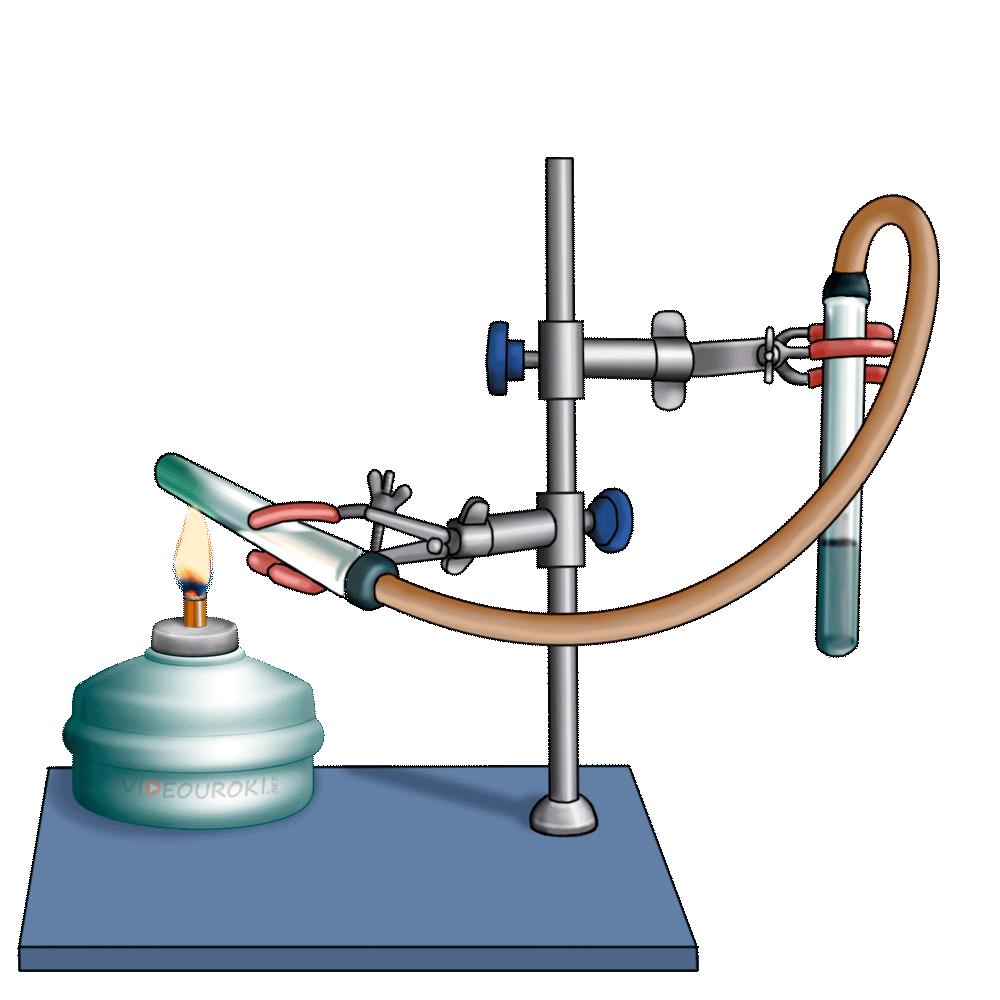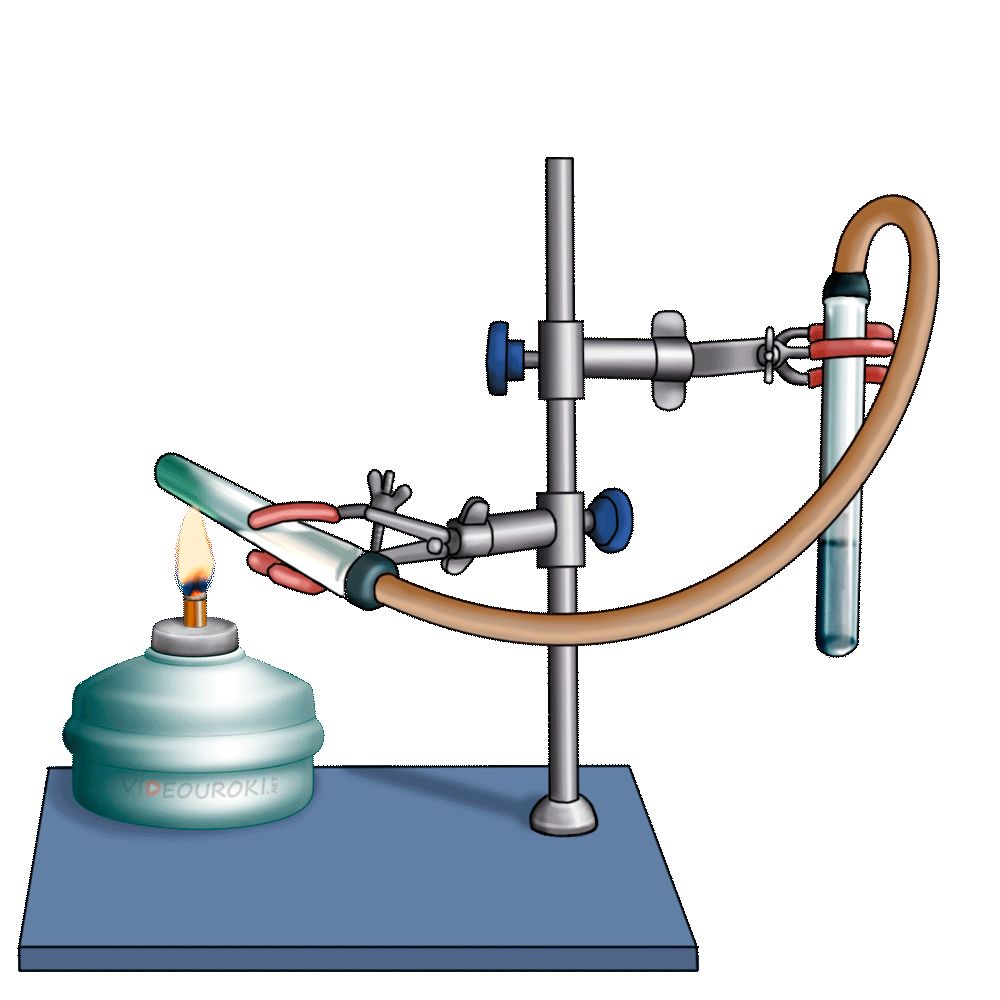
Получим угольную кислоту и исследуем её свойства. Собрав прибор для получения газов и проверив его на герметичность, следует поместить в пробирку кусочки мрамора и прилить соляной кислоты. После чего мы можем наблюдать выделение газа, который следует пропустить через воду с лакмусом. При этом видно, что лакмус изменил окраску с фиолетовой на красную. Но через некоторое время лакмус опять меняет свою окраску с красной на фиолетовую, потому что образовавшаяся угольная кислота является нестойкой и через некоторое время распадается на исходные вещества – углекислый газ и воду.

Как двухосновная кислота угольная кислота диссоциирует по двум ступеням: на первой ступени образуется ион водорода и гидрокарбонат-ион, а на второй – ион водорода и карбонат-ион:
Угольная кислота образует два типа солей: средние – карбоната и кислые – гидрокарбонаты. Например, CaCO3 – карбонат кальция, Ca(HCO3)2 – гидрокарбонат кальция. Из карбонатов в воде растворимы только соли калия, натрия и аммония. Карбонаты других металлов нерастворимы в воде и при нагревании разлагаются на оксид металла и углекислый газ. При разложение карбоната магния образуется оксид магния и углекислый газ, а при разложении карбоната кальция образуется оксид кальция и углекислый газ. При нагревании карбоната аммония образуется аммиак, вода и углекислый газ.
Кислые соли растворимы в воде.
Карбонаты могут превращаться в гидрокарбонаты: если через них пропустить углекислый газ в присутствии воды. Например, если через известковую воду пропускать углекислый газ, то сначала известковая вода мутнеет, вследствие образования карбоната кальция, но при дальнейшем пропускании углекислого газа помутнение исчезает, потому что карбонат переходит в гидрокарбонат.
Наличием гидрокарбонатов кальция и магния в природной воде объясняется её временная жёсткость. В жёсткой воде плохо мылится мыло, трудно стирать бельё, плохо развариваются овощи. Если нагреть растворимый гидрокарбонат кальция, то образуется снова карбонат кальция – нерастворимая в воде соль.
Эта реакция приводит к образованию накипи на стенках котлов, чайников, труб парового отопления. В природе в результате этой реакции в пещерах формируются свисающие вниз сталактиты, навстречу которым снизу вырастают сталагмиты.


Другие соли кальция и магния, такие как хлориды и сульфаты, придают воде постоянную жёсткость. Для её устранения нужно использовать карбонат натрия – Na2CO3 – соду, которая переводит ионы кальция в осадок. Например, в реакции хлорида кальция с карбонатом натрия образуется нерастворимая соль – карбонат кальция и хлорид натрия. Таким образом, карбонат натрия перевёл растворимую соль кальция – хлорид кальция, в нерастворимую – карбонат кальция.
Соду можно использовать и для устранения временной жёсткости.
Качественными реакциями на карбонаты и гидрокарбонаты являются реакции этих солей с кислотами. Например, если в расвтор карбоната натрия добавить соляной кислоты, то происходит «вскипание» раствора, из-за образовавшегося углекислого газа. То же самое можно наблюдать при добавлении соляной кислоты к гидрокарбонату натрия.
Из солей угольной кислоты наиболее широко применяют кристаллическую соду – Na2CO3 ∙ 10H2O, кальцинированную соду – Na2CO3 – в стекольной, мыловаренной, целлюлозно-бумажной, текстильной, нефтеперерабатывающей и других отраслях промышленности, а в быту её используют как моющее средство.
Сода была известна человеку примерно за полторы – две тысячи лет до нашей эры, а может быть и раньше. Её добывали из содовых озёр и извлекали из месторождений. Первые сведения о получении соды путём упаривания воды озёр относятся к шестьдесят четвертому г н. э. и приведены в сочинениях древнеримского врача и ботаника Диоскорида Педания о лекарственных веществах.
Питьевая сода – NaHCO3 – применяется в медицине, хлебопечении, пищевой промышленности, питьевая сода входит в состав наполнителя для огнетушителей.
Карбонат калия, или поташ – K2CO3 – используют для получения мыла, в фотографии, в качестве удобрения, при изготовлении тугоплавкого стекла.
Известняк, или мрамор – CaCO3 – используют в строительстве как облицовочный и строительный материал. Он необходим для получения извести, его вносят в почву для понижения кислотности, мел необходим для побелки, а также в стекольной, резиновой и других областях промышленности.
Таким образом, угольная кислота – это двухосновная слабая неустойчивая кислота, которая образуется при растворении в воде углекислого газа, она диссоциирует по двум ступеням, поэтому образует два типа солей – карбонаты и гидрокарбонаты, карбонаты многих металлов нерастворимы в воде и при нагревании разлагаются, а гидрокарбонаты – это растворимые соли. Карбонаты можно перевести в гидрокарбонаты и наоборот. Для перевода карбоната в гидрокарбонат через карбонат пропускают углекислый газ в воде, а при нагревании гидрокарбонатов образуются карбонаты. Различают временную и постоянную жёсткость. Временная жёсткость обусловлена наличием гидрокарбонатов кальция и магния и устраняется кипячением, постоянная жёсткость обусловленая наличием других солей кальция и магния, и устраняется добавлением соды. Качественными реакциями на карбонат и гидрокарбонат-ион является действие кислот на эти соли, при этом наблюдается бурное выделение углекислого газа. Карбонаты и гидрокарбонаты многих металлов находят широкое применение во многих отраслях народного хозяйства.