карбонат кальция какая соль
Карбонат кальция, характеристика, свойства и получение, химические реакции
Карбонат кальция, характеристика, свойства и получение, химические реакции.
Карбонат кальция – неорганическое вещество, имеет химическую формулу СаСО3.
Краткая характеристика карбоната кальция:
Карбонат кальция – неорганическое вещество белого цвета.
Химическая формула карбоната кальция СаСО3.
Карбонат кальция при прокаливании разлагается. Однако при избыточном давлении углекислого газа (СО2) плавится без разложения.
Встречается в виде трех кристаллических модификаций:
– кальцита (известняк, мел, мрамор);
– фатерита или ватерита.
Кальцит и арагонит являются устойчивыми кристаллическими модификациями. Фатерит является наименее стабильной разновидностью карбоната кальция, и очень быстро превращается в воде либо в кальцит, либо в арагонит. Фатерит в природе встречается относительно редко.
Зарегистрирован как белый пищевой краситель E170.
Физические свойства карбоната кальция:
| Наименование параметра: | Значение: |
| Химическая формула | СаСО3 |
| Синонимы и названия иностранном языке | calcium carbonate (англ.) |
углекислый кальций (рус.)
Получение карбоната кальция:
Промышленный способ получения карбоната кальция заключается в разработке его месторождений в природе.
В лаборатории карбонат кальция получают гашением негашеной извести и последующим продуванием углекислого газа.
Так как гидроксид кальция растворяется в воде в небольшом количестве, то после отфильтровывания известкового молока получается прозрачный раствор – известковая вода, которая мутнеет при пропускании через неё диоксида углерода (углекислого газа). В результате образуется карбонат кальция, который выпадает в осадок.
Химические свойства карбоната кальция. Химические реакции карбоната кальция:
Карбонат кальция – это средняя соль, образованная сильным основанием (гидроксид кальция Ca(OH)2) и слабой кислотой (угольная кислота H2CO3).
Водные растворы CaCO3 имеют слабую щелочную реакцию.
1. реакция термического разложения карбоната кальция – обжиг известняка:
В результате реакции образуются оксида кальция и оксид углерода (IV). Обжиг известняка – это промышленный способ получения углекислого газа. Технологически этот процесс в промышленности реализуют в специальных шахтных печах.
2. реакция карбоната кальция и углерода (графита, кокса):
CaCO3 + C → CaO + 2CO (t = 800-850 °C).
В результате реакции образуются оксид кальция и оксида углерода (II).
3. реакция карбоната кальция и фтороводорода:
4. реакция взаимодействия карбоната кальция и сероводорода:
В результате реакции образуются сульфид кальция, вода и оксид углерода (IV).
Аналогичные реакции протекают и с другими галогеноводородами.
5. реакция взаимодействия карбоната кальция и азотной кислоты:
6. реакция взаимодействия карбоната кальция и угольной кислоты:
В результате реакции образуется гидрокарбонат кальция.
7. реакция взаимодействия карбоната кальция и бромной кислоты:
В результате реакции образуются бромат кальция, вода и оксид углерода (IV).
Аналогично проходят реакции карбоната кальция и с другими кислотами.
8. реакция взаимодействия карбоната кальция, оксида углерода (IV) и воды:
В результате реакции образуется гидрокарбонат кальция. Реакция протекает при комнатной температуре.
9. реакция взаимодействия карбоната кальция и оксида кремния:
В результате реакции образуются метасиликат кальция и оксида углерода (IV).
10. реакция взаимодействия карбоната кальция и оксида титана:
В результате реакции образуются титанат кальция и оксида углерода (IV). Реакция протекает при сплавлении реакционной смеси.
11. реакция взаимодействия карбоната кальция, оксида серы и кислорода:
В результате реакции образуются сульфат кальция и оксида углерода (IV). Данная реакция представляет собой метод очистки смеси газов от SO2.
12. реакция взаимодействия карбоната кальция, оксида свинца и кислорода:
13. реакция взаимодействия карбоната кальция и гидроксида натрия:
В результате реакции образуются карбонат натрия и гидроксид кальция. При этом гидроксид натрия в качестве исходного вещества используется в виде водного раствора.
14. реакция взаимодействия карбоната кальция и хлорида аммония:
В результате реакции образуются хлорид кальция, аммиак, вода и оксид углерода (IV). Реакция протекает при кипении.
15. реакция взаимодействия карбоната кальция и сульфида калия:
В результате реакции образуются карбонат калия и сульфид кальция.
16. реакция взаимодействия карбоната кальция и сульфида натрия:
В результате реакции образуются карбонат натрия и сульфид кальция.
Применение и использование карбоната кальция:
Карбонат кальция используется во множестве отраслей промышленности и для бытовых нужд:
– для письма на досках;
– в быту для побелки потолков, покраски стволов деревьев;
– в целлюлозно-бумажной промышленности – в производстве бумаги в качестве отбеливателя, наполнителя, а также раскислителя;
– в качестве пищевой добавки в пищевой промышленности;
– при производстве предметов гигиены (например, зубной пасты) и лекарственных средств;
– при производстве силикатного стекла ;
– в качестве наполнителя при производстве шпаклёвок и герметиков,
Карбонат кальция: способы получения и химические свойства
Карбонат кальция CaCO3 — соль кальция и угольной кислоты. Белый, при прокаливании разлагается, плавится без разложения под избыточным давлением CO2. Практически не растворяется в воде.
Относительная молекулярная масса Mr = 100,09; относительная плотность для тв. и ж. состояния d= 2,93; tпл = 1242º C при избыточном давлении.
Способ получения
2. В результате взаимодействия при комнатной температуре оксида кальция и углекислого газа происходит образование карбоната кальция:
3. Гидроксид кальция вступает в взаимодействие с углекислым газом и образует карбонат кальция и воду:
Качественная реакция
Качественная реакция на карбонат кальция — взаимодействие его с раствором сильных кислот. В результате реакции происходит бурное выделение углекислого газа, образование которого можно проверить, если пропустить его через известковую воду, которая мутнеет из-за образования осадка:
1. При взаимодействии с хлороводородной кислотой, карбонат кальция образует хлорид кальция, углекислый газ и воду:
Химические свойства
1. Карбонат кальция разлагается при температуре выше 900 — 1200º С, с образованием оксида кальция и углекислого газа:
2. Карбонат кальция вступает в реакцию со многими сложными веществами :
2.1. Карбонат кальция реагирует с оксидами :
2.1.1. Карбонат лития вступает в взаимодействие с оксидом кремния при 800º С и образует на выходе силикат кальция и углекислый газ:
2.2. Карбонат кальция реагирует с кислотами :
2.2.1. При взаимодействии с разбавленной хлороводородной кислотой карбонат кальция образует хлорид кальция, углекислый газ и воду:
2.2.3. Карбонат кальция взаимодействует с сероводородной кислотой при 900º С и образует сульфид кальция, воду и углекислый газ:
3. Карбонат кальция реагирует с простыми веществами:
3.1. Карбонат кальция при 800 — 850º С вступает в реакцию с углеродом (коксом) образуя оксид кальция и угарный газ:
CaCO3 + C = CaO + 2CO
Карбонат кальция – это
Определение и формула
Неорганическое соединение, соль угольной кислоты и кальция
Альтернативное название
Формула
Формула карбоната кальция
Химическая формула: CaCO3.
Краткая характеристика карбоната кальция:
Карбонат кальция – неорганическое вещество белого цвета.
Химическая формула карбоната кальция СаСО3.
Карбонат кальция (углекислый кальций) – неорганическое химическое соединение, соль угольной кислоты и кальция.
Практически не растворяется в воде. Не растворяется в этаноле. Легко растворяется в кислотах с выделением углекислого газа.
Карбонат кальция при прокаливании разлагается. Однако при избыточном давлении углекислого газа (СО2) плавится без разложения.
Встречается в виде трех кристаллических модификаций:
– кальцита (известняк, мел, мрамор);
– фатерита или ватерита.
Кальцит и арагонит являются устойчивыми кристаллическими модификациями. Фатерит является наименее стабильной разновидностью карбоната кальция, и очень быстро превращается в воде либо в кальцит, либо в арагонит. Фатерит в природе встречается относительно редко.
Зарегистрирован как белый пищевой краситель E170.
Физические свойства карбоната кальция:
| Наименование параметра: | Значение: |
| Химическая формула | СаСО3 |
| Синонимы и названия иностранном языке | calcium carbonate (англ.) |
углекислый кальций (рус.)
Плотность карбоната кальция
Плотность (кальцит) 2,74 г/см³, (арагонит) 2,83 г/см³.
Температура плавления карбонат кальция
Температура плавления (кальцит) 825° C, (арагонит) 1339° C,
Температура разложения карбоната кальция
Температура разложения 900-1000° C.
Химические свойства карбоната кальция. Химические реакции карбоната кальция:
Карбонат кальция – это средняя соль, образованная сильным основанием (гидроксид кальция Ca(OH)2) и слабой кислотой (угольная кислота H2CO3).
Водные растворы CaCO3 имеют слабую щелочную реакцию.
Химические свойства
Растворяется в воде при избытке углекислого газа образуя кислую соль — гидрокарбонат кальция Ca(HCO3)2:
Из-за этой реакции образуются сталактиты, сталагмиты. Природные подземные воды, обильные углекислом газом, растворяют плохо растворимый карбонат кальция с образованием много лучше растворимого в воде гидрокарбоната кальция, при выделении подземной воды в виде капель с потолков пещер при попадании в воздух с низкой концентрацией углекислого газа происходит обратная реакция превращения гидрокарбоната кальция в плохо растворимый осадок карбоната кальция, образующего красивые природные формы в пещерах, и из-за этого же механизма образуются карстовые пещеры.
При обжиге с температурой свыше 1500 °C с углеродом, например, в форме кокса, образует карбид кальция и угарный газ:
Биологическое значение
Карбонат кальция считается нетоксичным веществом. ПДК 180 мг/дм³ (в воде, с обязательным контролем по ионам кальция). ЛД50 на крысах около 6400 мг/кг.
Получение карбоната кальция
Промышленный способ получения карбоната кальция заключается в разработке его месторождений в природе.
В лаборатории карбонат кальция получают гашением негашеной извести и последующим продуванием углекислого газа.
Оксид кальция (негашеная известь) смешивается с водой. В результате образуется так называемое известковое молоко (гидроксид кальция).
Так как гидроксид кальция растворяется в воде в небольшом количестве, то после отфильтровывания известкового молока получается прозрачный раствор – известковая вода, которая мутнеет при пропускании через неё диоксида углерода (углекислого газа). В результате образуется карбонат кальция, который выпадает в осадок.
Где добывают карбонат кальция?
Залежи карбоната кальция в форме меловых отложений имеются на всех континентах. Добычей занимается множество компаний, но 70 % производства принадлежит десятку фирм из Европы, среди которых лидируют швейцарская Omya и французская Imerys. Однако около 10 лет назад добычей природных карбонатов и изготовлением Е 170 активно занялись китайские предприятия. Сейчас их доля на рынке постоянно растет, постепенно сужая сбыт европейской продукции.
Меловые пласты, пригодные для добычи карбоната кальция, есть и на российской территории, например, в Белгороде и Воронеже.
Лучший порошок получается в результате промышленной обработки мрамора. Для изготовления фармацевтического компонента и пищевого красителя Е 170 камень подвергается измельчению и многоступенчатой очистке.
Получение
Подавляющее количество карбоната кальция, добывающееся из полезных ископаемых, используется в промышленности. Чистый карбонат кальция (например, для производства продуктов питания или использования в фармацевтических целях), может быть изготовлен из природного минерала с малым количеством вредных примесей, например, из мрамора.
В лаборатории карбонат кальция может быть приготовлен предварительным гашением оксида кальция — негашеной извести. При этом образуется гидроксид кальция, и затем в суспензию продувается углекислый газ для получения карбоната кальция:
Нахождение в природе
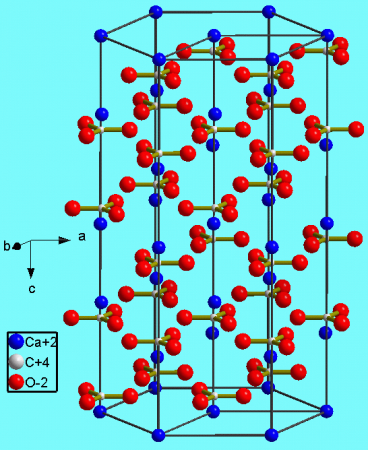
Кристаллическая структура кальцита
Карбонат кальция находится в минералах в виде полиморфов:
Тригональная кристаллическая структура кальцита является наиболее распространенной.
Минералы карбоната кальция находятся в следующих горных породах:
Геология
Залежи карбоната кальция в виде известняковых и меловых пластов — распространенное явление в земной коре. Они имеют органическое, реже хемогенное происхождение.
Органическое происхождение связано отложениями останков древних морских организмов: зоопланктона, моллюсков, кораллов и др., в основном, в меловой период.
Такие горные породы как известняк, мел, мрамор, травертин и другие известковые туфы практически полностью состоят из карбоната кальция с различными примесями.
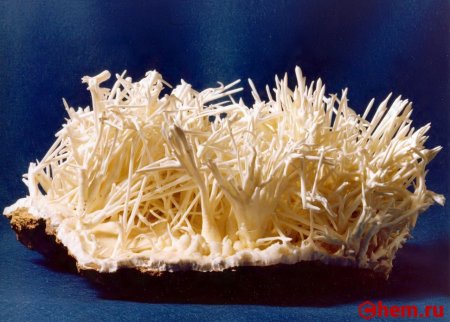
В природе встречаются три кристаллические модификации карбоната кальция (минералы с одинаковым химическим составом, но с различной кристаллической структурой): кальцит, арагонит и фатерит (ватерит).
Кальцит является наиболее устойчивой и распространённой кристаллической модификацией карбоната кальция. Около 10 % всех осадочных пород составляют известняки, сложенные кальцитовыми останками раковин простейших морских организмов.
Арагонит является второй по устойчивости и распространённости кристаллической модификацией CaCO3. В основном формируется в раковинах моллюсков и скелетах кораллов. Также арагонит может образовываться при неорганических процессах (хемогенное происхождение), например, в карстовых пещерах или гидротермальных источниках в результате химического осаждения из водных растворов или при испарении воды.
Фатерит является наименее стабильной разновидностью карбоната кальция и очень быстро превращается в воде либо в кальцит, либо в арагонит. В природе встречается относительно редко, когда его кристаллическая структура стабилизирована теми или иными примесями.
Применение и использование карбоната кальция:
Карбонат кальция используется во множестве отраслей промышленности и для бытовых нужд:
– для письма на досках;
– в быту для побелки потолков, покраски стволов деревьев;
– в целлюлозно-бумажной промышленности – в производстве бумаги в качестве отбеливателя, наполнителя, а также раскислителя;
– в качестве пищевой добавки в пищевой промышленности;
– в качестве наполнителя при производстве пластмасс, красок, резины, продукции бытовой химии и пр.;
– при производстве предметов гигиены (например, зубной пасты) и лекарственных средств;
– при производстве силикатного стекла;
– в качестве наполнителя при производстве шпаклёвок и герметиков,
– в сельском хозяйстве для раскисления кислых почв.
Массовое производство/использование
Таблетки из карбоната кальция
Очищенный от примесей, карбонат кальция широко используется в бумажной и пищевой промышленности, в качестве наполнителя при производстве пластмасс, красок, резины, продукции бытовой химии, в строительстве.
При производстве бумаги карбонат кальция применяют одновременно в качестве отбеливателя, наполнителя, а также раскислителя.
Используется при производстве силикатного стекла, — материала для производства оконного стекла, стеклянных бутылок, стекловолокна.
Применяется при производстве предметов гигиены (например, зубной пасты), в медицине.
В пищевой промышленности часто используется в качестве препарата препятствующего слеживанию и для препятствования слипания в комки сухих молочных продуктах.
При употреблении сверх рекомендованной дозы (1,5 г в день) может вызывать молочно-щелочной синдром (синдром Бернетта). Рекомендован при болезнях костных тканей.
Производители пластмассы — одни из основных потребителей чистого карбоната кальция (более 50% всего потребления). Используемый в качестве наполнителя и красителя, карбонат кальция необходим при производстве поливинилхлорида (PVC), полиэфирных волокон (кримплен, лавсан, и т. п.), полиолефинов. Изделия из данных видов пластмасс распространены повсеместно — это трубы, сантехника, кафельная плитка, черепица, линолеум, ковровые покрытия, и т.п. Карбонат кальция составляет порядка 20% красящего пигмента, используемого при производстве красок.
В строительстве
Строительство — ещё один из основных потребителей карбоната кальция. Например, в качестве наполнителя шпаклёвок и герметиков.
Также карбонат кальция является важным составным элементом при производстве продукции бытовой химии — средств для чистки сантехники, кремов для обуви.
Карбонат кальция широко применяется для раскисления кислых почв.
Применение карбоната кальция в промышленности
Физико-химические свойства карбоната кальция обусловили широкий потенциал его применения в разных отраслях промышленности. Мел используется при производстве:
Также природный карбонат кальция задействуется в разнообразных промышленных системах очистки. Он эффективно заменяет опасные синтетические препараты, чем помогает сохранять экологию. Углекислый кальций полезен для сельхозугодий — с его помощью восстанавливают и поддерживают кислотно-щелочной баланс почвы.
Применение в продуктах питания
Природный карбонат кальция применим в кулинарии как натуральный пищевой краситель, разрыхлитель, регулятор кислотности, наполнитель.
Также вещество предупреждает слеживание и комкование сыпучих изделий.
Карбонат кальция встречается в составе молочных и молочнокислых продуктов: сыра, сгущенки, сливок, йогуртов. Также полезную добавку используют при приготовлении детского питания, консервов, шоколадных плиток.
Польза и вред карбоната кальция для организма
Как мы уже выяснили, карбонат кальция не несет вреда организму. Доказательством тому служит использование в фармацевтике: вещество присутствует в БАДах и витаминных препаратах, направленных на устранения дефицита кальция.
Польза Е 170 очевидна: вещество поддерживает жизнедеятельность организма, стабилизирует кровяное давление, стимулирует работу сердечной мышцы, отвечает за свертываемость крови и формирование костных структур.
Для лучшего усвоения карбонат кальция рекомендуется употреблять совместно с витамином D.
Фармакодинамика и фармакокинетика
При попадании средства в пищеварительный тракт происходит нейтрализация соляной кислоты, снижается кислотность желудочного сока в целом. Эффект от применения Карбоната Кальция наступает достаточно быстро, однако при прекращении действия может возникнуть обратное действие, секреция желудочного сока усиливается. Вещество нормализует уровень электролитов, угнетает активность остеокластов, замедляет процессы разрушения костной ткани.
Показания к применению
Углекислый кальций назначают:
Противопоказания
Передозировка
Показано промыть желудок, дать пострадавшему энтеросорбенты, проводить симптоматическое лечение.
Взаимодействие
Сочетанный прием средства с тетрациклиновыми антибиотиками может привести к снижению их эффективности и плазменной концентрации.
При сочетании препарата с тиазидными диуретиками выше риск развития метаболического алкалоза и гиперкальциемии.
Карбонат Кальция замедляет процессы абсорбции других лекарств.
Особые указания
При продолжительном лечении средством рекомендуют контролировать плазменную концентрацию кальция.
При приеме больших доз препарата и больших количеств молочной продукции может развиться гиперкальциемия и молочно-щелочной синдром.
Детям
Для детей нужно скорректировать дозировку.
При беременности и лактации
Вещество часто назначают беременным женщинам и кормящим мамам.