карбид кальция какая кристаллическая решетка
Типы кристаллических решёток
Урок 9. Химия 11 класс ФГОС
В данный момент вы не можете посмотреть или раздать видеоурок ученикам
Чтобы получить доступ к этому и другим видеоурокам комплекта, вам нужно добавить его в личный кабинет, приобрев в каталоге.
Получите невероятные возможности
Конспект урока «Типы кристаллических решёток»
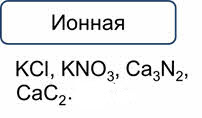
Для определения типа кристаллической решётки поступают следующим образом. Если связь в соединении ионная, то кристаллическая решётка всегда ионного типа: хлорид калия, нитрат калия, нитрид кальция, карбид кальция, оксид алюминия.
Если связь металлическая, то и кристаллическая решётка всегда металлическая: латунь, железо, медь, натрий.
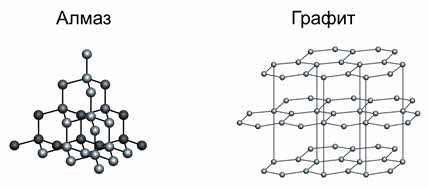
Если связь ковалентная, то решётка может быть, как атомной, так и молекулярной. Веществами с атомной кристаллической решёткой являются: карборунд, оксид кремния четыре, бор, кремний, алмаз, графит, чёрный и красный фосфор.
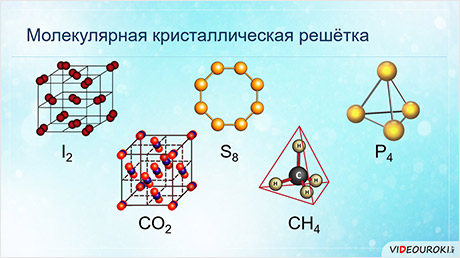
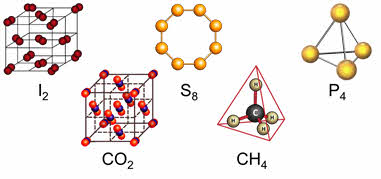
У веществ с молекулярной кристаллической решёткой в узлах кристаллической решётки расположены молекулы, прочность данной связи слабая.
Для веществ с молекулярной кристаллической решёткой характерны низкие температуры плавления, то есть они легкоплавки и летучи, значительная сжимаемость, иногда запах, а также явление сублимации, или возгонки, как для йода и твёрдого углекислого газа.
Для веществ с молекулярной кристаллической решёткой характерна небольшая твёрдость, большинство этих веществ хорошо растворимы в воде. Молекулярную кристаллическую решётку имеют газы и жидкости в твёрдом агрегатном состоянии. Например, кристаллический йод, сера, белый фосфор, углекислый газ, большинство органических соединений.
У веществ с атомной кристаллической решёткой в узлах расположены атомы. Связь между атомами в кристаллические решётки – ковалентная, очень прочная. Для этих веществ характерны высокие температуры кипения и плавления, то есть они тугоплавки и нелетучий, очень твёрдые, практически не растворимы в воде и не имеют запаха.
Примером веществ с таким типом кристаллических решёток являются алмаз и графит.
Как известно, твёрдость алмаза оценивается по шкале Мооса самым высоким значением – 10. Благодаря высокой твёрдости алмаз используют для изготовления буров, свёрл, шлифовальных инструментов, стеклорезов. Алмаз является камнем ювелиров, они используют отшлифованные алмазы – бриллианты.
Графит также является веществом с атомной кристаллической решёткой, но несмотря на это, он мягкий, так как имеет слоистую структуру. В кристаллической решётке графита атомы углерода, лежащие в одной плоскости, связаны в правильные шестиугольники. Связи между слоями непрочные, за счёт этого графит мягкий. Графит, как и алмаз, тугоплавкий. Из него изготавливают электроды, твёрдые смазки, стержни для карандашей, замедлители нейтронов в ядерных реакторах.
Атомные кристаллические решётки имеют не только простые, но и сложные вещества. Например, все разновидности оксида алюминия. Такие, как наждак, корунд, рубин, сапфир.
Наиболее распространённое соединение кремния – это оксид кремния четыре, который также имеет атомную кристаллическую решётку. Почти чистым оксидом кремния четыре является минерал кварц.
У веществ с ионным типом связи в узлах кристаллической решётки расположены ионы, связь между частицами – ионная, она прочная.
Для веществ с ионным типом связи характерны следующие свойства: высокие температуры плавления и кипения, они тугоплавки и нелетучи, они твёрдые, хрупкие, многие растворимы в воде. Их хрупкость объясняется тем, что если попробовать деформировать такую кристаллическую решётку, то один из её слоёв будет двигаться относительно другого слоя до тех пор, пока одинаково заряженные ионы не будут друг против друга. Эти ионы начнут отталкиваться друг от друга, и кристаллическая решётка разрушиться.
Вещества с ионным типом связи плохо проводят электрический ток и тепло. Но их растворы и расплавы проводят электрический ток. Вещества с ионным типом связи не имеют запаха.
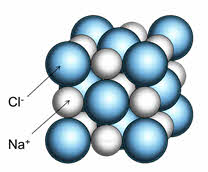
Ионное соединение представляет собой гигантскую ассоциацию ионов, расположенных в пространстве благодаря равновесию сил притяжения и отталкивания.
Например, кристалл хлорида натрия состоит из катионов натрия и анионов хлора. Каждый катион натрия окружён шестью анионами хлора, а каждый анион хлора – шестью катионами натрия. Наименьшей структурной единицей кристалла является элементарная ячейка. Строение элементарной ячейки зависит от соотношения размеров катиона и аниона.
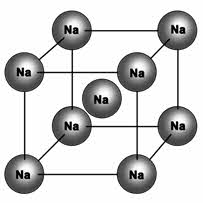
У веществ с металлическим типом связи в узлах кристаллической решётки расположены атом-ионы, связь между ними металлическая. Связь может быть различной по прочности.
Металлическая кристаллическая решётка определяет свойства металлов: ковкость, пластичность, электро-и теплопроводность, металлический блеск, способность образовывать сплавы.
Пластичность выражается в способности металлов деформироваться под действием механической нагрузки. Это свойство лежит в основе ковки, прокатки металлов, их способности вытягиваться в проволоку. Пластичность объясняется тем, что под воздействием силы слои перемещаются относительно друг друга без разрыва связи между ними.
Например, если двумя плоскими стеклянными пластинками поместить несколько капель воды, то пластинки будут свободно скользить относительно друг друга, но вот разъединить их будет достаточно сложно. Таким образом, в данном опыте вода играла роль свободных электронов, которые находятся в металлической кристаллической решётке.
Наиболее пластичными металлами являются золото, серебро и медь. Именно из золота можно сделать самую тонкую фольгу толщиной три тысячных миллиметра. Такую тонкую фольгу использую для золочения. Примером может служить Янтарная комната в Большом Екатерининском дворце.
Высокая электропроводность металлов обусловлена наличием свободных электронов, которые под действием электрического тока приобретают направленное движение.
Лучшими проводниками электрического ока являются серебро и медь, немного худшим – алюминий. Однако в большинстве случаев в качестве электропроводов используют алюминий, а не медь.
Теплопроводность металлов также объясняется движением свободных электронов, которые сталкиваются с атом-ионами в узлах кристаллической решётки и обмениваются с ними энергией. Благодаря этому свойству металлическая посуда равномерно нагревается.
Вещества с металлическим типом кристаллической решётки имеют металлический блеск из-за отражения световых лучей.
Высокой светоотражающей способностью обладают ртуть, серебро, палладий и алюминий. Из серебра, палладия и алюминия изготавливают зеркала, прожектора и фары. В порошкообразном состоянии металлы теряют свой блеск, только магний и алюминий сохраняют его.
Большинство металлов имеет серебристо-белый цвет. Только золото окрашено в жёлтый цвет, а медь в красный.
Металлическая кристаллическая решётка характерна не только для металлов, но и для сплавов. Это отличает металлические сплавы от других сплавов: стекла, фарфора, керамики, базальтов, гранитов, гнейсов.
Карбид кальция
| Карбид кальция | |
|---|---|
  | |
| Систематическое наименование | Кальция карбид |
| Традиционные названия | Ацетиленид кальция; углеродистый кальций |
| Хим. формула | CaC2 |
| Рац. формула | CaC2 |
| Состояние | твёрдое |
| Молярная масса | 64,0994 (±0,004) г/моль |
| Плотность | 2,22 г/см³ |
| Т. плав. | 2160 °C |
| Т. кип. | 2300 °C |
| Координационная геометрия | 6 |
| Кристаллическая структура | Тетрагональная |
| ГОСТ | ГОСТ 1460-81 ГОСТ 1460-2013 |
| Рег. номер CAS | 75-20-7 |
| PubChem | 6352 |
| Рег. номер EINECS | 200-848-3 |
| SMILES | |
| RTECS | EV9400000 |
| ChemSpider | 6112 |
| Приводятся данные для стандартных условий (25 °C, 100 кПа), если не указано иного. | |
Карбид кальция (углеродистый кальций, ацетиленид кальция) — CaC2 — в чистом виде белое кристаллическое вещество. Бинарное неорганическое соединение кальция с углеродом.
Содержание
История получения
Впервые получен в 1861 году Фридрихом Вёлером нагреванием сплава цинка и кальция с углём.
Получение
В настоящее время получают прокаливанием в электрических печах (температура 1900—1950 °C) смеси оксида кальция с коксом.
Полученный таким образом технический продукт имеет чисто-черный цвет вследствие загрязнения углём и другими красящими примесями. Он содержит также примеси фосфида и сульфида кальция, вследствие чего такой карбид кальция и полученный из него ацетилен имеют неприятный запах.
Физические свойства
Химические свойства
При взаимодействии c водой карбид кальция гидролизуется с образованием ацетилена и гидроксида кальция (гашёной извести):
Представленная выше реакция является экзотермической.
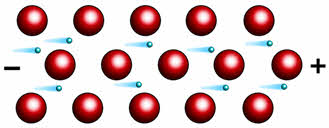
Внешний вид и характеристики технического карбида кальция
Карбид кальция получают сплавлением в электрических печах кокса и негашеной извести. Расплавленный карбид кальция выпускается из печи в специальные формы — изложницы, в которых он затвердевает. Застывший карбид кальция дробится и сортируется на куски определённых размеров.
Технический карбид кальция представляет собой твёрдое кристаллическое вещество. По внешнему виду карбид кальция представляет собой твёрдое вещество тёмно-серого или коричневого цвета. Он даёт кристаллический излом серого цвета с различными оттенками в зависимости от чистоты. Карбид кальция жадно поглощает воду. При взаимодействии с водой даже на холоде карбид кальция разлагается с бурным выделением ацетилена и большого количества тепла. Разложение карбида кальция происходит и под влиянием атмосферной влаги.
По ГОСТ 1460-56 установлены следующие размеры (грануляция) кусков карбида кальция: 2×8; 8×15; 15×25; 25×80. Технический карбид кальция содержит до 80 % химически чистого карбида кальция, остальное составляют примеси — негашеная известь, углерод, кремнекислота и другое.
Область применения карбида кальция
Карбид кальция используют при проведении автогенных работ и освещения, а также в производстве ацетиленовой сажи и продуктов органического синтеза, из которых главным является синтетический каучук.
Карбид кальция применяют в производстве цианамида кальция, из которого получают удобрения, цианистые соединения. Карбид кальция используют для получения карбидно-карбамидного регулятора роста растений, изготовления порошкового карбидного реагента.
Из 1 кг технического карбида получается от 235 до 285 л ацетилена в зависимости от его сорта и грануляции: чем чище и крупнее карбид кальция, тем большее количество ацетилена он даёт при разложении.
Для разложения 1 кг карбида кальция теоретически требуется 0,56 л воды. Практически берут от 5 до 20 л воды с целью лучшего охлаждения ацетилена и обеспечения безопасности при работе. Скорость разложения карбида кальция водой зависит от его чистоты, грануляции, температуры и чистоты воды. Чем чище карбид кальция, меньше размер его кусков, выше температура и чище вода, тем больше скорость.
Как применяется карбид кальция для сварки, из чего он сделан
История получения
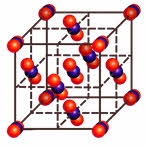
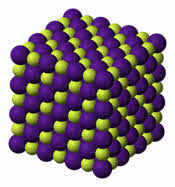
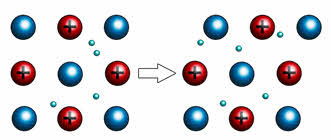
Карбид кальция – соединение, получившее широкое применение в современной промышленности. В 1862 году немецкий химик Фридрих Велер впервые синтезировал молекулу этого вещества. Получение карбида кальция он осуществил следующим образом. Ученый приготовил расплав кальция с цинком, а затем нагрел его с углем. В результате получился карбид. Химическая формула соединения – CaC2.Промышленный способ получения карбида предложил ученый Муассан в 1892 году. Другие названия вещества – ацетиленид кальция, или углеродистый кальций. Кристаллическая решетка соединения выглядит следующим образом:
Физические свойства
Химические свойства
Карбид кальция хорошо впитывает воду. Этот процесс сопровождается химической реакцией разложения. Важно, что карбидная пыль обладает раздражающим действием на слизистые оболочки, кожу и органы дыхания. Поэтому во время работы с соединением необходимо использовать противогазы либо противопылевые респираторы. С кислородом карбид кальция взаимодействует при высокой температуре с образованием карбоната кальция. Реакция с азотом приводит к синтезу цианамида кальция. Также при высоких температурах карбид кальция вступает в реакции соединения с хлором, фосфором, мышьяком. Но все-таки одним из важнейших свойств соединения считается разложение водой.



Можно ли тушить водой карбид кальция?
Calcium carbide является негорючим продуктом, но выделяющийся при его разложении ацетилен взрыво- и пожароопасен. Он легко воспламеняется даже при кратковременном контакте с воздухом и обладает способностью самовоспламеняться даже в чистом виде. Он также легко вступает в реакцию с солями меди, серебра и ртути с образованием нестойких взрывчатых ацетеленидов. Обладает наркотическим действием, обусловленным фосфористым водородом в его составе.
Реагент ни в коем случае не разрешается тушить водой! При попадании жидкости в емкости с веществом возможны взрывы. Для тушения следует применять сухие порошковые огнетушители, сухой песок, углекислоту, асбестовое полотно.
Ацетилен легче воздуха, поэтому возможно его накопление в высших точках слабовентилируемых помещений.
Получение
Производство карбида кальция заключается в следующем. Негашеную известь и предварительно измельченный кокс смешивают. Полученную смесь подвергают расплавлению в электрических печах. Кокс и оксид кальция берутся в равных по массе частях. Процесс происходит при температуре 1900 оС. Расплав выходит из печи и в дальнейшем разливается по специальным формам. Затем уже затвердевший карбид кальция дробят и сортируют по размеру кусков. Гранулы вещества разделяются на четыре фракции в соответствии с их размерами: 25×80, 15×25, 8×15, 2×8, которые определяются ГОСТом 1460-56. По своему составу технический карбид кальция содержит 75-80% основного вещества. На долю примесей, таких, как углерод, известь и других, приходится до 25% от общей массы полученной смеси. Кроме того, содержащийся в техническом карбиде сульфид и фосфид кальция обусловливают довольно неприятный его запах. Представим реакцию получения СаС2: СаО + 3С → СаС2 + СО↑. Образование ацетиленида кальция сопровождается поглощением тепла. Поэтому логично предположить, что реакция его разложения, напротив, идет с выделением энергии.
Какие бывают карбиды?
Оказывается, карбид, формула которого, скажем, CaC2, существенно отличается по строению от SiC. И отличие это прежде всего в характере связи между атомами. В первом случае мы имеем дело с солеобразным карбидом. Назван этот класс соединений так потому, что ведёт себя фактически как соль, то есть способен диссоциировать на ионы. Такая ионная связь очень слабая, что и позволяет легко проводить реакцию гидролиза и многие другие превращения, включающие взаимодействия между ионами.
Другим, наверное, более промышленно важным видом карбидов являются ковалентные карбиды: такие как, например, SiC или WC. Они отличаются высокой плотностью и прочностью. А также тугоплавки и инертны к разбавленным химическим веществам.
Существуют также металлоподобные карбиды. Их скорее можно рассматривать как сплавы металлов с углеродом. Среди таких можно выделить, например, цементит (карбид железа, формула которого бывает разной, но в среднем она примерно такая: Fe3C) или чугун. Они имеют химическую активность, промежуточную по своей степени между ионными и ковалентными карбидами.
Каждый из этих подвидов обсуждаемого нами класса химических соединений имеет своё практическое применение. О том, как и где применяется каждый из них, мы поговорим в следующем разделе.
Транспортировка и хранение
По причине того, что влага моментально разлагает карбид с выделением большого количества тепла и образованием взрывоопасного газа ацетилена, хранить вещество необходимо в герметично закупоренных барабанах или бидонах. Следует помнить, что ацетилен легче воздуха и способен скапливаться в верхних зонах помещения. Этот газ, помимо наркотического действия, обладает способностью к самовоспламенению. Поэтому использовать карбид кальция необходимо с большой осторожностью. Расфасовке на производстве уделяется особое внимание. Готовое вещество помещается в специальные барабаны (тара, напоминающая консервные банки). Такая упаковка требует аккуратного вскрытия. При этом должен использоваться инструмент, не приводящий к образованию искр (молоток или специальный нож). В случае попадания карбида на кожу или слизистые оболочки необходимо немедленно промыть пораженный участок водой и обработать место вазелином или жирным кремом. Транспортировка соединения осуществляется с использованием только крытых видов транспорта. Воздушная доставка карбида запрещена. Помещения, где хранится СаС2, должны быть хорошо проветриваемыми. Также не разрешается хранить карбид совместно с другими химическими веществами. Это может привести к нежелательным, а, возможно, и опасным, реакциям. Срок хранения карбида составляет полгода.


Свойства и состав
Чтобы получить этот камень, нужно, как минимум, два элемента. Во-первых, это углерод. Его наличие обязательно. А дальше уже есть выбор: металл, или неметалл. Главное, чтобы выполнялось правило: электроотрицательность (сила, с которой атомы элемента притягивают к себе чужие электроны) обязательного компонента выше, чем его «партнера». Иначе получатся совсем другие соединения.
Формула карбида кальция
Впервые об этом соединении заговорили в Англии еще в 19-м веке. Однако, слава первооткрывателя досталась французу, благодаря опытам которого вещество официально признали, случилось это лишь к концу столетия. А теперь от том, какие качества присущи этому соединению:
Применение
Область применения карбида кальция чрезвычайно широка. В первую очередь это промышленный синтез. Карбид кальция используется для производства синтетического каучука, уксусной кислоты, ацетона, этилена, винилхлорида, стирола. Также он находит применение в получении цианамида кальция. Это вещество ценно своим использованием в синтезе различных удобрений и цианистых веществ. В сельском хозяйстве любому агроному известно такое название, как карбидно-карбамидный регулятор. Он применяется для регуляции роста растений. А для его получения также используется карбид кальция. Кроме того, это соединение находит применение в процессе производства цианамида кальция. Эта реакция основана на нагревании карбида кальция с азотом. Восстановление щелочных металлов также не обходится без применения описываемого нами вещества. Карбид кальция применяется и в процессе газосварки. Например, широко используются карбидные лампы. Принцип их работы основан на взаимодействии в специальной емкости карбида с водой и сгорании на выходе из аппарата конечного вещества реакции – ацетилена. Посмотрите на фото карбидной лампы.
Особенности применения
В сварке это вещество используют везде. Делают это по следующей схеме:
Карбид при сварочных работах выполняет функции топлива, насыщающего генератор газа. И без его применения будет трудно применять ацетиленовую горелку. Ведь газовый баллон очень нелегко перемещать. А карбидные кусочки достаточно положить в герметичный сосуд и транспортировать на совершенно любые расстояния, предотвратив появление влаги.
Производство ацетилена
Одной из важнейших областей применения карбида кальция является его использование в получении ацетилена. Заслуга в открытии этого способа также принадлежит немецкому ученому-химику Фридриху Велеру. В основе этого промышленного процесса лежит реакция разложения карбида под воздействием воды. СаС2 + 2 Н2О → С2Н2 + Са(ОН)2↓.На выходе образуется газ ацетилен и гашеная известь, выпадающая в осадок. Процесс сопровождается выделением большого количества тепла. Объем газа на выходе зависит от того, насколько чистый используется для реакции карбид кальция. Ацетилен, образующийся в результате, может иметь различный объем – 1 кг исходного вещества может дать от 235 до 290 литров газа. Что касается скорости протекания реакции, то она зависит как от малого процента примесей в карбиде кальция, так и от температуры воды, а также ее чистоты. Если рассматривать теоретическую реакцию производства ацетилена из карбида, то в ней на 1 кг карбида достаточно 560 мл воды. Однако на практике объем воды для проведения реакции увеличивается. На 1 кг карбида кальция в условиях промышленного синтеза требуется от 5 до 20 литров воды. Такое количество необходимо для того, чтобы ацетилен лучше охлаждался, а также для обеспечения оптимальной безопасности при работе. Ниже изображен немецкий химик Фридрих Велер.
Применение вещества
Кальция карбид активно применяется в промышленности. Он является катализатором в сфере синтеза органических соединений. С его помощью стало возможным синтезировать каучук за более низкую цену. Однако для этого вначале необходимо провести необходимые химические реакции для синтеза собственного карбида, а уже потом — каучука. Все больше химиков задаются вопросом о том, где найти карбид в природе, чтобы облегчить себе работу.
Карбид нашел свое применение в садоводстве. На его основе фермеры получают удобрение под названием цианид кальция. Применяется для улучшения роста корневой системы саженцев и взрослых растений.
Лабораторный опыт получения ацетилена
Многим из школьных уроков химии знакома реакция взаимодействия карбида с водой. Обычно этот опыт позволяет продемонстрировать реакцию получения ацетилена, а также физические и химические его свойства. Процесс выделения газа при этом происходит достаточно бурно, поэтому трубка, отводящая ацетилен из колбы с действующими веществами, помещается в чашу с водой. Это обеспечивает менее активное и стремительное движение газа. Кроме того, в лабораторных условиях можно использовать и другой способ, чтобы сделать не слишком бурной реакцию разложения такого соединения, как карбид. Ацетилен при этом идет равномерно и спокойно. Для этого вместо воды необходимо взять насыщенный раствор поваренной соли. Также в лаборатории при проведении этой реакции следует осторожно добавлять воду в карбид, помещенный в объемную колбу, а не наоборот.
Практическое применение карбидов
Самое узкое применение имеют солеобразующие карбиды. Их реакцию с водой используют как лабораторный способ получения углеводородов. То, как это происходит, мы уже разобрали выше.
Наравне с ковалентными, металлоподобные карбиды имеют широчайшее применение в промышленности. Как мы уже говорили, таким металлоподобным видом обсуждаемых нами соединений являются стали, чугуны и прочие соединения металлов с вкраплениями углерода. Как правило, металл, находящийся в таких веществах, относится к классу d-металлов. Именно поэтому он склонен образовывать не ковалентные связи, а как бы внедряться в структуру металла.
На наш взгляд, практических применений у вышеперечисленных соединений более чем достаточно. Теперь взглянем на процесс их получения.
Применение материалов
Карбиды металлов применяются производстве (в основном — в тяжелом). Перечислим основные варианты применения:
Производство карбида
Что такое карбид кальция? Это продукт, получаемый в результате термической реакции окиси кальция и кокса. Основным сырьем для его производства служат известняки, к которым предъявляются особые требования. Сырье должно быть однородным, поэтому карбидные предприятия обычно работают на известняках из хорошо изученных месторождений. Технологический процесс складывается из нескольких этапов:
Сам материал и его производство относится к разряду взрыво- и огнеопасных. Поэтому государственными нормативами предусмотрено строжайшее выполнение правил безопасного хранения и обращения с карбидом кальция. Основные требования таковы:
Емкости с карбидом кальция можно складировать и в горизонтальном, и в вертикальном положении. Свободную тару необходимо хранить в специально отведенных местах.
Разновидности карбидов
Различают несколько разновидностей карбидов в зависимости от конфигурации кристаллической решетки. Тип решетки определяет ряд физико-химических свойства материала, что нужно учитывать при их применении. Рассмотрим основные разновидности кристаллических решеток карбидов:
Внешний вид и характеристики технического карбида кальция
Впервые рассматриваемый состав был получен в 1862 году. Проводимая процедура касалась отделения кальция от извести, в результате чего получился бледно-серый состав без признаков, свойственных металлам. В результате опыта был получен карбид, который в последствии стал активно использоваться при выпуске различной продукции.
В начале 20 века карбид кальция стали использовать для производства ацетилена в больших объемах. Именно поэтому стали вести активные исследования для выявления более производительной технологии.
Технические характеристики материала определяют его широкое распространение. Внешний вид вещества характеризуется светло-серым цветом, выпускаются карбиды в виде камня или порошка.