какую связь называют пептидной
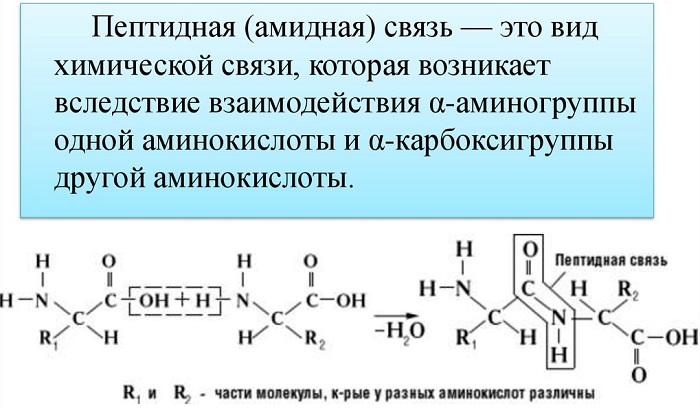
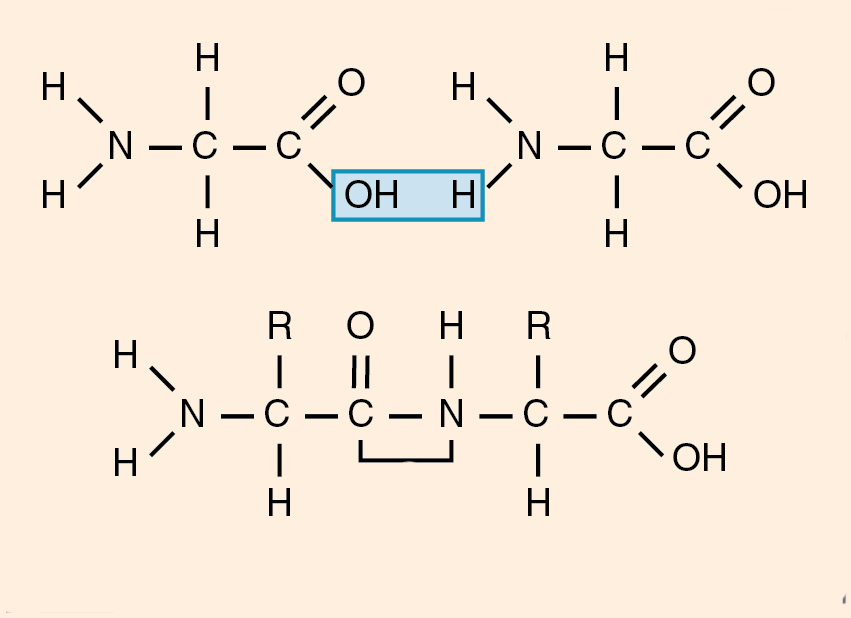
Пептидная связь возникает между аминокислотами при взаимодействии аминогруппы (-NH2) и карбоксильной группы (-СООН). Две соединенные между собой аминокислоты дают дипептид, три – трипепетид и так далее. Более длинные цепи называют полипептиды и белки.
Как образуется пептидная связь
Данный вид образуется при оттягивании электронной плотности с атома водорода аминогруппы одной и атомом кислорода карбоксильной группы другой аминокислоты.
В результате разрываются соединение между N и Н в аминогруппе и между С и ОН в карбоксильной группе. Протон и гидроксильная группа, объединяясь, дают воду. Два аминокислотных остатка – дипептид.
Свойства пептидной связи
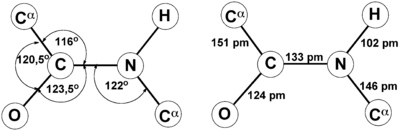
Пептидная связь, характерная для первичной структуры белков, не является полностью одинарной. Её длина составляет 0.132 нм. Это среднее значение между значением истинной двойной связью (C = N, 0,127 нм) и значением истинной одинарной связью (C – N, 0,149 нм).
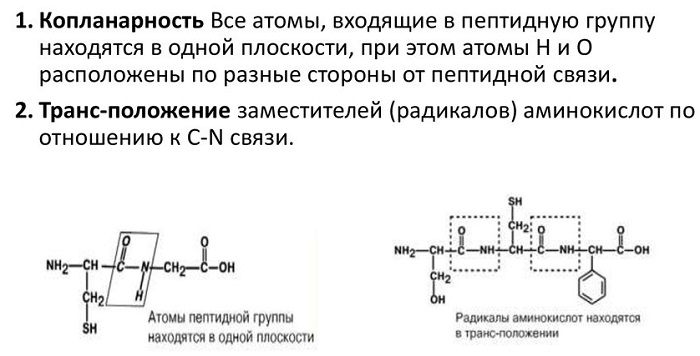
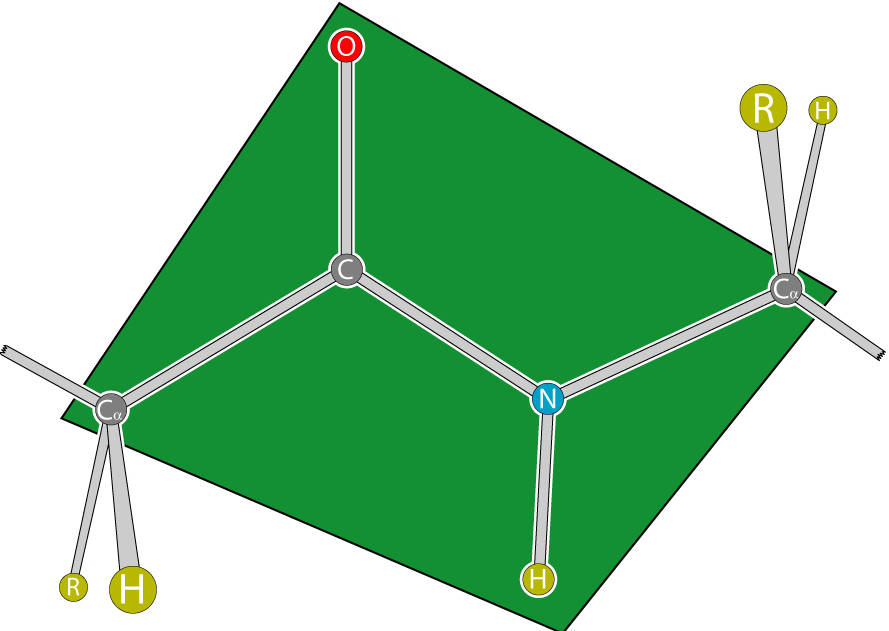
Атомы, непосредственно вступающие во взаимодействие (углерод, азот, кислород, водород) и два атома α-углерода расположены в общей плоскости. Радикальные группы аминокислот и водорода при α-углеродах лежат за пределами плоскости.
Водород и кислород пептидной связи и α-углероды аминокислот находятся в транс-ориентации. Во всех белковых и пептидных молекулах естественного происхождения, аминокислотные R-группы тоже ориентированы в транс-модификацию.
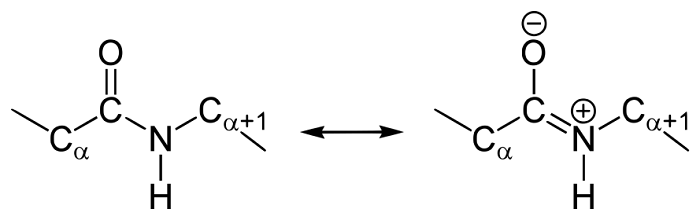
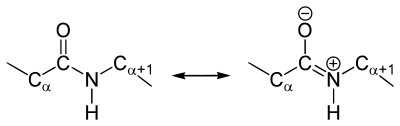
Резонансные формы пептидных связей
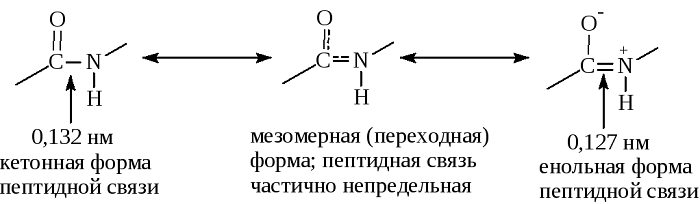
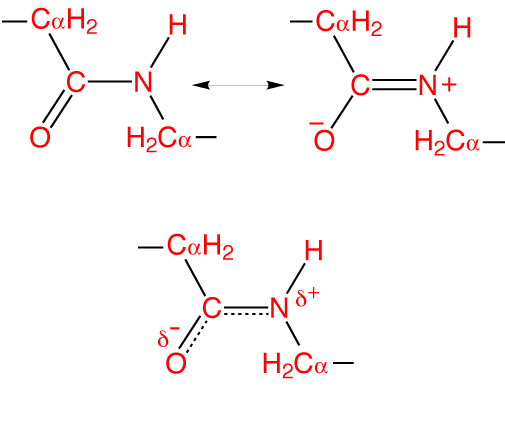
В основе феномена резонанса пептидной связи лежит то, что она на 40% является двойной.
В результате этот вид существует в трех формах:
Кетольная (0,132 нм). Когда взаимодействие между атомами азота и углерода стабилизируется и становится полностью одиночной.
Переходная или мезомерная форма с неопределенными, промежуточными характеристиками.
Енольная (0,127 нм). В этой форме электронная плотность переходит с пептидной на связь между углеродом и кислородом, делая её полностью двойной, вследствие атом кислорода становится заряжен частично отрицательно.
Таким образом, причиной резонанса является делокализованность электронной плотности между азотом и углеродом.
Строение пептидной связи
В итоге электронная плотность пептидной группы смещается к кислороду. В результате такого сопряжения выравниваются длины связей внутри радикала.
Структура и формула отражены на картинке:
Методы определения пептидных связей
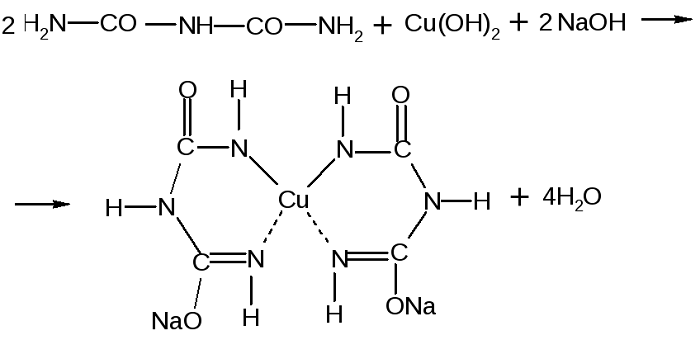
Качественной является биуретовая реакция. Такое название она получила, так как впервые была проведена для биурета, хоть и не являющегося аминокислотой, но обладающего двумя пептидными связями.
Принцип определения сводится к тому, что аминокислоты, могущие образовать минимум две пептидные связи, в щелочной среде, при добавлении сульфата меди (II), образуют медьсодержащее комплексное соединение фиолетового цвета.
Комплекс меди с биуретом образуется по схеме:
Заключение
Пептидная связь является основой построения белковых молекул, из которых, в конечном итоге, строятся все живые организмы. Особенности её строения и пространственной конфигурации оказали огромное влияние на саму возможность существования жизни на нашей планете.
Последовательность аминокислот в белке определяется другой важнейшей молекулой – ДНК.
Пептидная связь
Пептидная связь — вид амидной связи, возникающей при образовании белков и пептидов в результате взаимодействия α-аминогруппы (—NH2) одной аминокислоты с α-карбоксильной группой (—СООН) другой аминокислоты.
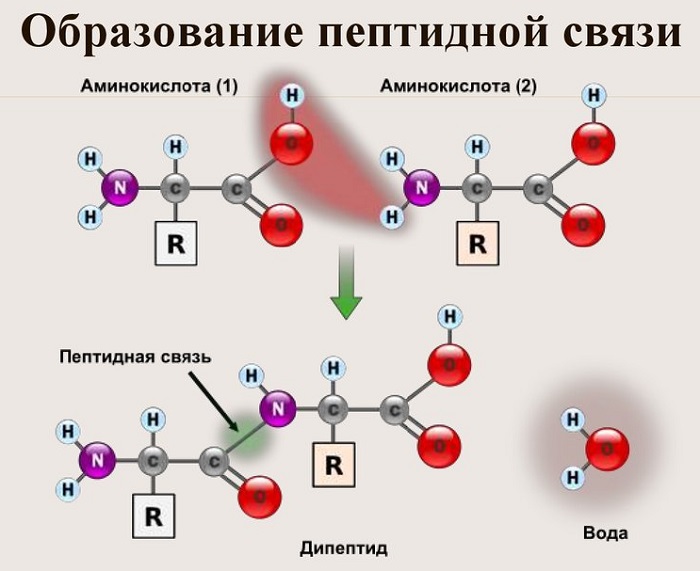
Из двух аминокислот (1) и (2) образуется дипептид (цепочка из двух аминокислот) и молекула воды. По этой же схеме рибосома генерирует и более длинные цепочки из аминокислот: полипептиды и белки. Разные аминокислоты, которые являются «строительными блоками» для белка, отличаются радикалом R.
Свойства пептидной связи
Как и в случае любых амидов, в пептидной связи за счет резонанса канонических структур связь C-N между углеродом карбонильной группы и атомом азота частично имеет характер двойной:
Это проявляется, в частности, в уменьшении её длины до 1,33 ангстрема:
Это обусловливает следующие свойства:
Для обнаружения белков и пептидов, а также их количественного определения в растворе используют биуретовую реакцию.
Ссылки
Полезное
Смотреть что такое «Пептидная связь» в других словарях:
ПЕПТИДНАЯ СВЯЗЬ — ( CO NH ) химическая связь, соединяющая аминогруппу одной аминокислоты с карбоксильной группой другой в молекулах пептидов и белков … Большой Энциклопедический словарь
пептидная связь — – амидная связь (NH CO ), образующаяся между амино и карбоксильной группами аминокислот в результате реакции дегидратации … Краткий словарь биохимических терминов
пептидная связь — Ковалентная связь между альфа аминогруппой одной аминокислоты и альфа карбоксильной группой другой аминокислоты [http://www.dunwoodypress.com/148/PDF/Biotech Eng Rus.pdf] Тематики биотехнологии EN peptide bond … Справочник технического переводчика
Пептидная связь — * пептыдная сувязь * peptide bond ковалентная связь между двумя аминокислотами, возникающая в результате соединения α аминогруппы одной молекулы с α карбоксильной группой др. молекулы, с одновременным удалением воды … Генетика. Энциклопедический словарь
пептидная связь — ( СО NH ), химическая связь, соединяющая аминогруппу одной аминокислоты с карбоксильной группой другой в молекулах пептидов и белков. * * * ПЕПТИДНАЯ СВЯЗЬ ПЕПТИДНАЯ СВЯЗЬ ( CO NH ), химическая связь, соединяющая аминогруппу одной аминокислоты… … Энциклопедический словарь
пептидная связь — peptide bond пептидная связь. Pазновидность амидной связи, образуется между α карбоксильной и α аминогруппой двух аминокислот. (Источник: «Англо русский толковый словарь генетических терминов». Арефьев В.А., Лисовенко Л.А., Москва: Изд во ВНИРО,… … Молекулярная биология и генетика. Толковый словарь.
пептидная связь — peptidinis ryšys statusas T sritis chemija apibrėžtis Amidinis ryšys, jungiantis elementariąsias grandis baltymo ar peptido molekulėje. atitikmenys: angl. peptide bond rus. пептидная связь … Chemijos terminų aiškinamasis žodynas
ПЕПТИДНАЯ СВЯЗЬ — Связь между аминной группой одной аминокислоты и карбоксильной группой другой … Толковый словарь по психологии
Пептидная связь — характеристика, свойства и строение
Пептидная связь возникает между аминокислотами при взаимодействии аминогруппы (-NH2) и карбоксильной группы (-СООН). Две соединенные между собой аминокислоты дают дипептид, три – трипепетид и так далее. Более длинные цепи называют полипептиды и белки.
Образование полипептидной связи внутри клеток идет на рибосомах, при участии ферментов с затратой энергии. Аминокислоты являются мономерами — строительными блоками белков. Для синтеза белка живые организмы используют 20 видов аминокислот.
Как образуется пептидная связь
Данный вид образуется при оттягивании электронной плотности с атома водорода аминогруппы одной и атомом кислорода карбоксильной группы другой аминокислоты.
В результате разрываются соединение между N и Н в аминогруппе и между С и ОН в карбоксильной группе. Протон и гидроксильная группа, объединяясь, дают воду. Два аминокислотных остатка – дипептид.
Свойства пептидной связи
Пептидная связь, характерная для первичной структуры белков, не является полностью одинарной. Её длина составляет 0.132 нм. Это среднее значение между значением истинной двойной связью (C = N, 0,127 нм) и значением истинной одинарной связью (C – N, 0,149 нм).
Атомы, непосредственно вступающие во взаимодействие (углерод, азот, кислород, водород) и два атома α-углерода расположены в общей плоскости. Радикальные группы аминокислот и водорода при α-углеродах лежат за пределами плоскости.
Водород и кислород пептидной связи и α-углероды аминокислот находятся в транс-ориентации. Во всех белковых и пептидных молекулах естественного происхождения, аминокислотные R-группы тоже ориентированы в транс-модификацию.
Резонансные формы пептидных связей
В основе феномена резонанса пептидной связи лежит то, что она на 40% является двойной.
В результате этот вид существует в трех формах:
Кетольная (0,132 нм). Когда взаимодействие между атомами азота и углерода стабилизируется и становится полностью одиночной.
Переходная или мезомерная форма с неопределенными, промежуточными характеристиками.
Енольная (0,127 нм). В этой форме электронная плотность переходит с пептидной на связь между углеродом и кислородом, делая её полностью двойной, вследствие атом кислорода становится заряжен частично отрицательно.
Таким образом, причиной резонанса является делокализованность электронной плотности между азотом и углеродом.
Строение пептидной связи
В итоге электронная плотность пептидной группы смещается к кислороду. В результате такого сопряжения выравниваются длины связей внутри радикала.
Структура и формула отражены на картинке:
Методы определения пептидных связей
Качественной является биуретовая реакция. Такое название она получила, так как впервые была проведена для биурета, хоть и не являющегося аминокислотой, но обладающего двумя пептидными связями.
Принцип определения сводится к тому, что аминокислоты, могущие образовать минимум две пептидные связи, в щелочной среде, при добавлении сульфата меди (II), образуют медьсодержащее комплексное соединение фиолетового цвета.
Комплекс меди с биуретом образуется по схеме:
Заключение
Пептидная связь является основой построения белковых молекул, из которых, в конечном итоге, строятся все живые организмы. Особенности её строения и пространственной конфигурации оказали огромное влияние на саму возможность существования жизни на нашей планете.
Последовательность аминокислот в белке определяется другой важнейшей молекулой – ДНК.
Пептидная связь — это основа первичной структуры белка. Характеристика и образование пептидной связи
Пептидная связь — это прочное соединение между фрагментами двух аминокислот, которое лежит в основе образования линейных структур белков и пептидов. В таких молекулах каждая аминокислота (за исключением концевых) соединяется с предыдущей и последующей.
В зависимости от количества звеньев пептидные связи могут создавать дипептиды (состоят из двух аминокислот), трипептиды (из трех), тетрапептиды, пентапептиды и т. д. Короткие цепочки (от 10 до 50 мономеров) называют олигопептидами, а длинные — полипептидами и белками (мол. масса более 10 тыс. Да).
Характеристика пептидной связи
Пептидная связь — это ковалентное химическое соединение между первым атомом углерода одной аминокислоты и атомом азота другой, возникающее в результате взаимодействия альфа-карбоксильной группы (COOH) с альфа-аминогруппой (NH2). При этом происходит нуклеофильное замещение OH-гидроксила на аминогруппу, от которой отделяется водород. В итоге образуется одинарная C-N связь и молекула воды.
Так как во время реакции происходит потеря некоторых компонентов (ОН-группы и атома водорода), звенья пептида называют уже не аминокислотами, а аминокислотными остатками. Из-за того, что последние содержат по 2 атома углерода, в пептидной цепи происходит чередование С-С и C-N-связей, которые формируют пептидный остов. По бокам от него располагаются аминокислотные радикалы. Расстояние между атомами углерода и азота варьирует от 0,132 до 0,127 нм, что свидетельствует о неопределенной связи.
Пептидная связь — это очень прочный вид химического взаимодействия. При стандартных биохимических условиях, соответствующих клеточной среде, она не подвергается самостоятельному разрушению.
Для пептидной связи белков и пептидов характерно свойство копланарности, поскольку все атомы, участвующие в ее образовании (C, N, O и H), располагаются в одной плоскости. Это явление объясняется жесткостью (т. е. невозможностью вращения элементов вокруг связи), возникающей в результате резонансной стабилизации. В пределах аминокислотной цепи между плоскостями пептидных групп находятся α-углеродные атомы, связанные с радикалами.
Типы конфигурации
В зависимости от положения альфа-углеродных атомов относительно пептидной связи последняя может иметь 2 конфигурации:
Транс-форма характеризуется большей устойчивостью. Иногда конфигурации характеризуют по расположению радикалов, что не меняет сути, поскольку они связаны с альфа-углеродными атомами.
Явление резонанса
Особенность пептидной связи заключается в том, что она на 40% двойная и может находится в трех формах:
Формирование пептидной связи
Формирование пептидной связи — это типичная реакция поликонденсации, которая термодинамически невыгодна. В естественных условиях равновесие смещается в сторону свободных аминокислот, поэтому для осуществления синтеза требуется катализатор, активирующий или модифицирующий карбоксильную группу для более легкого ухода гидроксильной.
В живой клетке образование пептидной связи происходит в белоксинтезирующем центре, где в роли катализатора выступают специфические ферменты, работающие с затратой энергии макроэргических связей.