какую связь имеет вторичная структура белка
Строение белков. Структуры белков
Структуры белков: первичная, вторичная, третичная и четвертичная
Белки
Название «белки» происходит от способности многих из них при нагревании становиться белыми. Название «протеины» происходит от греческого слова «первый», что указывает на их важное значение в организме. Чем выше уровень организации живых существ, тем разнообразнее состав белков.
Белки образуются из аминокислот, которые соединяются между собой ковалентной – пептидной связью: между карбоксильной группой одной аминокислоты и аминогруппой другой. При взаимодействии двух аминокислот образуется дипептид (из остатков двух аминокислот, от греч. пептос – сваренный). Замена, исключение или перестановка аминокислот в полипептидной цепи вызывает возникновение новых белков. Например, при замене лишь одной аминокислоты (глутамина на валин) возникает тяжелая болезнь – серповидно-клеточная анемия, когда эритроциты имеют другую форму и не могут выполнять свои основные функции (перенос кислорода). При образовании пептидной связи отщепляется молекула воды. В зависимости от количества аминокислотных остатков выделяют:
– олигопептиды (ди-, три-, тетрапептиды и т. п.) – содержат до 20 аминокислотных остатков;
– полипептиды – от 20 до 50 аминокислотных остатков;
– белки – свыше 50, иногда тысячи аминокислотных остатков
По физико-химическим свойствам различают белки гидрофильные и гидрофобные.
Существуют четыре уровня организации белковой молекулы – равноценные пространственные структуры (конфигурации, конформации) белков: первичная, вторичная, третичная и четвертичная.
Первичная структура
Первичная структура белков является простейшей. Имеет вид полипептидной цепи, где аминокислоты связаны между собой прочной пептидной связью. Определяется качественным и количественным составом аминокислот и их последовательностью.
Вторичная структура
Вторичная структура образована преимущественно водородными связями, которые образовались между атомами водорода NH-группы одного завитка спирали и кислорода СО-группы другого и направлены вдоль спирали или между параллельными складками молекулы белка. Белковая молекула частично или целиком скручена в α-спираль или образует β-складчатую структуру. Например, белки кератина образуют α-спираль. Они входят в состав копыт, рогов, волос, перьев, ногтей, когтей. β-складчатую имеют белки, которые входят в состав шелка. Извне спирали остаются аминокислотные радикалы (R-группы). Водородные связи значительно более слабые, чем ковалентные, но при значительном их количестве образуют довольно прочную структуру.
Функционирование в виде закрученной спирали характерно для некоторых фибриллярных белков – миозин, актин, фибриноген, коллаген и т. п.
Третичная структура
Третичная структура белка. Эта структура постоянна и своеобразна для каждого белка. Она определяется размером, полярностью R-групп, формой и последовательностью аминокислотных остатков. Полипептидная спираль закручивается и укладывается определенным образом. Формирование третичной структуры белка приводит к образованию особой конфигурации белка – глобулы (от лат. globulus – шарик). Его образование обуславливается разными типами нековалентных взаимодействий: гидрофобные, водородные, ионные. Между остатками аминокислоты цистеина возникают дисульфидные мостики.
Гидрофобные связи – это слабые связи между неполярными боковыми цепями, которые возникают в результате взаимного отталкивания молекул растворителя. При этом белок скручивается так, что гидрофобные боковые цепи погружены вглубь молекулы и защищают ее от взаимодействия с водой, а снаружи расположены боковые гидрофильные цепи.
Третичную структуру имеет большинство белков – глобулины, альбумины и т. п.
Четвертичная структура
Четвертичная структура белка. Образуется в результате объединения отдельных полипептидных цепей. В совокупности они составляют функциональную единицу. Типы связей разные: гидрофобные, водородные, электростатические, ионные.
Электростатические связи возникают между электроотрицательными и электроположительными радикалами аминокислотных остатков.
Для одних белков характерно глобулярное размещение субъединиц – это глобулярные белки. Глобулярные белки легко растворяются в воде или растворах солей. К глобулярным белкам принадлежит свыше 1000 известных ферментов. К глобулярным белкам относятся некоторые гормоны, антитела, транспортные белки. Например, сложная молекула гемоглобина (белка эритроцита крови) является глобулярным белком и состоит из четырех макромолекул глобинов: двух α-цепей и двух β-цепей, каждая из которых соединена с гемом, содержащим железо.
Для других белков характерно объединение в спиральные структуры – это фибриллярные (от лат. fibrilla – волоконце) белки. Несколько (от 3 до 7) α–спиралей свиваются вместе, подобно волокнам в кабеле. Фибриллярные белки нерастворимы в воде.
Белки делят на простые и сложные.
Простые (протеины)
Состоят только из остатков аминокислот. К простым белкам относят глобулины, альбумины, глутелины, проламины, протамины, пистоны. Альбумины (например, альбумин сыворотки крови) растворимы в воде, глобулины (например, антитела) нерастворимы в воде, но растворимы в водных растворах некоторых солей (хлорид натрия и т. п.).
Сложные (протеиды)
Включают в состав, кроме остатков аминокислот, соединения другой природы, которые называются простетическою группой. Например, металлопротеиды – это белки, содержащие негеминовое железо или связанные атомами металлов (большинство ферментов), нуклеопротеиды – белки, соединенные с нуклеиновыми кислотами (хромосомы и т. п.), фосфопротеиды –белки, в состав которых входят остатки фосфорной кислоты (белки яичного желтка и т. п.), гликопротеиды –белки в соединении с углеводами (некоторые гормоны, антитела и т. п.), хромопротеиды – белки, содержащий пигменты (миоглобин и т. п.), липопротеиды – белки, содержащие липиды (входят в состав мембран).
Строение и функции белков
Белки (протеины) составляют 50% от сухой массы живых организмов.
Белки состоят из аминокислот. У каждой аминокислоты есть аминогруппа и кислотная (карбоксильная) группа, при взаимодействии которых получается пептидная связь, поэтому белки еще называют полипептидами.
Структуры белка
Первичная – цепочка из аминокислот, связанных пептидной связью (сильной, ковалентной). Чередуя 20 аминокислот в разном порядке, можно получать миллионы разных белков. Если поменять в цепочке хотя бы одну аминокислоту, строение и функции белка изменятся, поэтому первичная структура считается самой главной в белке.
Вторичная – спираль. Удерживается водородными связями (слабыми).
Третичная – глобула (шарик). Четыре типа связей: дисульфидная (серный мостик) сильная, остальные три (ионные, гидрофобные, водородные) – слабые. Форма глобулы у каждого белка своя, от нее зависят функции. При денатурации форма глобулы меняется, и это сказывается на работе белка.
Четвертичная – имеется не у всех белков. Состоит из нескольких глобул, соединенных между собой теми же связями, что и в третичной структуре. (Например, гемоглобин.)
Денатурация
Это изменение формы глобулы белка, вызванное внешними воздействиями (температура, кислотность, соленость, присоединение других веществ и т.п.)
Функции белков
Их очень много, например:
Еще можно почитать
Задания части 1
Выберите один, наиболее правильный вариант. Вторичная структура молекулы белка имеет форму
1) спирали
2) двойной спирали
3) клубка
4) нити
Выберите один, наиболее правильный вариант. Водородные связи между СО- и NН-группами в молекуле белка придают ей форму спирали, характерную для структуры
1) первичной
2) вторичной
3) третичной
4) четвертичной
Выберите один, наиболее правильный вариант. Четвертичная структура молекулы белка образуется в результате взаимодействия
1) участков одной белковой молекулы по типу связей S-S
2) нескольких полипептидных нитей, образующих клубок
3) участков одной белковой молекулы за счет водородных связей
4) белковой глобулы с мембраной клетки
Выберите один, наиболее правильный вариант. Последовательность и число аминокислот в полипептидной цепи – это
1) первичная структура ДНК
2) первичная структура белка
3) вторичная структура ДНК
4) вторичная структура белка
Выберите один, наиболее правильный вариант. Вторичная структура белка, имеющая форму спирали, удерживается связями
1) пептидными
2) ионными
3) водородными
4) ковалентными
Выберите один, наиболее правильный вариант. Первичная структура белка образована связью
1) водородной
2) макроэргической
3) пептидной
4) ионной
Выберите один, наиболее правильный вариант. В основе образования пептидных связей между аминокислотами в молекуле белка лежит
1) принцип комплементарности
2) нерастворимость аминокислот в воде
3) растворимость аминокислот в воде
4) наличие в них карбоксильной и аминной групп
БЕЛКИ
1. Выберите три варианта. Белки в организме человека и животных
1) составляют бо́льшую часть организма по массе
2) начинают расщепляться в ротовой полости
3) не содержат фосфора в составе молекулы
4) могут откладываться в запас
5) в качестве ферментов ускоряют химические реакции
6) служат основным строительным материалом
2. Выберите три верных ответа из шести и запишите цифры, под которыми они указаны. Выберите только особенности строения белковой молекулы.
1) содержит атомы фосфора
2) состоит из аминокислот
3) мономеры удерживаются пептидными связями
4) состоит из одинаковых по строению мономеров
5) изменяет форму под действием температуры
6) четвертичная структура состоит из нескольких молекул
БЕЛКИ КРОМЕ
1. Все перечисленные признаки, кроме двух, можно использовать при описании яичного белка альбумина. Определите два признака, «выпадающие» из общего списка, и запишите цифры, под которыми они указаны.
1) состоит из аминокислот
2) пищеварительный фермент
3) денатурирует обратимо при варке яйца вкрутую
4) мономеры связаны пептидными связями
5) молекула образует первичную, вторичную и третичную структуры
2. Все перечисленные ниже признаки, кроме двух, можно использовать для описания молекулы белка. Определите два признака, «выпадающих» из общего списка, и запишите цифры, под которыми они указаны.
1) состоит из нуклеотидов
2) может иметь форму глобулы
3) имеет третичную и четвертичную структуры
4) образуется в ядре
5) бывают глобулярные и фибриллярные
БЕЛКИ КРОМЕ РИС
1. Перечисленные ниже признаки, кроме двух, используются для описания строения, функций изображенного органического вещества. Определите два признака, «выпадающие» из общего списка, и запишите цифры, под которыми они указаны.
1) имеет структурные уровни организации молекулы
2) входит в состав клеточных стенок
3) является биополимером
4) служит матрицей при трансляции
5) состоит из аминокислот

2. Все перечисленные ниже признаки, кроме двух, используются для описания изображённой на рисунке структуры. Определите два признака, «выпадающие» из общего списка, и запишите цифры, под которыми они указаны.
1) вторичная структура молекулы белка
2) удерживается только пептидными связями
3) определяется методом рентгеноструктурного анализа
4) представляет собой глобулу
5) может выполнять ферментативные функции

3. Все перечисленные ниже характеристики, кроме двух, используют для описания изображенной на рисунке молекулы органического вещества клетки. Определите две характеристики, «выпадающие» из общего списка, и запишите цифры, под которыми они указаны.
1) денатурация
2) репликация
3) транскрипция
4) аминокислоты
5) водородные связи
СТРУКТУРЫ БЕЛКА
Установите соответствие между характеристикой и структурой белка: 1) первичная, 2) третичная. Запишите цифры 1 и 2 в порядке, соответствующем буквам.
А) молекула в форме глобулы или фибриллы
Б) строгая последовательность аминокислотных остатков
В) аминокислотные остатки соединены только пептидными связями
Г) имеет дисульфидные мостики между радикалами аминокислот
Д) при ее разрушении наступает необратимая денатурация
Е) пространственная конфигурация полипептидной цепи
ФЕРМЕНТАТИВНАЯ
1. Все приведенные ниже признаки, кроме двух, можно использовать для описания ферментов. Определите два признака, «выпадающих» из общего списка, и запишите цифры, под которыми они указаны.
1) входят в состав клеточных мембран и органоидов клетки
2) играют роль биологических катализаторов
3) имеют активный центр
4) оказывают влияние на обмен веществ, регулируя различные процессы
5) специфические белки
2. Выберите три верных ответа из шести и запишите цифры, под которыми они указаны. Ферменты – это вещества, которые
1) вырабатываются в железах внутренней секреции
2) являются белками
3) поступают в организм, как правило, вместе с пищей
4) являются в организме источником энергии
5) ускоряют протекание химических реакций
6) у человека выполняют свои функции при температуре около 36 градусов
ФУНКЦИИ БЕЛКОВ
Выберите три верных ответа из шести и запишите цифры, под которыми они указаны. Функциями белков в организме человека являются
1) строительная
2) передача наследственных признаков
3) защитная
4) запасающая
5) ферментативно-каталитическая
6) хранение генетической информации
ФУНКЦИИ БЕЛКОВ КРОМЕ
Все перечисленные характеристики используют для описания функций белков. Определите две характеристики, «выпадающие» из общего списка, и запишите цифры, под которыми они указаны.
1) регуляторная
2) двигательная
3) рецепторная
4) образуют клеточные стенки
5) служат коферментами

Рассмотрите рисунок с изображением полипептида и укажите (А) уровень его организации, (Б) форму молекулы и (В) вид взаимодействия, поддерживающий эту структуру. Для каждой буквы выберите соответствующий термин или соответствующее понятие из предложенного списка.
1) первичная структура
2) вторичная структура
3) третичная структура
4) взаимодействия между нуклеотидами
5) металлическая связь
6) гидрофобные взаимодействия
7) фибриллярная
8) глобулярная

Рассмотрите схему химического вещества. Укажите (А) название класса органических веществ, (Б) уровень организации полимерной молекулы и (В) название мономеров, из которых состоит данная молекула. Для каждой буквы выберите соответствующий термин из предложенного списка.
1) ДНК
2) белок
3) альфа-спираль
4) вторичная структура
5) третичная структура
6) аминокислоты
7) нуклеотиды
8) рибоза

Рассмотрите рисунок с изображением полипептида. Укажите (А) уровень его организации, (Б) мономеры, которые его образуют, и (В) вид химических связей между ними. Для каждой буквы выберите соответствующий термин или соответствующее понятие из предложенного списка.
1) первичная структура
2) водородные связи
3) двойная спираль
4) вторичная структура
5) аминокислота
6) альфа-спираль
7) нуклеотид
8) пептидные связи

Проанализируйте таблицу «Уровни организации белка». Для каждой ячейки, обозначенной буквой, выберите соответствующий термин из предложенного списка.
1) глобула
2) двойная спираль
3) эфирные
4) гидрофильные
5) пептидные
6) нитчатая
7) вторичная
8) четвертичная
Известно, что белки – нерегулярные полимеры, имеющие высокую молекулярную массу, строго специфичны для каждого вида организма. Выберите из приведенного ниже текста три утверждения, по смыслу относящиеся к описанию этих признаков, и запишите цифры, под которыми они указаны. (1) В состав белков входит 20 различных аминокислот, соединенных пептидными связями. (2) Белки имеют различное количество аминокислот и порядок их чередования в молекуле. (3) Низкомолекулярные органические вещества имеют молекулярную массу от 100 до 1000. (4) Они являются промежуточными соединениями или структурными звеньями – мономерами. (5) Многие белки характеризуются молекулярной массой от нескольких тысяч до миллиона и выше, в зависимости от количества отдельных полипептидных цепей в составе единой молекулярной структуры белка. (6) Каждый вид живых организмов имеет особый, только ему присущий набор белков, отличающий его от других организмов.
Фиброин
Свойства
Фиброин является гетеродимером, образованным двумя белковыми цепями. Его первичная структура состоит из повторяющейся аминокислотной последовательности (Gly-Ser-Gly-Ala-Gly-Ala) n.
В свою очередь, повторяющиеся аминокислотные последовательности образуют антипараллельные складчатые β-слои, связанные водородными связями. Эта структура обуславливает высокий предел прочности нитей паутин и шелка. Более прочный, чем кевлар, фиброин вдобавок ещё и высоко эластичен. Эти качества делают его материалом, применяемым в различных областях, включая биомедицину и текстильное производство.
Структуры
Структура белка
По вторичной структуре белка семейство кератинов разделяется на две группы:
Для первичной структуры α-кератинов характерно большое содержание цистеина и множество дисульфидных связей.
В отличие от α-кератинов поперечные дисульфидные связи между соседними полипептидными цепями у β-кератинов отсутствуют. В полипептидной цепи каждый второй элемент — глицин. Характерно повторение последовательности «GSGAGA».
Для α-кератинов основным структурным компонентом являются цилиндрические микрофибриллы диаметром 75 А, состоящие из спирализованных, скрученных попарно протофибрилл.
Параграф 58. белки вторичная и третичная структура
Автор текста – Анисимова Елена Сергеевна.
Авторские права защищены. Продавать текст нельзя. Курсив НЕ НУЖНО зубрить.
Замечания можно присылать по почте: exam_bch@mail.ru
https://vk.com/bch_5
ПАРАГРАФ 58:
«ВТОРИЧНАЯ И ТРЕТИЧНАЯ СТРУКТУРА белков».
(См. сначала п.56 и п.57.)
Полипептидная цепь (ППЦ) способна формировать в пространстве определённую структуру за счёт взаимодействия атомов;
эти структуры получили название вторичной и третичной структуры (см. далее).
58.1. ВТОРИЧНАЯ СТРУКТУРА БЕЛКА.
Один из самых распространённых способов изменить конформацию и активность молекул белков – это присоединение и отщепление фосфатной группы. Эти реакции осуществляются под действием ферментов протеинкиназ и протеинфосфатаз (активность которых, в свою очередь, регулируется гормонами).
Присоединение фосфата меняет конформацию белковой молекулы потому, что фосфат имеет отрицательный заряд; присоединие фосфата приводит к тому, что к его отрицательному заряду притягиваются положительно заряженные радикалы, а отрицательно заряженные радикалы отталкиваются от отрицательного заряда фосфата.
Кратко – изменение конформации белка приводит к изменению активности белка (так как приводит к исчезновению или к появлению активного центра). Причиной изменений конформации белка является изменение условий среды, в которой находится белок, или изменение химического состава белка.
58.5. Денатурация. См. параграф 3.
Это потеря активности белка в результате разрушения третичной (или четвертичной) структуры. При этом ППЦ не разрушается, первичная структура сохраняется.
Почему происходит потеря активности – потому что при разрушении третичной структуры исчезают активные центры – из-за того, что отдаляются друг от друга РАДИКАЛЫ, формировавшие активный центр.
Под действием чего происходит денатурация и почему? – Под действием факторов, которые называют денатураторами. Примеры денатураторов:
ВЫСОКАЯ ТЕМПЕРАТУРА (нагревание; повышение температуры тела выше 37 градусов),
повышение или ПОНИЖЕНИЕ рН в результате появления кислот или щелочей (отклонение от оптимального для данного белка рН, который для большинства белков – около 7),
определённые излучения (например, РАДИАЦИЯ), определённые химические вещества, особенно гидрофобные, растворители и т.д.
Все денатураторы (например, высокая температура) ПОТЕНЦИАЛЬНО ОПАСНЫ для организма именно потому, что приводят к потере активности белков, что приводит к нарушению процессов в организме и гибели клеток.
При исчезновении денатурирующего фактора ППЦ иногда могут снова сформировать третичную структуру, что может привести к возвращению активности белка.
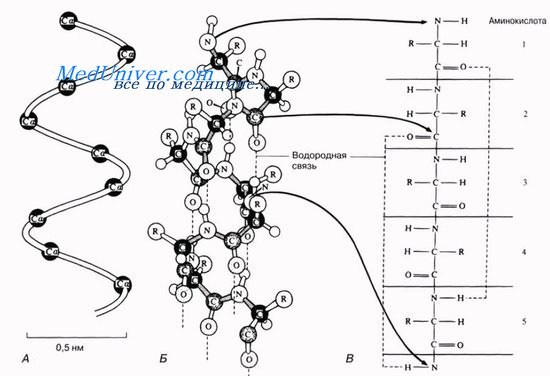
Какую связь имеет вторичная структура белка
Для всякого белка характерна, помимо первичной, еще и определенная вторичная структура. Обычно белковая молекула напоминает растянутую пружину.
Это так называемая а-спираль, стабилизируемая множеством водородных связей, возникающих между находящимися поблизости друг от друга СО- и NH-группами. Атом водорода NH-группы одной аминокислоты образует такую связь с атомом кислорода СО-группы другой аминокислоты, отстоящей от первой на четыре аминокислотных остатка.
Таким образом аминокислота 1 оказывается связанной с аминокислотой 5, аминокислота 2 — с аминокислотой 6 и т. д. Рентгеноструктурный анализ показывает, что на один виток спирали приходится 3,6 аминокислотного остатка.
Полностью а-спиральную конформацию и, следовательно, фибриллярную структуру имеет белок кератин. Это структурный белок волос, шерсти, ногтей, клюва, перьев и рогов, входящий также в состав кожи позвоночных.
Твердость и растяжимость кератина варьируют в зависимости от числа дисульфидных мостиков между соседними полипептидными цепями (от степени сшивки цепей).
Теоретически все СО- и NH-группы могут участвовать в образовании водородных связей, так что а-спираль — это очень устойчивая, а потому и весьма распространенная конформация. Участки а-спирали в молекуле напоминают жесткие стержни. Тем не менее большинство белков существует в глобулярной форме, в которой также имеются участки (3-слоя (см. ниже) и участки с нерегулярной структурой.
Объясняется это тем, что образованию водородных связей препятствует ряд факторов: наличие некоторых аминокислотных остатков в полипептидной цепи, наличие дисульфидных мостиков между различными участками одной и той же цепи и, наконец, тот факт, что аминокислота пролин вообще неспособна образовывать водородные связи.
Бета-Слой, или складчатый слой — это другой тип вторичной структуры. Белок шелка фиброин, выделяемый шелкоотделительными железами гусениц шелкопряда при завивке коконов, представлен целиком именно этой формой. Фиброин состоит из ряда полипептидных цепей, вытянутых сильнее, чем цепи с конформацией альфа-спирали.
Эти цепи уложены параллельно, но соседние цепи по своему направлению противоположны одна другой (антипараллельны). Они соединены друг с другом при помощи водородных связей, возникающих между С=0- и NH-группами соседних цепей. В этом случае в образовании водородных связей также принимают участие все NH- и С=0-группы, т. е. структура тоже весьма стабильна.
Такая конформация полипептидных цепей называется бета-конформацией, а структура в целом — складчатым слоем. Фиброин обладает высокой прочностью на разрыв и не поддается растяжению, но подобная организация полипептидных цепей делает шелк очень гибким. В глобулярных белках полипептидная цепь может складываться на себя, и тогда в этих точках глобулы возникают участки, имеющие структуру складчатого слоя.
Еще один способ организации полипептидных цепей мы находим у фибриллярного белка коллагена. Это тоже структурный белок, обладающий подобно кератину и фиброину высокой прочностью на разрыв. У коллагена три полипептидные цепи свиты вместе, как пряди в канате, образуя тройную спираль. В каждой полипептидной цепи этой сложной спирали, называемой тропоколлагеном, содержится около 1000 аминокислотных остатков. Отдельная полипептидная цепь представляет собой свободно свернутую спираль (но не а-спираль;).
Три цепи удерживаются вместе водородными связями. Из многих тройных спиралей, располагающихся параллельно друг другу и удерживаемых вместе ковалентными связями между соседними цепями, образуются фибриллы. Они в свою очередь объединяются в волокна. Структура коллагена формируется, таким образом, поэтапно — на нескольких уровнях — подобно структуре целлюлозы. Коллаген также невозможно растянуть, и это его свойство существенно для той функции, которую он выполняет, например, в сухожилиях, костях и других видах соединительной ткани.
Белки, существующие только в полностью спирализованной форме, подобно кератину и коллагену, представляют собой исключение среди прочих белков.