какую роль в синтезе белка играют рибосомы
Строение и функции рибосом. Биосинтез белков и значение рибосом для организма
Рибосомы — субмикроскопические немембранные органеллы, необходимые для синтеза белка. Они объединяют аминокислоты в пептидную цепь, образуя новые белковые молекулы. Биосинтез осуществляется по матричной РНК путем трансляции.
Особенности строения
Рибосомы находятся на гранулярном эндоплазматическом ретикулуме или свободно плавают в цитоплазме. Крепятся они к эндоплазматической сети своей большой субъединицей и синтезируют белок, который выводится за пределы клетки, используется всем организмом. Цитоплазменные рибосомы в основном обеспечивают внутренние потребности клетки.
Форма шаровидная или овальная, в диаметре около 20нм.
На этапе трансляции к мРНК может прикрепляться несколько рибосом, образуя новую структуру – полисому. Сами же они образуются в ядрышке, внутри ядра.
Выделяют 2 вида рибосом:
Строение обоих видов идентичное. В состав рибосомы входят две субъединицы — большая и малая, которые в сочетании напоминают гриб. Объединяются они при помощи ионов магния, сохраняя между соприкасающимися поверхностями небольшую щель. При дефиците магния субъединицы отдаляются, происходит дезагрегация и рибосомы уже не могут выполнять свои функции.
Химический состав
Рибосомы состоят из высокополимерной рибосомальной РНК и белка в соотношении 1:1. В них сосредоточено примерно 90% всей клеточной РНК. Малая и большая субъединицы содержат около четырех молекул рРНК, которая имеет вид нитей собранных в клубок. Окружены молекулы белками и формируют вместе рибонуклеопротеид.
Полирибосомы – это объединение информационной РНК и рибосом, которые нанизываются на нить иРНК. В период отсутствия синтезирующих процессов, рибосомы разъединяются и обмениваются субъединицами. При поступлении иРНК они снова собираются в полирибосомы.
Количество рибосом может изменяться в зависимости от функциональной нагрузки на клетку. Десятки тысяч находятся в клетках с высокой митотической активностью (меристема растений, стволовые клетки).
Образование в клетке
Субъединицы рибосом формируются в ядрышке. Матрицей для синтеза рибосомальной РНК является ДНК. Для полного созревания они проходят несколько этапов:
Биосинтез белков на рибосомах
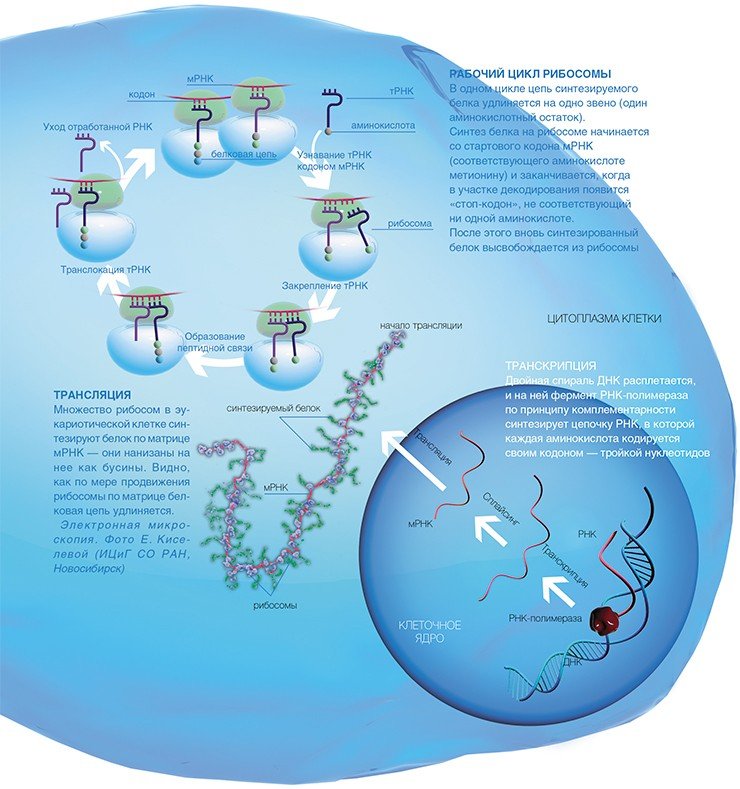
Трансляция или синтез белков на рибосомах с матрицы иРНК – конечный этап преобразования генетической информации в клетках. Во время трансляции информация, закодированная в нуклеиновых кислотах, переходит в белковые молекулы со строгой последовательностью аминокислот.
Трансляция – весьма непростой этап (в сравнении с репликацией и транскрипцией). Для проведения трансляции в процесс включаются все виды РНК, аминокислот, множество ферментов, которые могут исправлять погрешности друг друга. Самые важные участники трансляции – это рибосомы.
После транскрипции, новообразованная молекула иРНК, выходит из ядра в цитоплазму. Здесь после нескольких преобразований она соединяется с рибосомой. При этом аминокислоты приводятся в действие после взаимодействия с энергетическим субстратом – молекулой АТФ.
Аминокислоты и иРНК имеют разный химический состав и без постороннего участия не могут взаимодействовать между собой. Для преодоления этой несовместимости существует транспортная РНК. Под действием ферментов аминокислоты соединяются с тРНК. В таком виде они переносятся на рибосому и тРНК, с определенной аминокислотой, прикрепляется на иРНК в предназначенном месте. Далее рибосомальные ферменты формируют пептидную связь между присоединенной аминокислотой и строящимся полипептидом. После рибосома перемещается по цепи информационной РНК, оставляя участок для прикрепления следующей аминокислоты.
Рост полипептида идет до того момента, пока рибосома не встретит «стоп-кодон», который сигнализирует об окончании синтеза. Для освобождения новосинтезированного пептида от рибосомы включаются факторы терминации, окончательно завершающие биосинтез. К последней аминокислоте прикрепляется молекула воды, а рибосома распадается на две субъединицы.
Когда рибосома продвигается дальше по иРНК, она освобождает начальный отрезок цепи. К нему снова может присоединиться рибосома, которая начнет новый синтез. Таким образом, используя одну матрицу для биосинтеза, рибосомы создают одномоментно множество копий белка.
Роль рибосом в организме
Биосинтез белка в митохондриях
Хотя изолированные митохондрии активно синтезируют белок, из них не удается получить эффективные бесклеточные системы трансляции. Это сдерживает исследование молекулярных механизмов трансляции в митохондриях, и имеется мало информации относительно факторов трансляции, участвующих в синтезе митохондриальных белков.
Одной из особенностей биосинтеза белка в митохондриях является малое число видов рРНК и тРНК, вовлеченных в этот процесс. Остается непонятным, каким образом миторибосомы распознают инициирующие кодоны. Поскольку митохондриальные мРНК лишены 5’UTR, которые характерны для бактериальных и ядерных мРНК, взаимодействие миторибосом с инициирующими кодонами должно определяться другими принципами, отличающимися от сканирования цитоплазматическими рибосомами эукариот или от взаимодействий TIR-последовательностей мРНК с 16S рРНК у бактерий. Низкая эффективность трансляции митохондриальных мРНК in vitro может быть следствием строения их 5′-концевых последовательностей, и для осуществления биосинтеза митохондриального белка на приемлемом уровне требуется присутствие мРНК в высоких концентрациях, что и имеет место в нативных митохондриях.
В бесклеточных системах было показано, что 28S субчастица миторибосом прочно связывается с мРНК независимо от последовательности нуклеотидов в отсутствие дополнительных факторов и инициаторной тРНК, что отличает ее от субчастиц других про- и эукариотических рибосом. Для ее эффективного взаимодействия с мРНК длина полинуклеотида должна быть
400 нуклеотидов, тогда как сама субчастица защищает от действия РНКазы T1 участок мРНК длиной в 30-80 нуклеотидов. Возможно, это объясняет, почему самые короткие ОРС мтДНК являются перекрывающимися, так как благодаря такому строению соответствующие мРНК приобретают размеры, необходимые для оптимального взаимодействия с малой субчастицей миторибосом. Полагают, что после взаимодействия с мРНК малая субчастица при участии еще не идентифицированных факторов трансляции перемещается к инициирующему кодону на 5′-конце матрицы.
Единственным охарактеризованным митохондриальным фактором инициации трансляции является mtIF2, который обеспечивает GTP- зависимое вхождение инициаторной формилметионил-тРНК (fMet-тРНК) в комплекс, образованный малой субчастицей миторибосом и мРНК. Вероятно, гидролиз GTP сопровождается освобождением mtIF2 из тройного комплекса с последующим соединением малой и большой (39S) субчастиц миторибосом с образованием комплекса, способного к элонгации полипептидных цепей.
Из печени быка выделены три фактора элонгации трансляции: mtEF-Tu, mtEF-Ts и mtEF-G, которые обладают высокой гомологией с соответствующими прокариотическими факторами. Полагают, что механизм элонгации полипептидных цепей в митохондриях соответствует таковому E.coli. В отличие от бактериальных факторов EF-Tu и EF-Ts факторы митохондрий образуют друг с другом более прочный комплекс, для диссоциации которого недостаточно присутствия только GTP, однако комплекс диссоциирует при наличии в бесклеточных системах GTP и аминоацилированной тРНК.
Внимание! Информация на сайте www.humbio.ru предназначена исключительно для образовательных и научных целей.
Информационная поддержка: ООО «Лайт Телеком»
Остановимся подробнее на механизме работы рибосомы. Рибосома во время движения по и-РНК в каждый данный момент находится в контакте с небольшим учаством ее молекулы. Возможно, размер этого участка составляет всего один триплет нуклеотидов. Рибосома передвигается по и-РНК не плавно, а прерывисто, «шажками», триплет за триплетом. На некотором расстоянии от места контакта рибосомы с и-РЕК находится пункт «сборки» белка: здесь помещается и работает фермент белок-синтетаза, создающий полипептидную цепь, т. е. образующий пептидные связи между аминокислотами.
Рибосомы, их структура и роль в синтезе белка
Вы будете перенаправлены на Автор24
Строение рибосом
Рибосомы – это субмикроскопические немебранные органеллы, основной функцией которых является биосинтез белка.
Они объединяют аминокислоты в пептидную цепь и формируют новые молекулы белка, которые необходимы клетке для осуществления всех процессов жизнедеятельности.
Биосинтез белка в данном случае осуществляется по матричной РНК путем процесса трансляции.
Рибосомы имеют несколько ключевых особенностей строения:
Рибосома имеет шаровидную форму и диаметр около 20 нм. В процессе трансляции к матричной РНК может прикрепиться сразу несколько рибосом, формируя структуру – полисому. Рибосомы образуются в ядрышке, во внутреннем пространстве ядра.
Существует два вида рибосом:
Рисунок 1. Схема строения рибосомы. Автор24 — интернет-биржа студенческих работ
Строение обоих видов рибосом идентичное. Они состоят из двух субъединиц: большой и малой. Эти части объединяются при помощи ионов магния, а между соприкасающимися поверхностями остается лишь небольшая щель. При дефиците магния субъединицы отдаляются, происходит дезагрегация и рибосомы уже не могут выполнять свои функции.
Готовые работы на аналогичную тему
Химический состав рибосомы также оригинален. Рибосомы состоят из высокополимерной рибосомальной РНК. Также в их составе выделяют белок. Обе субъединицы содержат около 4 молекул РНК, они имеют вид нитей, которые собраны в РНК. Эти нити окружаются белками и формируют комплексный рибонуклеопротеид.
Также рибосомы могут объединяться в специализированные комплексы полирибосомы.
Полирибосомы – это объединение информационной РНК и рибосом, которые нанизываются на ее нить. В ходе синтезирующих процессов рибосомы разъединяются и обмениваются субъединицами. В момент поступления т-РНК они снова собираются в полирибосому.
Роль рибосом в процессе биосинтеза белка
Количество рибосом может поменяться в зависимости от функциональной нагрузки на клетку. Когда клетка вступает в период митотической активности и в ней в этот период можно обнаружить десятки тысяч рибосом. Такое количество характерно для меристем растений, а также стволовых клеток.
Рибосомы определенным образом образуются в клетке. Они формируются в ядрышке и матрицей для их создания является ДНК. До полного созревания они проходят несколько ключевых этапов:
Каждый элемент рибосомы выполняет собственную уникальную функцию. Большая субъединица выполняет функции трансляции, декодирования генетической информации. Малая субъединица в свою очередь отвечает за объединение аминокислот, создание пептидных связей и синтез новых молекул белка.
Трансляция – это процесс синтеза белка на рибосомах или конечный этап преобразования генетической информации в клетке. В процессе трансляции информация закодирована в нуклеиновых кислотах и переходит в белковые молекулы, которые обладают строгой аминокислотной последовательностью.
Трансляция представляет собой достаточно непростой этап в формировании белковой молекулы. Для проведения трансляции в процесс включаются все виды РНК, аминокислот, множество ферментов, которые могут исправлять погрешности друг друга. Самые важные участники трансляции – это рибосомы.
После транскрипции новая молекула и – РНК выходит из ядра в цитоплазму, потом происходит несколько преобразований, и она соединяется с рибосомой. Аминокислоты начинают действовать после соединения с энергетическим субстратом ДНК.
Так как аминокислоты имеют различный состав РНК (химический). Без постороннего участия их процесс взаимодействия между собой становится невозможным. Чтобы преодолеть подобную несовместимость существует молекула транспортной РНК. Процесс соединения всех типов аминокислот становится возможным благодаря действию различных ферментов. В дальнейшем все рибосомальные ферменты участвуют в образовании пептидной связи. Далее запускается процесс перемещения рибосомы по цепи и – РНК. При этом остается участок для прикрепления новой аминокислоты.
В дальнейшем происходит рост полипептида, но до того момента, пока рибосома не встретит «стоп – кодон», который является сигналом к окончанию процесса синтеза. Для того, чтобы пептид смог освободиться от рибосомы, включаются факторы терминами, которые уже завершают процесс синтеза окончательно.
Последняя аминокислота прикрепляет к себе молекулу воды, а рибосома распадается на две субъединицы. В процессе продвижения рибосомы по и- РНК, она освобождает начальный отрезок цепи. К нему снова может прицепиться рибосома, и процесс биосинтеза белка запуститься снова.
Тем самым на одной матрице для биосинтеза происходит создание множества копий белка в течение одного момента времени.
Рибосомы важны для биосинтеза белка, поскольку они создают его для нужд самой клетки и за ее пределами.
Например, в печени создаются плазменные факторы свертывания крови. Также рибосомы выполняют своего рода каталитическую функцию при формировании пептидных связей в молекуле вновь созданного белка.
Активация функций рибосом происходит в тот момент, когда они объединяются в полирибосомы. Эти комплексы могут формировать одновременно несколько молекул белка.
Что такое биосинтез белка в клетке
В статье мы дадим определение биосинтезу и рассмотрим основные этапы синтеза белков. Разберёмся, чем трансляция отличается от транскрипции.
В клетках непрерывно идут процессы обмена веществ — процессы синтеза и распада веществ. Каждая клетка синтезирует необходимые ей вещества. Этот процесс называется биосинтезом.
Биосинтез — это процесс создания сложных органических веществ в ходе биохимических реакций, протекающих с помощью ферментов. Биосинтез необходим для выживания — без него клетка умрёт.
Одним из важнейших процессов биосинтеза в клетке является процесс биосинтеза белков, который включает в себя особые реакции, встречающиеся только в живой клетке — это реакции матричного синтеза. Матричный синтез — это синтез новых молекул в соответствии с планом, заложенным в других уже существующих молекулах.
Синтез белка в клетке протекает при участии специальных органелл — рибосом. Это немембранные органеллы, состоящие из рРНК и рибосомальных белков.
Последовательность аминокислот в каждом белке определяется последовательностью нуклеотидов в гене — участке ДНК, кодирующем именно этот белок. Соответствие между последовательностью аминокислот в белке и последовательностью нуклеотидов в кодирующих его ДНК и иРНК определяется универсальным правилом — генетическим кодом.
Информация о белке может быть записана в нуклеиновой кислоте только одним способом — в виде последовательности нуклеотидов. ДНК построена из 4 видов нуклеотидов: аденина (А), тимина (Т), гуанина (Г), цитозина (Ц), а белки — из 20 видов аминокислот. Таким образом, возникает проблема перевода четырёхбуквенной записи информации в ДНК в двадцатибуквенную запись белков. Генетический код — соотношения нуклеотидных последовательностей и аминокислот, на основе которых осуществляется такой перевод.
Процесс синтеза белка в клетке можно разделить на два этапа: транскрипция и трансляция.
Транскрипция — первый этап биосинтеза белка
Транскрипция — это процесс синтеза молекулы иРНК на участке молекулы ДНК.
Транскрипция (с лат. transcription — переписывание) происходит в ядре клетки с участием ферментов, основную работу из которых осуществляет транскриптаза. В этом процессе матрицей является молекула ДНК.
Специальный фермент находит ген и раскручивает участок двойной спирали ДНК. Фермент перемещается вдоль цепи ДНК и строит цепь информационной РНК в соответствии с принципом комплементарности. По мере движения фермента растущая цепь РНК матрицы отходит от молекулы, а двойная цепь ДНК восстанавливается. Когда фермент достигает конца копирования участка, то есть доходит до участка, называемого стоп-кодоном, молекула РНК отделяется от матрицы, то есть от молекулы ДНК. Таким образом, транскрипция — это первый этап биосинтеза белка. На этом этапе происходит считывание информации путём синтеза информационной РНК.
Копировать информацию, хотя она уже содержится в молекуле ДНК, необходимо по следующим причинам: синтез белка происходит в цитоплазме, а молекула ДНК слишком большая и не может пройти через ядерные поры в цитоплазму. А маленькая копия её участка — иРНК — может транспортироваться в цитоплазму.
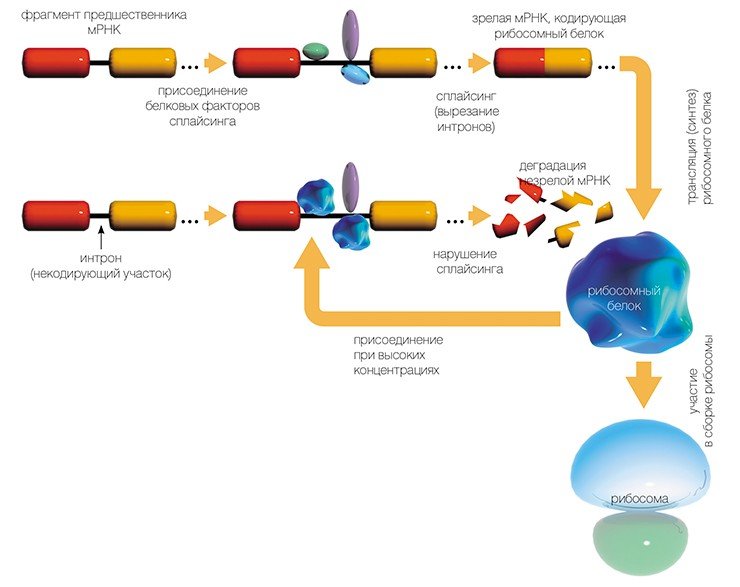
После транскрипции громоздкая молекула ДНК остаётся в ядре, а молекула иРНК подвергается «созреванию» — происходит процессинг иРНК. На её 5’ конец подвешивается КЭП для защиты этого конца иРНК от РНКаз — ферментов, разрушающих молекулы РНК. На 3’ конце достраивается поли(А)-хвост, который также служит для защиты молекулы. После этого проходит сплайсинг — вырезание интронов (некодирующих участков) и сшивание экзонов (информационных участков). После процессинга подготовленная молекула транспортируется из ядра в цитоплазму через ядерные поры.
Транскрипция пошагово:
Проверьте себя: помните ли вы принцип комплементарности? Молекула ДНК состоит из двух спирально закрученных цепей. Цепи в молекуле ДНК противоположно направлены. Остов цепей ДНК образован сахарофосфатными остатками, а азотистые основания одной цепи располагаются в строго определённом порядке напротив азотистых оснований другой — это и есть правило комплементарности.
Трансляция — второй этап биосинтеза белка
Трансляция — это перевод информации с языка нуклеотидов на язык аминокислот.
Что же происходит в клетке? Трансляция представляет собой непосредственно процесс построения белковой молекулы из аминокислот. Трансляция происходит в цитоплазме клетки. В трансляции участвуют рибосомы, ферменты и три вида РНК: иРНК, тРНК и рРНК. Главным поставщиком энергии при трансляции служит молекула АТФ — аденозинтрифосфорная кислота.
Во время трансляции нуклеотидные последовательности информационной РНК переводятся в последовательность аминокислот в молекуле полипептидной цепи. Этот процесс идёт в цитоплазме на рибосомах. Образовавшиеся информационные РНК выходят из ядра через поры и отправляются к рибосомам. Рибосомы — уникальный сборочный аппарат. Рибосома скользит по иРНК и выстраивает из определённых аминокислот длинную полимерную цепь белка. Аминокислоты доставляются к рибосомам с помощью транспортных РНК. Для каждой аминокислоты требуется своя транспортная РНК, которая имеет форму трилистника. У неё есть участок, к которому присоединяется аминокислота и другой триплетный антикодон, который связывается с комплементарным кодоном в молекуле иРНК.
Цепочка информационной РНК обеспечивает определённую последовательность аминокислот в цепочке молекулы белка. Время жизни информационной РНК колеблется от двух минут (как у некоторых бактерий) до нескольких дней (как, например, у высших млекопитающих). Затем информационная РНК разрушается под действием ферментов, а нуклеотиды используются для синтеза новой молекулы информационной РНК. Таким образом, клетка контролирует количество синтезируемых белков и их тип.
Трансляция пошагово:
По промокоду BIO92021 вы получите бесплатный доступ к курсу биологии 9 класса. Выберите нужный раздел и изучайте биологию вместе с домашней онлайн-школой «Фоксфорда»!
Резюме
Теперь вы знаете, что биосинтез необходим для выживания — без него клетка умрёт. Процесс биосинтеза белков включает в себя особые реакции, встречающиеся только в живой клетке, — это реакции матричного синтеза.
Синтез белка состоит из двух этапов: транскрипции (образование информационной РНК по матрице ДНК, протекает в ядре клетки) и трансляции (эта стадия проходит в цитоплазме клетки на рибосомах). Эти этапы сменяют друг друга и состоят из последовательных процессов.
Рибосома – минифабрика по производству белков
Одним из наиболее сложных процессов, осуществляемых живыми существами, является, пожалуй, синтез белков — важнейших структурных и функциональных «кирпичиков» любого организма. Подлинное понимание молекулярных процессов, лежащих в его основе, могло бы пролить свет на неимоверно давние события, связанные с тайной зарождения самой Жизни.
Во всех живых организмах, от простейших бактерий до человека, белки синтезируются специальными клеточными устройствами рибосомами. На этих уникальных фабриках происходит образование белковой цепи из отдельных аминокислот.
В клетках, ведущих интенсивный белковый синтез, рибосом очень много: так, в одной бактериальной клетке содержится около 10 тыс. этих минифабрик, составляющих до 30% общей сухой массы клетки! В клетках высших организмов рибосом содержится меньше — их число зависит от типа ткани и уровня метаболизма клетки.
Рибосома синтезирует белок со средней скоростью 10—20 аминокислот в секунду. Точность трансляции исключительно высока — ошибочное включение «неправильного» аминокислотного остатка в цепь белка составляет в среднем одну аминокислоту на 3 тыс. звеньев (при средней длине белковой цепи у человека в 500 аминокислотных остатков), т. е. всего одна ошибка на шесть белков.
О генетическом коде
Программа, задающая последовательность аминокислотных остатков в белке, записана в геноме клетки: около полувека назад было установлено, что аминокислотные последовательности всех белков непосредственно закодированы в ДНК с помощью так называемого генетического кода. Согласно этому коду, универсальному для всех живых организмов, каждой из двадцати существующих аминокислот соответствует свой кодон — тройка нуклеотидов, представляющих собой элементарные единицы цепочки ДНК. Любой белок закодирован в ДНК определенной последовательностью кодонов. Эта последовательность называется геном.
Одна клетка может содержать до 10 тыс. рибосом — белковых минифабрик, составляющих до 30% сухой клеточной массы
Как же эта генетическая информация доходит до рибосомы? На отдельном гене, как на матрице, синтезируется цепь еще одной информационной молекулы — рибонуклеиновой кислоты (РНК). Этот процесс копирования гена, называемый транскрипцией, осуществляется специальными ферментами — РНК-полимеразами.
Но РНК, полученная таким образом, еще не является матрицей для синтеза белка: из нее, вырезаются определенные «некодирующие» куски нуклеотидной последовательности (процесс сплайсинга).
Точность белкового синтеза рибосомой исключительно высока — у человека ошибка составляет один на три тысячи «неправильный» аминокислотный остаток
В результате получается матричная РНК (мРНК), которая и используется рибосомами в качестве программы для синтеза белка. Сам синтез, т.е. перевод генетической информации с языка нуклеотидной последовательности мРНК на язык аминокислотной последовательности белка, называется трансляцией.
Декодирование и синтез
В клетках эукариот одну мРНК обычно транслирует сразу множество рибосом, образуя так называемые полисомы, которые можно отчетливо видеть с помощью электронной микроскопии, позволяющей получать увеличение в десятки тысяч раз.
Как поступают в рибосому аминокислоты, являющиеся строительными кирпичиками для синтеза белка? Еще в 50-х годах прошлого столетия были открыты особые «перевозчики», доставляющие аминокислоты в рибосому, — короткие (длиной менее 80 нуклеотидов) транспортные РНК (тРНК). Специальный фермент присоединяет аминокислоту к одному из концов тРНК, причем каждой аминокислоте соответствует строго определенная тРНК. Синтез белка на рибосоме включает три основные стадии: начало, удлинение полипептидной цепи и окончание.
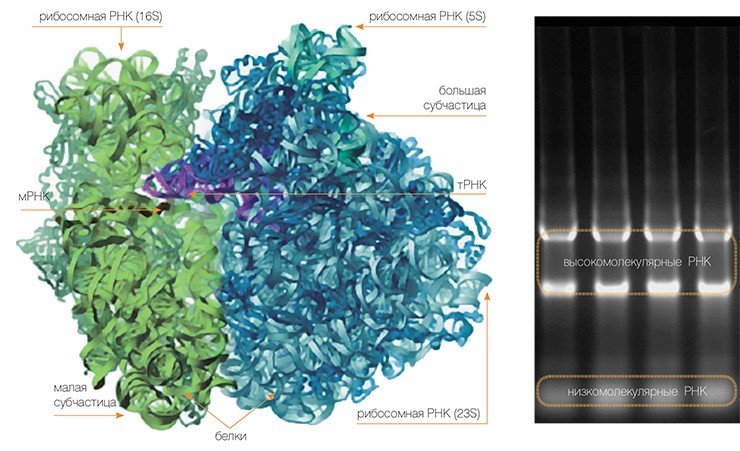
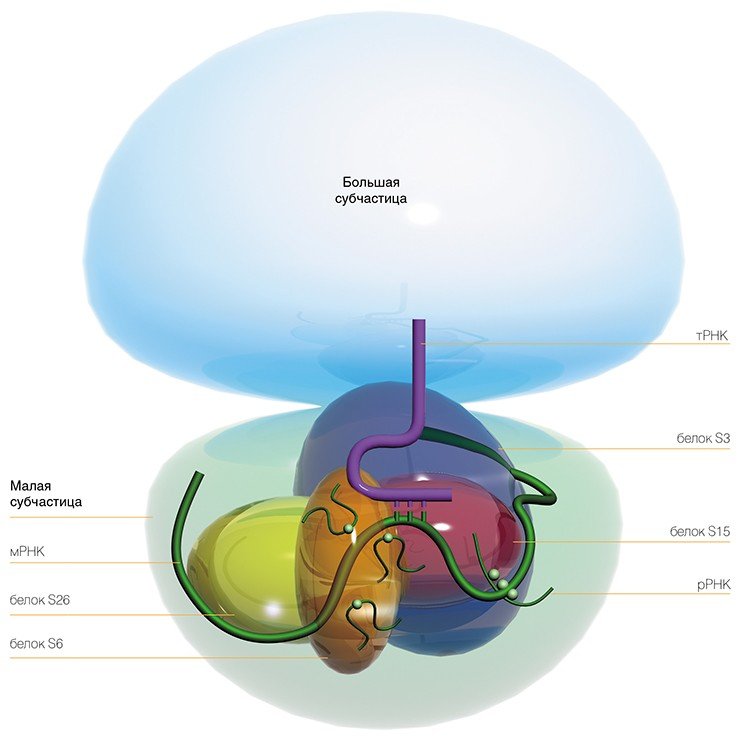
Сама рибосома — одна из самых сложно организованных молекулярных машин клетки — состоит из двух неравных частей, так называемых субчастиц (малой и большой). Ее можно легко разделить на части центрифугированием при сверхвысоких скоростях в специальных пробирках с раствором сахарозы, концентрация которой увеличивается сверху вниз. Поскольку малая субчастица в два раза легче большой, они движутся от верха пробирки к дну с разными скоростями.
Малая субчастица отвечает за декодирование генетической информации. Она состоит из высокомолекулярной рибосомной РНК (рРНК) и нескольких десятков белков (около 20 у прокариот и более 30 — у эукариот).
В раковых клетках резко повышается уровень некоторых рибосомных белков. Возможная причина — сбои в механизмах авторегуляции их производства
Большая субчастица, ответственная за образование пептидной связи между аминокислотными остатками, состоит из нескольких рРНК: одной высокомолекулярной и одной (или двух в случае эукариот) низкомолекулярной, а также нескольких десятков белков (более 30 у прокариот и до 50 у эукариот). О масштабе деятельности рибосом можно судить хотя бы по тому факту, что рибосомная РНК составляет около 80 % всей РНК клетки, тРНК, транспортирующая аминокислоты, — около 15 %, тогда как матричная РНК, несущая информацию о белковой последовательности, — лишь 5 %!
Нужно отметить, что рибосомные белки наделены множеством других, дополнительных функций, которые могут проявляться на разных этапах жизнедеятельности клетки. Например, рибосомный белок S3 человека — один из ключевых белков центра связывания мРНК на рибосоме — принимает также участие в «ремонте» повреждений в ДНК (Kim et al., 1995), участвует в апоптозе (запрограммированной гибели клетки) (Jung et al., 2004), а также защищает от разрушения белок теплового шока (Kim et al., 2006).
Кроме того, чересчур интенсивный синтез некоторых рибосомных белков может свидетельствовать о развитии злокачественной трансформации клетки. Например, значительное повышение уровня пяти рибосомных белков было обнаружено в опухолевых клетках толстого кишечника (Zhang et al., 1999). Недавно сотрудниками лаборатории структуры и функции рибосом ИХБФМ СО РАН был открыт новый механизм авторегуляции биосинтеза рибосомных белков у человека, основанный на принципе обратной связи. Неуправляемый синтез рибосомных белков, характерный для опухолевых клеток, вероятно, вызван сбоями именно в этом механизме. Дальнейшие исследования в этой области представляют особый инте¬рес не только для ученых, но и для медиков.
Работает как «рибозим»
Удивительно, но, несмотря на миллиарды лет эволюции, разделяющие бактерии и человека, вторичная структура рибосомальных РНК у них мало различается.
О том, как уложена рРНК в субчастицах и каким образом она взаимодействует с рибосомными белками, до недавнего времени было известно не много. Революционный сдвиг в понимании устройства рибосомы на молекулярном уровне произошел на рубеже нового тысячелетия, когда с помощью рентгеноструктурного анализа удалось расшифровать на уровне отдельных атомов структуру рибосом простейших организмов и их модельных комплексов с мРНК и тРНК. Это позволило понять молекулярные механизмы декодирования генетической информации и образования связей в молекуле белка.
Оказалось, что оба важнейших функциональных центра рибосомы — как декодирующий на малой субчастице, так и отвечающий за синтез белковой цепочки на большой субчастице — сформированы не белками, а рибосомной РНК. То есть, рибосома работает подобно рибозимам — необычным ферментам, состоящим не из белков, а из РНК.
Рибосомные белки, тем не менее, также играют важную роль в работе рибосомы. В отсутствие этих белков рибосомные РНК совершенно неспособны ни декодировать генетическую информацию, ни катализировать образование пептидных связей. Белки обеспечивают необходимую для работы рибосомы сложную «укладку» рРНК в функциональных центрах, служат «передатчиками» изменений пространственной структуры рибосомы, необходимых в процессе работы, а также связывают различные молекулы, влияющие на скорость и точность процесса белкового синтеза.
Сама рабочая схема белкового цикла в принципе одинакова для рибосом всех живых существ. Однако до сих пор неизвестно, до какой степени схожи молекулярные механизмы работы рибосом у разных организмов. Особенно не хватает информации об устройстве функциональных центров рибосом высших организмов, которые изучены гораздо хуже, чем рибосомы простейших.
Это связано с тем, что многие из методов, успешно использованных для исследования рибосом прокариот, оказались для эукариот неприменимыми. Так, из рибосом высших организмов не удается получить кристаллы, пригодные для рентгеноструктурного анализа, а их субчастицы невозможно «собрать» в пробирке из смеси рибосомных белков и рРНК, как это делается у простейших.
От низших — к высшим
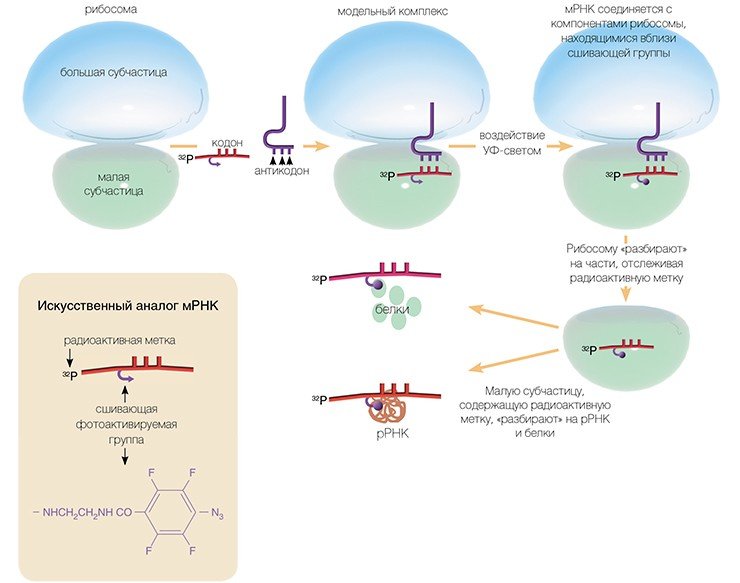
И все-таки способы получения сведений о строении функциональных центров рибосом высших организмов существуют. Одним из таких методов является метод химического аффинного сшивания, разработанный 35 лет назад в отделе биохимии НИОХ СО АН СССР (ныне ИХБФМ СО РАН) под руководством академика Д. Г. Кнорре.
Метод основан на использовании коротких синтетических мРНК, несущих в выбранном положении химически активные («сшивающие») группы, которые в нужный момент можно активировать (например, облучая мягким ультрафиолетовым светом).
Метод аффинного химического сшивания был разработан 35 лет назад в отделе биохимии НИОХ СО АН СССР (ныне ИХБФМ СО РАН) под руководством академика Д. Г. Кнорре.До появления рентгеноструктурного анализа рибосом он использовался во всем мире для изучения рибосом у прокариот.
Этот метод и сегодня является основным для изучения структурно-функциональной организации рибосом высших организмов
Достоинство этого метода в том, что сшивающую группу можно присоединить практически к любому нуклеотидному остатку мРНК и в результате получить детальную информацию о его окружении на рибосоме. Используя набор коротких мРНК с разным расположением сшивающей группы, нам удалось определить рибосомные белки и нуклеотиды рРНК рибосомы человека, образующие канал для считывания генетической информации в процессе трансляции.
Впервые экспериментально удалось показать, что все нуклеотиды рРНК малой рибосомной частицы человека, соседствующие с кодонами мРНК, расположены в консервативных районах вторичной структуры молекулы рРНК. Более того, их расположение совпадает с положением соответствующих нуклеотидов во вторичной структуре рРНК рибосом низших организмов. Это позволило сделать вывод, что эта часть рибосомной РНК малой субчастицы составляет эволюционно консервативный «кор» (сердцевину) рибосомы, структурно идентичный у всех организмов.
С другой стороны, в устройстве мРНК-связывающего канала рибосом у человека и низших организмов обнаружен ряд принципиальных различий. Оказалось, что у высших организмов рибосомные белки играют намного большую роль в формировании этого канала, чем у прокариот, кроме того, в этом участвуют также белки, не имеющие «двойников» (гомологов) у низших организмов.
Почему же, несмотря на то, что функция рибосомы практически не изменилась в процессе эволюции, в организации декодирующего центра рибосом у высших организмов появились специфичные черты? Вероятно, это связано с более сложной и многостадийной регуляцией белкового синтеза у эукариот по сравнению с прокариотами, в ходе которой рибосомные белки мРНК-связывающего канала могут взаимодействовать не только с мРНК, но и с различными факторами, влияющими на эффективность и точность трансляции. Так ли это, покажут дальнейшие исследования.



.jpg)