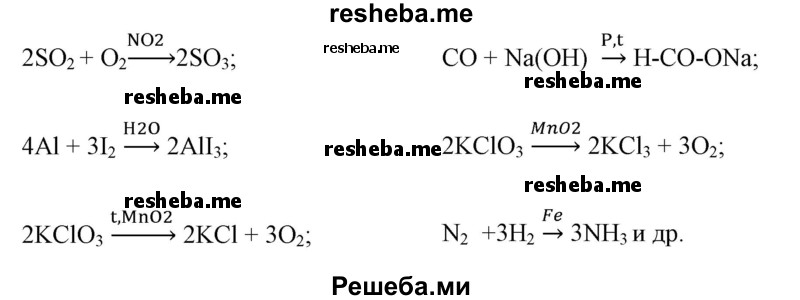какую роль катализаторы играют в химических реакциях
Катализаторы
Примерно 90% объема современного химического производства основано на каталитических процессах.
Гидроочистка является наиболее крупнотоннажным каталитическим процессом в нефтепереработке.
В процессе гидроочистки понижается содержание серы в топливе.
Эффективность гидроочистки зависит от активности катализаторов, температурного режима и качества сырья.
И повышение эффективности процесса требует использования новых типов катализаторов.
Требования к катализаторам:
Селективность изменяется из-за изменения электронных свойств и окружения активных центров катализатора (эффект лиганда).
В реакциях сложных органических молекул большое значение имеет преимущественное образование продукта, близкого по своей форме и размерам к размерам микропор катализатора.
В сложных многостадийных реакциях применяют многофазные многокомпонентные катализаторы, селективность которых выше благодаря тому, что каждая стадия сложной реакции ускоряется своим компонентом катализатора. Селективность катализатора зависит также от его пористости, размера зерен и характера их укладки.
Термостойкость катализаторов важна для первых по ходу реагента слоев катализаторов в экзотермических реакциях, когда выделение тепла может вызвать рекристаллизацию и дезактивацию катализаторов.
Для предотвращения рекристаллизации катализаторы наносят на термостойкие носители.
Устойчивость катализатора к действию ядов каталитических определяется спецификой их взаимодействия с катализатором.
Металлические катализаторы отравляются соединениями кислорода (Н2О, СО), серы (H2S, CS2 и др.), N, Р, As и другими веществами, образующими более прочную химическую связь с катализатором, чем реагирующие вещества.
На оксидные катализаторы действуют те же яды, однако оксиды более устойчивы к отравлению.
В процессах крекинга, риформинга и других реакций углеводородов катализаторы отравляются в результате покрытия их слоем кокса.
Кроме того, катализаторы могут дезактивироваться из-за механического покрытия поверхности пылью, которая вносится извне или образуется при катализе.
Приготовление катализаторов
Катализаторы с развитой удельной поверхностью распространение получил метод осаждения из водных растворов солей с последующим прокаливанием образующихся соединений.
Так получают многие оксиды металлов. При этом лучше использовать водный раствор NH3, потому что отпадает необходимость отмывки осадка от щелочных металлов.
Охлажденный катализатор дробят, просеивают и восстанавливают азотно-водородной смесью в колонне синтеза.
Для получения правильной геометрической формы зерен катализатора используют специальные формовочные машины.
Цилиндрические гранулы получают экструзией (выдавливанием) влажной массы с помощью массивного винта (шнека) через отверстия нужного диаметра, после чего разрезают полученный жгут на отдельные цилиндрики, которые
закатываются в сферические гранулы в специальных грануляторах.
Плоские цилиндрические таблетки получают прессованием сухого порошка на таблеточных машинах
Какую роль катализаторы играют в химических реакциях
Подробное решение параграф § 12 по биологии для учащихся 10 класса, авторов Пасечник В.В., Каменский А.А., Рубцов A.M. Углубленный уровень 2019
Вопрос 1. Что такое катализ? Какие катализаторы химических реакций вы знаете?
Катализ — возбуждение химических реакций или изменение их скорости под влиянием веществ — катализаторов, многократно вступающих в химическое взаимодействие с участниками реакции и восстанавливающихся после каждого цикла взаимодействия свой химический состав.
Например, в некоторых химических реакциях применяются следующие катализаторы реакций Al2O3, TiO2, ThO2, MnO2, алюмосиликаты, цеолиты, CaO, BaO, MgO, Ti, Rh, Ni, квант света, повышение температуры и др.
Вопрос 2. Что такое экзо — и эндотермические реакции?
Экзотермическая реакция — химическая реакция, сопровождающаяся выделением теплоты в окружающую среду. Экзотермическая реакция являются, например, горение, нейтрализация, большинство реакций образования химических соединений из простых веществ.
Эндотермическая реакция — реакция, сопровождающаяся поглощением теплоты. К эндотермическим реакциям относятся диссоциация (в частности, разложение молекул на свободные атомы), восстановление металлов из руд, фотосинтез в растениях, образование некоторых соединений из простых веществ.
Вопрос 3. Что такое прямая и обратная химические реакции?
Прямая, или необратимая, химическая реакция — реакция, идущая до конца и не изменяющая своего направления при изменении температуры и давления, а также если один из продуктов реакции выводится из сферы реакции в виде газа, осадка, малодиссоциированного соединения (воды, слабой кислоты или основания, комплексной соли) или выделяется большое количество тепла (реакция горения).
Обратная, или обратимая, химическая реакция, — это такая, в результате которой полученные вещества вновь реагируют между собой с образованием исходных веществ. При одних условиях (P, t, kat) они идут в одном направлении, при других — в обратном, а при некоторых промежуточных — протекают одновременно в двух взаимно противоположных направлениях. Примером обратимых реакций служат реакции термического разложения гидроксида кальция, синтез аммиака.
Вопрос 4. Какова роль катализаторов в протекании химических реакций?
Катализаторы в протекании химических реакций могут увеличивать концентрации активных частиц в реакционной смеси, образовывать промежуточные соединения с обоими из реагентов реакции, осуществлять химическую активацию, значительно ускорять протекание химических реакций.
Вопрос 5. Что лежит в основе работы (механизма действия) любых катализаторов, в том числе ферментов?
Они снижают необходимое количество энергии активации, и за счёт этого ускоряется протекание реакции.
Вопрос 6. Какое строение имеет молекула белка — фермента?
Простые ферменты состоят только из аминокислот — например, пепсин, трипсин, лизоцим.
Сложные ферменты (холоферменты) имеют в своем составе белковую часть, состоящую из аминокислот — апофермент, и небелковую часть — кофактор (кофактор, в свою очередь, может называться коферментом (НАД+, НАДФ+, ФМН, ФАД, биотин) или простетической группой (гем, олигосахариды, ионы металлов Fe2+, Mg2+, Ca2+, Zn2+)).
Для осуществления катализа необходим полноценный комплекс апобелка и кофактора, по отдельности катализ они осуществить не могут. Кофактор входит в состав активного центра, участвует в связывании субстрата или в его превращении.
В составе белка — фермента выделяют области, выполняющие различную функцию:
1. Активный центр — комбинация аминокислотных остатков (обычно 12 — 16), обеспечивающая непосредственное связывание с молекулой субстрата и осуществляющая катализ.
2. Аллостерический центр (allos — чужой) — центр регуляции активности фермента, который пространственно отделен от активного центра и имеется не у всех ферментов.
Вопрос 7. Какую роль в составе фермента играют коферменты? Какие вещества в организме являются их предшественниками? Приведите примеры.
Коферменты — органические природные соединения небелковой природы, необходимые для осуществления каталитического действия ферментов. Коферменты вместе с функциональными группами аминокислотных остатков фермента формируют активный центр фермента, на котором происходит связывание с субстратом и образование активированного фермент — субстратного комплекса.
Витамины, участвующие в биохимических процессах, являются предшественниками коферментов (например, витамин В1) или собственно коферментами (например, липоамид).
Вопрос 8. Как осуществляется регуляция активности фермента?
Так, активность ферментов может регулироваться при связывании низкомолекулярных соединений в специальных регуляторных центрах катализатора или же за счёт взаимодействия ферментов с активаторами или ингибиторами.
Активность многих ферментов зависит от присутствия в среде катионов и анионов. Например, активатором амилазы слюны (фермента, расщепляющего крахмал и гликоген в ротовой полости) являются анионы хлора, активаторами енолазы (фермента, катализирующего одну из реакций гликолиза) являются Mg2+, Мn2+ и К+, каталаза и пероксидаза активируются ионами Fe2+, карбоангидраза и лактатдегидрогеназа — ионами Zn2+, фосфоглюкомутаза и холинэстераза — ионами Мn2+, аскорбатоксидаза и фенолоксидаза — ионами Сu2+. Активатором многих ферментов, например, Са — кальмодулин — зависимой протеинкиназы и многих липаз, являются ионы Са2+.
В качестве активаторов или ингибиторов ферментов могут выступать и другие низкомолекулярные соединения. Так, АТФ и цитрат (лимонная кислота) ингибируют один из ключевых регуляторных ферментов гликолиза — фосфофруктокиназу, тогда как АДФ и АМФ, наоборот, активируют этот фермент.
В активации ещё одного фермента углеводного обмена — гликогенфосфорилазы, расщепляющей гликоген в клетках печени, участвуют как низкомолекулярные соединения, так и многочисленные белки.
Вопрос 9. Приведите примеры химических реакций с участием катализаторов, укажите условия их протекания.
В некоторых случаях выбор катализатора влияет на путь химической реакции и, в конечном итоге, продукты реакции будут разные.
Вопрос 10. Из курса химии вам известно, что реакции, протекающие при участии катализаторов (никель, платина), требуют высоких температур и давления. Ферментативные процессы протекают в узких пределах изменения температуры и давления. Дайте объяснение этому факту.
Вопрос 11. Почему белки редко используются организмами в качестве источника энергии для процессов жизнедеятельности?
Мономеры белков — аминокислоты — ценное сырье для построения новых белковых молекул. Поэтому полное расщепление полипептидов до неорганических веществ происходит редко. Следовательно, энергетическая функция, заключающаяся в выделении энергии при полном расщеплении, выполняется белками довольно редко.
Это невыгодно, выгоднее использовать липиды. Белки также выполняют много важных функций в организме.
Вопрос 12. Может ли один и тот же белок быть активатором одной, но при этом ингибитором другой реакции?
Может, например, протеинкиназа А одновременно способствует ингибированию синтеза гликогена и активации его распада.
Вопрос 13. Почему в качестве кофермента в активном центре присутствует низкомолекулярное вещество, а не пептидная цепь?
Сложные ферменты (холоферменты) имеют в своем составе белковую часть, состоящую из аминокислот — апофермент, и небелковую часть — кофактор (кофактор, в свою очередь, может называться коферментом (НАД+, НАДФ+, ФМН, ФАД, биотин) или простетической группой (гем, олигосахариды, ионы металлов Fe2+, Mg2+, Ca2+, Zn2+)).
Для осуществления катализа необходим полноценный комплекс апобелка и кофактора, по отдельности катализ они осуществить не могут. Кофактор входит в состав активного центра, участвует в связывании субстрата или в его превращении.
Вопрос 14. Взрослые люди часто тяжело переносят повышение температуры тела на несколько градусов от нормы, что само по себе является важнейшей защитной реакцией организма против возбудителей целого ряда заболеваний. Как это может повлиять на работу ферментов и других физиологически важных веществ организма человека, имеющих белковую природу?
Активность ферментов зависит от температуры. Та температура, при которой активность фермента наибольшая, называется температурным оптимумом (opt — t°). Для организма человека opt — t° находится в пределах 36,6 — 40°С. Снижение t° приводит к уменьшению активности ферментов, а при очень низких температурах (0° — +4°С) ферментативная активность практически прекращается, т.к. резко изменяются кинетические свойства ферментов. Поэтому снижение активности ферментов имеет обратимый характер: при повышении температуры ферментативная активность полностью восстанавливается.
Так при увеличении температуры тела с 360С до 390С скорость биохимических процессов в организме увеличивается в 1,2 — 1,4 раза. При достижении определенной t для каждого фермента, это приводит к полной инактивации фермента, которая является необратимой. При повышении t, происходит денатурация белка — фермента, разрушение активного центра фермента, образование Е — S — комплекса становится невозможным, и ферментативная реакция прекращается.
Вопрос 15. ЛАБОРАТОРНАЯ РАБОТА № 5 «Каталитическая активность ферментов (на примере амилазы)».
Цель: доказать каталитическое действие белков — ферментов, показать их высокую специфичность, а также зависимость их действия от условий среды.
1. Приготовление раствора слюны, содержащего фермент амилазу.
• Тщательно прополощите рот водой.
• Наберите 2—4 мл слюны в мерный цилиндр.
• Добавьте в цилиндр воды до объёма 10 мл.
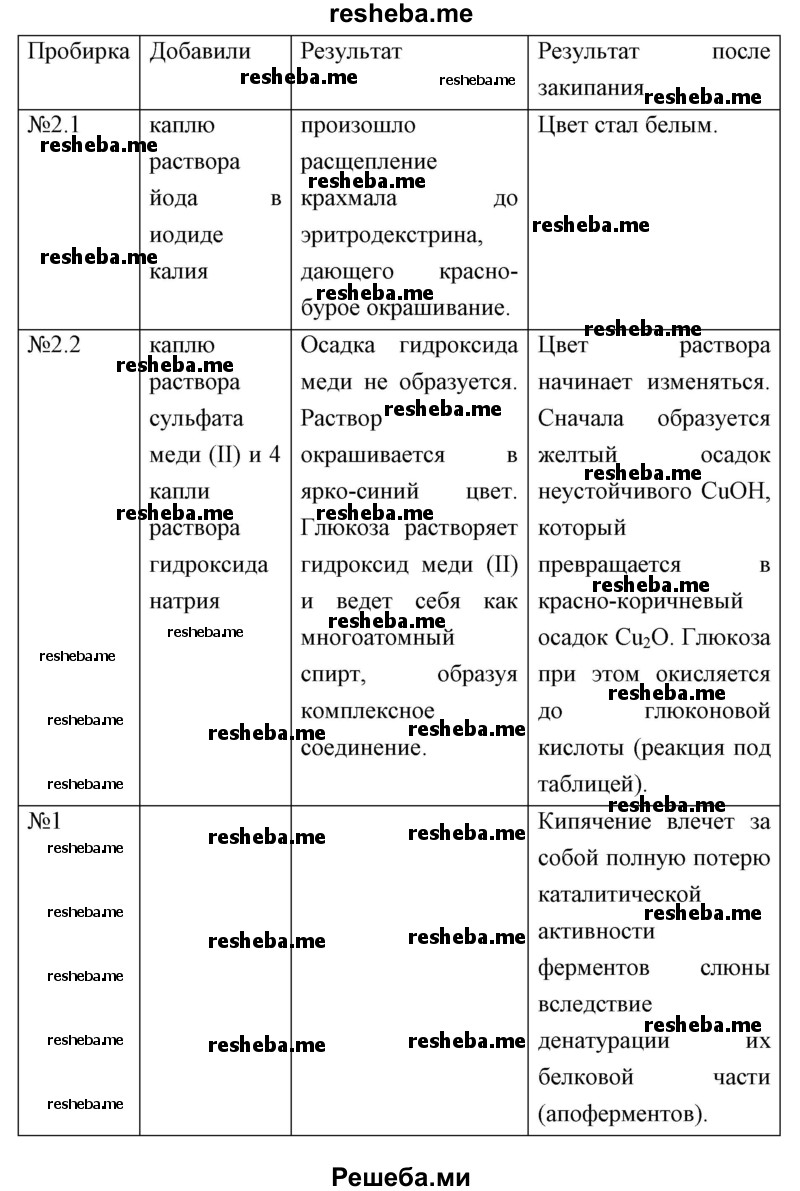
2. В две пронумерованные пробирки налейте по 10 капель раствора крахмала.
3. В пробирку № 1 внесите 4 капли воды (контроль), а в пробирку № 2 — 4 капли раствора слюны.
В пробирке №2 под действием слюны (в которой содержится амилаза) произойдет расщепление крахмала на олигосахариды (сахарозу, а она до глюкозы и фруктозы).
4. Перемешайте и поставьте на водяную баню или в термостат на 15 мин при температуре 37°С.
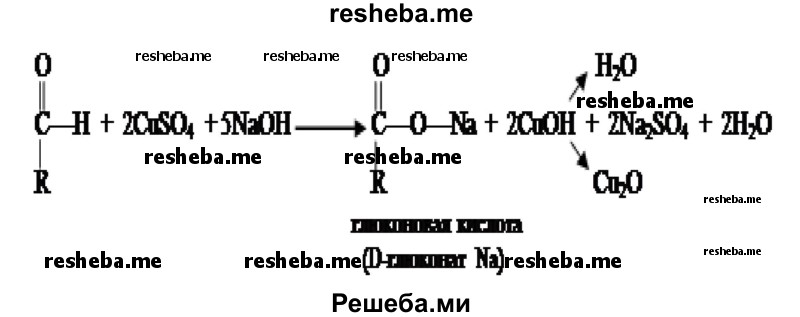
5. Из пробирки № 2 возьмите 4 капли исследуемого вещества и внесите их в две разные пробирки (по две капли в каждую). В одну из них добавьте каплю раствора йода в иодиде калия. В другую — каплю раствора сульфата меди (II) и 4 капли раствора гидроксида натрия и осторожно нагрейте до кипения. Те же действия проделайте с содержимым контрольной пробирки (№ 1).
6. Оформите полученные результаты в виде таблицы.
7. Сделайте вывод на основе проведённого исследования.
В качестве фермента, гидролизующего крахмал на его составные части (мальтозу, глюкозу), выступает амилаза слюны.
Каждый фермент действует только на одно вещество или группу сходных субстратов, что обусловлено соответствием структуры фермента, точнее его активного центра и структуры субстрата. Например, амилаза действует только на крахмал.
Мы также убедились в том, что фермент действует в зависимости от условий среды.
Катализатор, их виды и свойства
Катализатор, их виды и свойства.
Катализатор – это химическое вещество, ускоряющее реакцию, но не расходующееся в процессе реакции, и действующее повторно (неоднократно).
Катализатор (понятие и сущность):
Катализатор – это химическое вещество, ускоряющее реакцию, но не расходующееся в процессе реакции, и действующее повторно (неоднократно).
Катализаторы – это вещества, которые ускоряют химические реакции, но не входят в состав их конечных продуктов.
Катализаторы – это вещества, ускоряющие скорость химической реакции, которые могут участвовать в реакции, входить в состав промежуточных продуктов, но не входят в состав конечных продуктов реакции и после окончания реакции остаются неизменными.
Термин катализатор (от греч. katalysis – «ослабление», «разрушение») впервые ввел в 1835 г. шведский химик И. Берцелиус, который установил, что в присутствии определенных веществ скорость некоторых химических реакций существенно возрастает.
Соответственно химические реакции, протекающие в присутствии катализаторов, именуются каталитическими реакциями. А процесс, заключающийся в изменении скорости химических реакций в присутствии веществ, называемых катализаторами, именуется катализом.
Различают положительный катализ и отрицательный катализ. Положительным называют катализ, при котором скорость реакции возрастает, отрицательным (ингибированием) – при котором она убывает.
Вещества, замедляющие химическую реакцию, именуются ингибиторами. Однако ингибиторы в отличие от катализаторов могут расходоваться в процессе химической реакции.
Все химические реакции в прису тствии катализатора протекают быстрее, поскольку катализатор снижает энергию активации реакции.
В некоторых химических реакциях катализатор реагирует с одним или несколькими реагентами с образованием временного промежуточного продукта, который затем регенерирует исходный катализатор в циклическом процессе. Химическая реакция в таких случаях состоит из нескольких стадий:
X + K → XK,
Y + XK → XYK,
XYK → KZ,
KZ → K + Z,
Z – конечный продукт химической реакции X и Y,
При этом общее уравнение реакции записывается как:
В современном химическом производстве часто применяют каталитические системы из нескольких катализаторов, каждый из которых ускоряет разные стадии химической реакции.
Катализатор также может увеличивать скорость одной из стадий каталитического цикла, осуществляемого другим катализатором. Здесь имеет место «катализ катализа», или катализ второго уровня.
В настоящее время многие важнейшие химические производства, такие, как получение серной кислоты, аммиака, азотной кислоты, синтетического каучука, ряда полимеров и др., проводятся в присутствии катализаторов. Согласно оценкам, для производства 90 % всех коммерчески производимых химических продуктов на той или иной стадии процесса их изготовления использовались катализаторы.
Типы и виды катализаторов:
Катализаторы, как правило, подразделяются на гомогенные и гетерогенные.
Гомогенный катализатор – это катализатор, молекулы которого диспергированы (т.е. находятся) в одной и той же фазе (обычно в газообразной или жидкой), что и молекулы реагента.
Гетерогенный катализатор – это катализатор, молекулы которого находятся не в той же фазе, что и реагенты (которые обычно представляют собой газы или жидкости, адсорбированные на поверхности твердого катализатора). Гетерогенный катализатор образует самостоятельную фазу, отделённую границей раздела от фазы, в которой находятся реагирующие вещества – реагенты.
Действие гомогенного катализатора, как правило, связано с тем, что он вступает во взаимодействие с реагирующими веществами с образованием промежуточных соединений, что приводит к снижению энергии активации химической реакции. Впоследствии промежуточные вещества регенерируют исходный катализатор.
Гетерогенные катализаторы имеют, как правило, сильно развитую твердую поверхность, для чего их распределяют на инертном носителе (силикагель, оксид алюминия, активированный уголь и др.). Их действие основано на ускорении химической реакции на своей твердой поверхности (либо на плоской открытой поверхности, либо на краях кристалла, либо вследствие сочетания этих двух факторов). Поэтому активность гетерогенного катализатора зависит от величины и свойств его поверхности.
Типичными гомогенными катализаторами являются кислоты и основания. В качестве гетерогенных катализаторов применяются металлы, их оксиды и сульфиды.
Одни и те же химические реакции могут протекать как с гомогенными, так и с гетерогенными катализаторами. Для определенных химических реакций эффективны только определённые катализаторы.
В биохимических реакциях роль катализаторов выполняют ферменты, которые часто рассматриваются как третья – отдельная категория.
Соответственно классификации катализаторов положительный катализ подразделяют на три типа:
а) гомогенный катализ, когда реакционная смесь и катализатор находятся или в жидком или в газообразном состоянии;
в) ферментативный катализ, когда катализатором служат сложные белковые образования, ускоряющие течение биологически важных реакций в организмах растительного и животного мира. Ферментативный катализ может быть как гомогенным, так и гетерогенным, но из-за специфических особенностей действия ферментов целесообразно выделение этого вида катализа в самостоятельную область.
Свойства катализаторов:
Катализаторы как вещества, ускоряющие химические реакции, обладают следующими свойствами:
– каталитической активностью. Каталитическая активность – это свойство катализатора ускорять химическую реакцию. Формально каталитическую активность можно определить как скорость каталитической реакции в данных условиях за вычетом скорости той же реакции в отсутствие катализатора или как соотношение скоростей каталитической и некаталитической реакций;
– селективностью. Селективность – это способность протекания химической реакции в определённом направлении, то есть свойство получать те продукты реакции, на которые направлена химическая реакция;
– неизменностью. Неизменность означает, что после участия в химической реакции они (катализаторы) остаются химически неизменными;
– активностью. Активность катализатора в процессе реакции может понижаться вследствие воздействия на катализатор вредных примесей. К последним относятся каталитические яды и ингибиторы. Каталитические яды – это вещества, вызывающие «отравление» катализатора, т. е. снижающие его каталитическую активность или полностью прекращающие каталитическое действие. Поэтому важно в процессе реакции исключить воздействие на катализатор вредных факторов.
Другими немаловажными свойствами катализаторов являются твердость, механическая прочность, устойчивость к истиранию и дроблению, срок службы, устойчивость к отравлению каталитическими ядами, размер и форма, масса единицы объема, пористость, удельная поверхность, термостойкость и стабильность.
Каталитические системы на основе катализаторов:
Современные промышленные твердые катализаторы обычно представляют собой сложные смеси, называемые контактными массами. В состав контактных масс входят прежде всего вещества, являющиеся собственно катализаторами, а также носители и активаторы.
Активаторы (промоторы) – это вещества, добавляемые к катализатору в небольших количествах с целью улучшения его свойств, таких, как активность, селективность или стабильность, которые сами по себе могут быть неактивными для данной реакции, но значительно улучшают свойства катализатора. Поэтому деление на сложные и активированные катализаторы носит лишь ориентировочный характер.
Улучшение свойств катализатора при добавлении промотора (активатора) значительно превосходит тот эффект, который можно было бы получить в результате независимого действия самого промотора, т.к. сам промотор может и не обладать каталитической активностью.
В общем случае по своему целевому назначению промоторы могут быть разделены на две группы:
– способствующие протеканию целевой реакции, т. е. увеличивающие активность катализатора;
– подавляющие нежелательные процессы, т. е. увеличивающие селективность катализатора.
Среди промоторов первой группы различают структурообразующие и активирующие. Структурообразующие промоторы, как правило, представляют собой инертные вещества, присутствующие в катализаторе в виде мелких частиц, препятствующих спеканию частиц активной каталитической фазы, что предотвращает уменьшение активной поверхности во время работы катализатора. Активирующие промоторы могут создавать дополнительные активные центры, воздействовать на электронную структуру активной фазы и т.п.