какую роль играет водород в организме человека
Водород
Водород вместе с азотом, кислородом и углеродом входит в группу так называемых элементов-органогенов.
Именно из этих элементов в основном и состоит организм человека. Доля водорода в нем по массе достигает 10%, а по числу атомов 50% (каждый второй атом в организме – водород).
Водород и самый распространенный элемент в нашей вселенной – его доля составляет около 75% по массе и 92% по числу атомов. В отличие от кислорода, существующего как в природе, так и в организме в свободном виде, водород почти полностью находится в виде его соединений (основное соединение водорода – вода).
Биологическая роль водорода
Водород как отдельный элемент не обладает биологической ценностью. Для организма важны соединения, в состав которых он входит, а именно вода, белки, жиры, углеводы, витамины, биологически активные вещества (за исключением минералов) и т.д. Наибольшую ценность, конечно, представляет соединение водорода с кислородом – вода, которая фактически является средой существования всех клеток организма. Другой группой важных соединений водорода являются кислоты – их способность высвобождать ион водорода делает возможным формирование рН среды. Немаловажной функцией водорода также является его способность образовывать водородные связи, которые, например, формируют в пространстве активные формы белков и двухцепочечную структуру ДНК.
Основные пищевые источники водорода
Водород содержится практически во всех пищевых веществах, однако основное его количество попадает в организм в виде воды.
Дефицит водорода
Причины дефицита водорода
Дефицита водорода как такового не бывают, наблюдают дефицит его соединений, например, воды при ее недостаточном поступлении в организм или некомпенсированном ускоренном выведении.
Последствия дефицита водорода
Также как и в случае причин, наблюдают последствия дефицита его соединений, чаще всего воды. В этом случае наблюдают: обезвоживание, чувство жажды, снижение тургора тканей, сухость кожи и слизистых оболочек, повышение концентрации крови, артериальная гипотензия.
Избыток водорода
Избытка водорода как такового тоже не бывает, возможен избыток поступления его соединений. В этом случае наблюдают картину, характерную для конкретного соединения. Например, в случае избытка воды (гипергидратация) чаще всего наблюдают отеки.
Водород
Водород вместе с азотом, кислородом и углеродом входит в группу так называемых элементов-органогенов.
Именно из этих элементов в основном и состоит организм человека. Доля водорода в нем по массе достигает 10%, а по числу атомов 50% (каждый второй атом в организме – водород).
Водород и самый распространенный элемент в нашей вселенной – его доля составляет около 75% по массе и 92% по числу атомов. В отличие от кислорода, существующего как в природе, так и в организме в свободном виде, водород почти полностью находится в виде его соединений (основное соединение водорода – вода).
Биологическая роль водорода
Водород как отдельный элемент не обладает биологической ценностью. Для организма важны соединения, в состав которых он входит, а именно вода, белки, жиры, углеводы, витамины, биологически активные вещества (за исключением минералов) и т.д. Наибольшую ценность, конечно, представляет соединение водорода с кислородом – вода, которая фактически является средой существования всех клеток организма. Другой группой важных соединений водорода являются кислоты – их способность высвобождать ион водорода делает возможным формирование рН среды. Немаловажной функцией водорода также является его способность образовывать водородные связи, которые, например, формируют в пространстве активные формы белков и двухцепочечную структуру ДНК.
Основные пищевые источники водорода
Водород содержится практически во всех пищевых веществах, однако основное его количество попадает в организм в виде воды.
Дефицит водорода
Причины дефицита водорода
Дефицита водорода как такового не бывают, наблюдают дефицит его соединений, например, воды при ее недостаточном поступлении в организм или некомпенсированном ускоренном выведении.
Последствия дефицита водорода
Также как и в случае причин, наблюдают последствия дефицита его соединений, чаще всего воды. В этом случае наблюдают: обезвоживание, чувство жажды, снижение тургора тканей, сухость кожи и слизистых оболочек, повышение концентрации крови, артериальная гипотензия.
Избыток водорода
Избытка водорода как такового тоже не бывает, возможен избыток поступления его соединений. В этом случае наблюдают картину, характерную для конкретного соединения. Например, в случае избытка воды (гипергидратация) чаще всего наблюдают отеки.

Скажите, кто из нас, потребляя ароматный кусок поджаренного мяса или свежую котлету, задумывался над тем, а хватит ли в организме кислоты и щелочи это все переработать? Кислотно-щелочной баланс, как выяснили в нашем веке ученые, и есть главное, от чего зависит, насколько человек будет здоров, бодр и весел. На упаковке почти любого продукта питания Вы можете найти информацию о том, сколько в нем содержится белков, жиров и углеводов и какова энергетическая ценность 100 г этой пищи.
Кислотная нагрузка (КН) измеряется по принципу кислота минус щелочь.
Когда в пище преобладают компоненты, образующие серную кислоту (серосодержащие аминокислоты в белках) или органические кислоты (жиры, углеводы), то КН имеет положительную величину.
Если в пище больше компонентов, образующих щелочь (органические соли магния, кальция, калия), то КН представляет собой отрицательную величину.
На основе компьютерного анализа этими учеными была составлена таблица кислотной нагрузки основных продуктов питания.
Кислотная нагрузка основных продуктов питания (в миллиэквивалентах на 240 килокалорий)
Кислые продукты
Нейтральные продукты
Щелочные продукты
Молоко и йогурт = 2,8
Источник: Американский журнал клинического питания. 2002,76(6) 1308-1316
pH, или показатель кислотно-щелочного равновесия
Это мера относительной концентрации водородных (Н+) и гидроксильных (ОН-) ионов в жидкой системе и выражается в масштабе от 0 (полное насыщение ионами водорода Н+) до 14 (полное насыщение гидроксильными ионами ОН-), дистиллированная вода считается нейтральной с рН 7,0.
Повышение концентрации положительных ионов водорода (Н+) в любой из жидких сред организма вызывает смещение значений рН в сторону нуля и носит название кислотного сдвига.
Повышение концентрации гидроксильных ионов ОН вызывает смещение значений рН в сторону значения 14 и носит название щелочного сдвига.
рН артериальной крови= 7,35-7,45 рН венозной крови=7,26-7,36 рН лимфы= 7,35-7,4 рН межклеточной жидкости=7,26-7,38 рН внутрисуставной жидкости=7,3
Питание современного человека характеризуется дисбалансом ионов водорода и бикарбоната, что вызывает пожизненный, слабовыраженный болезнетворно (патогенно) существующий системный метаболический ацидоз (закисление).
По данным антропологов рацион древнего человека состоял на 1/3 из нежирного мяса и на 2/3 из растительной пищи. В этих условиях питание носило исключительно щелочной характер.
Кислотная нагрузка пищи древнего человека составляла в среднем минус 78.
Ситуация принципиально изменилась с возникновением аграрной цивилизации, когда человек стал употреблять в пищу много зерновых культур, молочные продукты и жирное мясо одомашненных животных.
Но особенно драматические сдвиги в питании произошли в конце 20 века, когда рацион заполнили промышленно обработанные кислые продукты питания.
Эти изменения в составе диеты были названы факторами риска в патогенезе болезней цивилизации: атеросклероза, гипертонии, остеопороза, диабета 2 типа.
Кислотная нагрузка пищи современного человека составляет плюс 48.
Диета современного человека богата насыщенными жирами, простыми сахарами, поваренной солью и бедна клетчаткой, магнием и калием. В ней доминируют рафинированные и обработанные продукты, сахар, мучные изделия, множество полуфабрикатов.
Что представляет собой пища современного человека? Это пицца, чипсы, глазированные сырки, новоявленные чудо-молочные продукты, кондитерские изделия, прохладительные сладкие напитки. Эта пища имеет кислые валентности. Организм постоянно стремится уравновесить это соотношение, поддерживая строго определенный уровень рН. Этот параметр оказывает существенное влияние на все биохимические процессы в организме.
Чем же опасно закисление организма?
Снижение рН в организме приводит к снижению иммунитета и появлению более чем 200 заболеваний, включая дальнозоркость и катаракту, хондрозы, желчнокаменную, почечнокаменную болезни, онкологию. Если у одного человека проявляется несколько заболеваний одновременно, налицо явное падение рН крови. Естественно, что восстановлении рН до нормы, является необходимым условием лечения этих состояний.
При снижении рН, т.е. при повышении кислотности, отмечается:
Влияние водорода на организм человека
Каждый химический элемент в периодической системе имеет свое определенное место положения, которое отражает проявляемые им свойства и говорит о его электронном строении. Однако есть среди всех один особый атом, который занимает сразу две ячейки. Он располагается в двух совершенно противоположных по проявляемым свойствам группах элементов. Это водород. Такие особенности делают его уникальным. Водород — это не просто элемент, но и простое вещество, а также составная часть многих сложных соединений, биогенный и органогенный элемент. Поэтому рассмотрим его характеристики и свойства подробнее.
Водород как химический элемент
Водород — это элемент первой группы главной подгруппы, а также седьмой группы главной подгруппы в первом малом периоде.
Данный период состоит всего из двух атомов: гелия и рассматриваемого нами элемента. Опишем основные особенности положения водорода в периодической системе.
Таким образом, очевидно, что атом водорода — это совершенно уникальный, непохожий на все остальные элемент. Следовательно, свойства его тоже особенные, а образуемые простые и сложные вещества очень важны. Рассмотрим их далее.
Простое вещество — водород
Если говорить о данном элементе как о молекуле, то нужно сказать, что она двухатомна. То есть водород (простое вещество) — это газ. Формула его эмпирическая будет записываться как Н2, а графическая — через одинарную сигма-связь Н-Н. Механизм образования связи между атомами — ковалентный неполярный.
Еще Генри Кавендиш в 1766 году сумел открыть данное вещество. Именно он и доказал, что водород — это газ, причем такой, который способен взрываться на воздухе. Позже были хорошо изучены свойства, стало ясно, что данное вещество — самое легкое среди известных.
Еще позже Лавуазье дал название (как элементу, так и веществу на его основе) на латыни — hydrogenium, что в переводе означает «рождающий воду». В 1781 году первооткрыватель данного элемента Генри Кавендиш доказал, что вода — сочетание водорода и кислорода, то есть это продукт их взаимодействия. А о том, что легкий газ еще и очень горючий, было известно еще в XVI веке, это отражалось в записях Парацельса.
Таким образом, молекулярный водород — это очень распространенное в природе и образующееся естественным путем газообразное соединение, состоящее из двух атомов, которое способно взрываться на воздухе. Кроме того, молекула может распадаться на атомы, которые принимают участие в ядерных реакциях, превращаясь в ядра гелия. Данные процессы непрерывно происходят на Солнце и в космосе, которые и являются основными поставщиками данного соединения.
Водород — это вещество, которое способно проявлять себя и как окислитель, и как восстановитель. Также оно находит себе очень широкое применение в деятельности человека.
Физические свойства водорода
Физические параметры водород имеет следующие:
Кристаллическая решетка простого вещества молекулярная, связи слабые, поэтому легко разрушаются.
Химические свойства водорода
Окислительные свойства водорода
Восстановительные свойства водорода
Отдельно следует выделить реакции, которые используются в органических синтезах. Они называются гидрированием — насыщением водородом и дегидрированием, то есть его отщеплением от молекулы. На основании этих способов превращений получают множество углеводородов и других органических соединений.
Нахождение водорода в природе
Водород — это самое распространенное вещество на нашей планете и за ее пределами. Ведь практически все межзвездное пространство и звезды состоят именно из этого соединения. В космосе он может существовать в виде:
Существует несколько видов различных по плотности облаков, состоящих именно из этого вещества.
Если говорить о распространении конкретно в земной коре, то водород стоит на втором месте по числу атомов после кислорода, его приблизительно 17%. В свободном виде встречается редко, лишь в незначительных количествах в составе сухого воздуха. Самое распространенное соединение данного элемента — вода. Именно в ее составе он и встречается на планете.
Также водород является обязательной составной частью любого живого организма. Причем в теле человека на долю этого атома приходится 63%. Водород — это органогенный элемент, поэтому формирует молекулы белков, жиров, углеводов и нуклеиновых кислот, а также многих других жизненно важных соединений.
Получение водорода
Существуют разные способы получения рассматриваемого нами газа. К ним относится несколько промышленных и лабораторных вариантов синтеза.
Промышленные способы получения водорода:
Лабораторные способы получения водорода:
Чтобы собрать образующийся водород, необходимо держать пробирку перевернутой вверх дном. Ведь данный газ нельзя собрать так, как, например, углекислый газ. Это водород, он намного легче воздуха. Быстро улетучивается, а в больших количествах при смешении с воздухом взрывается. Поэтому и следует переворачивать пробирку. После ее заполнения ее нужно закрыть резиновой пробкой.
Чтобы проверить чистоту собранного водорода, следует поднести к горлышку зажженную спичку. Если хлопок глухой и тихий — значит газ чистый, с минимальными примесями воздуха. Если же громкий и свистящий — грязный, с большой долей посторонних компонентов.
Области использования водорода
При сгорании водорода выделяется настолько большое количество энергии (теплоты), что данный газ считается самым выгодным топливом. К тому же экологически чистым. Однако на сегодняшний день его применение в данной области ограничено. Это связано с непродуманными до конца и не решенными проблемами синтеза чистого водорода, который был бы пригоден для использования в качестве топлива в реакторах, двигателях и портативных устройствах, а также отопительных котлах жилых домов.
Ведь способы получения данного газа достаточно дорогостоящие, поэтому прежде необходимо разработать особый метод синтеза. Такой, который позволит получать продукт в большом объеме и с минимальными затратами.
Можно выделить несколько основных областей, в которых находит применение рассматриваемый нами газ.
Очевидно, что водород так же важен, как и распространен в природе. Еще большую роль играют образуемые им различные соединения.
Влияние водорода на организм человека
Молекулярный водород (Н2) — это самый маленький элемент и самая легкая молекула во Вселенной. Его главная работа заключается в следующем:
Водород является самым маленьким антиоксидантом, поэтому он может проникать в мозг и ткани организма, легко преодолевая физиологический барьер между кровеносной системой и центральной нервной системой. Только водород способен проникать через клеточные мембраны и ликвидировать токсичные радикалы внутри клеток. Поскольку водород является антиоксидантом, то он помогает снизить нагрузку на иммунную систему, способствует сохранению здоровья организма и его способности к быстрому восстановлению.
Каждая клетка в организме человека должна быть здоровой для выполнения предназначенных функций. За это отвечает молекулярный водород. Нормально функционирующие клетки позволяют меньше зависеть он энергии, получаемой с пищей в течение дня. А приемлемое снижение потребления пищи означает, что в организме накапливается меньше токсинов.
Молекулярный водород (Н2) – это не чужеродное для организма вещество.
Его действие отлично от действия лекарственных препаратов, которые, как раз, являются чужими для нашего тела. Благодаря богатой клетчаткой пищи, наши кишечные бактерии производят большое количество этого газообразного водорода, который попадает в кровь и оказывает много полезных эффектов. Это также является одной из причин, почему употребление овощей весьма полезно.
По результатам научных исследований, питьевая вода, обогащенная водородом, является наиболее эффективным способом доставки водорода в организм, и, что интересно, это также самый простой и естественный способ насыщения организма водородом.
Более того, недавние исследования целебных источников во Франции, Мексике и Индии показали, что их воды являются лечебными из-за содержания большого количества растворенного водорода.
Аппараты по производству водородной воды портативны и производят только качественную, полезную воду с высоким содержанием водорода, которая способна оздоровить организм на клеточном уровне, улучшить иммунитет, добавить жизненного тонуса и замедлить процесс старения.
Читайте также:
Влияние кофе на печень
Влияние пчелиного подмора на поджелудочную железу
Влияние пива на поджелудочную железу
Влияние алкоголя на печень и поджелудочную железу
Влияние антибиотиков на поджелудочную железу
Какую роль играет водород в организме человека
Кислотно-основное состояние (КОС) организма является одним из важнейших и наиболее строго стабилизируемых параметров гомеостаза. От соотношения водородных и гидроксильных ионов во внутренней среде организма зависят активность ферментов, гормонов, интенсивность и направленность окислительно-восстановительных реакций, процессы обмена белков, углеводов и жиров, функции различных органов и систем, постоянство водного и электролитного обмена, проницаемость и возбудимость биологических мембран и т.д. Активность реакции среды влияет на способность гемоглобина связывать кислород и отдавать его тканям.
Активную реакцию среды принято оценивать по содержанию в жидкостях ионов водорода.
Величина рН является одним из самых «жестких» параметров крови и колеблется у человека в норме в очень узких пределах – рН артериальной крови составляет 7,35–7,45; венозной – 7,32–7,42. Более значительные изменения рН крови связаны с патологическими нарушениями обмена. В других биологических жидкостях и в клетках рН может отличаться от рН крови.
Сдвиги рН крови за указанные границы приводят к существенным сдвигам окислительно-восстановительных процессов, изменению активности ферментов, прницаемости биологических мембран, обусловливают нарушения со стороны функции сердечно-сосудистой, дыхательной и других систем; сдвиг на 0,3 может вызвать коматозные состояния, а на 0,4 – зачастую несовместим с жизнью.
Кислотно-основное состояние поддерживается мощными гомеостатическими механизмами. В их основе лежат особенности физико-химических свойств буферных систем крови и физиологические процессы, в которых принимают участие системы внешнего дыхания, почки, печень, желудочно-кишечный тракт и др.
Химические буферные системы образуют первую линию защиты против изменений рН жидкости организма, действуют для быстрого их предотвращения.
Буферной системой называют смеси, которые обладают способностью препятствовать изменению рН среды при внесении в нее кислот или оснований. Буферные системы не удаляют H+ из организма, а «связывают» его своим щелочным компонентом до окончательного восстановления КОС. Буферными свойствами обладают смеси, которые состоят из слабой кислоты и ее соли, содержащей сильное основание, или из слабого основания и соли сильной кислоты.
Наиболее емкими буферными системами крови являются бикарбонатный, фосфатный, белковый и гемоглобиновый. Первые три системы особенно важную роль играют в плазме крови, а гемоглобиновый буфер, самый мощный, действует в эритроцитах.
Бикарбонатный буфер является наиболее важной внеклеточной буферной системой и состоит из слабой угольной кислоты Н2СО3 и соли ее аниона – сильного основания 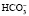
В нормальных условиях (при рН крови около 7,4) в плазме бикарбоната в 20 раз больше, чем углекислоты.
Емкость бикарбонатной системы составляет 53 % всей буферной емкости крови. При этом на бикарбонат плазмы приходится 35 % и на бикарбонат эритроцитов 18 % буферной емкости.
При образовании в плазме избытка кислореагирующих продуктов ионы водорода соединяются с анионами бикарбоната (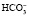
Бикарбонатный буфер способен нейтрализовать и избыток оснований. В этом случае ионы ОНˉ будут связаны углекислотой и вместо самого сильного основания ОНˉ образуется менее сильное 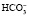
До тех пор, пока количество угольной кислоты и бикарбоната натрия изменяется пропорционально и соотношение между ними сохраняется 1:20, рН крови остается в пределах нормы.
Фосфатный буфер представлен солями одно- и двузамещенных фосфатов. Фосфатная буферная система обеспечивает 5 % буферной емкости крови, является основной буферной системой клеток.
Однозамещенная соль обладает кислыми свойствами, так как при диссоциации дает ион 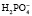
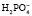
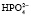
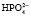
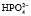
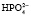
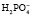
При нормальном рН в плазме соотношение фосфатных солей NаН2РО4: Nа2НРО4 = 1:4. Этот буфер имеет значение в почечной регуляции КОС, а также в регуляции реакции некоторых тканей. В крови же его действие главным образом сводится к поддержанию постоянства и воспроизводства бикарбонатного буфера.
Белковая буферная система является довольно мощным буфером, который способен проявлять свои свойства за счёт амфотерности белков. Белковая буферная система обеспечивает 7 % буферной емкости крови. Белки плазмы крови содержат достаточное количество кислых и основных радикалов, поэтому эта буферная система действует в зависимости от среды, в которой происходит диссоциация белков.
Гемоглобиновый буфер является самой емкой буферной системой. На ее долю приходится до 75 % всей буферной емкости крови. Свойства буферной системы гемоглобину придает главным образом его способность постоянно находиться в виде двух форм – восстановленного (редуцированного) гемоглобина ННb и окисленного (оксигемоглобина) НbО2.
Гемоглобиновый буфер, в отличие от бикарбонатного, в состоянии нейтрализовать как нелетучие, так и летучие кислоты. Окисленный гемоглобин ведёт себя как кислота, увеличивая концентрацию ионов водорода, а восстановленный (дезоксигенированный) – как основание, нейтрализуя H+.
Гемоглобин является классическим примером белкового буфера и эффективность его достаточно высока. Гемоглобин в шесть раз более эффективен как буфер, чем плазменные протеины.
Переход окисленной формы гемоглобина в восстановленную форму предупреждает сдвиг рН в кислую сторону во время контакта крови с тканями, а образование оксигемоглобина в легочных капиллярах предотвращает сдвиг рН в щелочную сторону за счет выхода из эритроцитов СО2 и иона хлора и образования в них бикарбоната.
Система аммиак/ион аммония (NH3/NH4+) – действует преимущественно в моче.
Помимо буферных систем в поддержании постоянства рН активное участие принимают физиологические системы, среди которых основными являются легкие, почки, печень, желудочно-кишечный тракт.
Система дыхания играет значительную роль в поддержании кислотно-щелочного баланса организма, однако для нивелирования сдвига рН крови им требуется 1–3 минуты. Роль легких сводится к поддержанию нормальной концентрации углекислоты, и основным показателем функционального состояния легких является парциальное напряжение углекислого газа в крови. Легочные механизмы обеспечивают временную компенсацию, так как при этом происходит смещение кривой диссоциации оксигемоглобина влево и уменьшается кислородная емкость артериальной крови.
При устойчивом состоянии газообмена легкие выводят углекислого газа около 850 г в сутки. Если напряжение углекислого газа в крови повышается сверх нормы на 10 мм рт. ст., вентиляция увеличивается в 4 раза.
Роль почек в регуляции активной реакции крови не менее важна, чем деятельность дыхательной системы. Почечный механизм компенсации более медленный, чем респираторный. Полноценная почечная компенсация развивается только через несколько дней после изменения pH.
Экскреция кислот при обычной смешанной пище у здорового человека превышает выделение оснований, поэтому моча имеет кислую реакцию (рН 5,3–6,5) и концентрация в ней ионов водорода примерно в 800 раз выше, чем в крови. Почки вырабатывают и выделяют с мочой количество ионов водорода, эквивалентное их количеству, непрерывно поступающему в плазму из клеток организма, совершая при этом замену ионов водорода, секретируемых эпителием канальцев, на ионы натрия первичной мочи. Этот механизм осуществляется с помощью нескольких химических процессов.
Первым из них является процесс реабсорбции натрия при превращении двузамещенных фосфатов в однозамещенные. При истощении фосфатного буфера (при рН мочи ниже 4,5) реабсорбция натрия и бикарбоната осуществляется за счет аммониогенеза.
Второй процесс, который обеспечивает задержку натрия в организме и выведение излишка ионов водорода, – это превращение в просвете канальцев бикарбонатов в угольную кислоту.
Третьим процессом, который способствует сохранению натрия в организме, является синтез в дистальных почечных канальцах аммиака (аммониогенез) и использование его для нейтрализации и выведения кислых эквивалентов с мочой.
Образовавшийся свободный аммиак легко проникает в просвет канальцев, где, соединяясь с ионом водорода, превращается в плохо диффундирующий аммонийный катион 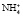
В общем итоге концентрация водородных ионов в моче может превышать концентрацию водородных ионов в крови в несколько сотен раз.
Это свидетельствует об огромной способности почек выводить из организма ионы водорода.
Почечные механизмы регуляции КОС не могут скорректировать рН в течение нескольких минут, как респираторный механизм, но они функционируют в течение нескольких дней, пока рН не вернется к нормальному уровню.
Регуляция КОС с участием печени. Печень окисляет до конечных продуктов недоокисленные вещества крови, оттекающей от кишечника; синтезирует мочевину из азотистых шлаков, в частности из аммиака и из хлорида аммония, поступающих из желудочно-кишечного тракта в кровь портальной вены; печени присуща выделительная функция и поэтому при накоплении в организме избыточного количества кислых или щелочных продуктов метаболизма они могут выделяться с желчью в желудочно-кишечный тракт. При избытке кислот в печени усиливается их нейтрализация и одновременно тормозится образование мочевины. Неиспользованный аммиак нейтрализует кислоты и увеличивает выведение аммонийных солей с мочой. При возрастании количества щелочных валентностей мочекинообразование возрастает, а аммониогенез снижается, что сопровождается уменьшением выведения с мочой аммонийных солей.
Концентрация водородных ионов в крови зависит также от деятельности желудка и кишечника. Клетки слизистой желудка секретируют соляную кислоту в очень высокой концентрации. При этом из крови ионы хлора выделяются в полость желудка в соединении с ионами водорода, образующимися в эпителии желудка с участием карбоангидразы. Взамен хлоридов в плазму в процессе желудочной секреции поступает бикарбонат.
Поджелудочная железа активно участвует в регуляции рН крови, так как она генерирует большое количество бикарбоната. Образование бикарбоната тормозится при избытке кислот и усиливается при их недостатке.
Кожа может в условиях избытка нелетучих кислот и оснований выделять последние с потом. Это имеет особое значение при нарушении функции почек.
Костная ткань. Это наиболее медленно реагирующая система. Механизм ее участия в регуляции рН крови состоит в возможности обмениваться с плазмой крови ионами Са2+ и Na+ в обмен на протоны Н+. Происходит растворение гидроксиапатитных кальциевых солей костного матрикса, освобождение ионов Са2+ и связывание ионов НРО42– с Н+ с образованием дигидрофосфата, который уходит с мочой. Параллельно при снижении рН (закисление) происходит поступление ионов H+ внутрь остеоцитов, а ионов калия – наружу.
Оценка кислотно-основного состояния организма
При изучении кислотно-щелочного баланса наибольшее значение имеет исследование крови. Показатели в капиллярной крови близки к показателям артериальной. В настоящее время показатели КОС определяют эквилибрационным микрометодом Аструпа. Данная методика позволяет, помимо истинного рН крови, получить показатель напряжения СО2 в плазме (рСО2), истинный бикарбонат крови (АВ), стандартный бикарбонат (SB), сумму всех оснований крови (ВВ) и показатель дефицита или избытка оснований (ВЕ).

