какую окраску приобретает лакмус в нейтральной среде
Лакмус
| Лакмус | |
 | |
 | |
| Общие | |
|---|---|
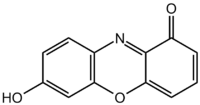
| Систематическое наименование | 7-гидроксифеноксазон (хромофорный компонент лакмуса) |
| Традиционные названия | Лакмус |
| Термические свойства | |
| Классификация | |
| Рег. номер CAS | 1393-92-6 |
| Регистрационный номер EC | 215-739-6 |
Лакмус (от нидерл. lakmoes ) — красящее вещество природного происхождения, один из первых и наиболее широко известных кислотно-основных индикаторов.
Наименование стандартного химического препарата «лакмусовая бумага» стало нарицательным в русском языке, как в химии для всех типов индикаторных бумаг, так и в повседневной жизни при описании знаковых явлений и событий.
Содержание
Свойства
В чистом виде представляет собой тёмный порошок со слабым запахом аммиака. Хорошо растворяется в чистой воде, образуя растворы фиолетового цвета. В кислых средах (pH 8,3) — синюю.
У лакмуса, по сравнению с остальными индикаторами, сравнительно небольшая погрешность в определении среды вещества.
Состав
| Лакмус (pH индикатор) | ||
| нижний предел pH 4.5 | верхний предел pH 8.3 | |
| red | ↔ | blue |
Фактически природный лакмус представляет собой сложную смесь 10—15 различных субстанций. Основными компонентами лакмуса считаются [1] :
Также экстракционным разделением из лакмуса могут быть выделены:
Применение
Применяется как индикатор для определения реакции среды. На практике используется несколько препаративных форм лакмуса: водный раствор лакмуса, полоски и клочки ленты фильтровальной бумаги, пропитанные лакмусом — т. н. лакмусовая бумага, «лакмусовое молоко» (нем. Lackmusmilch ).
Происхождение
Добывается из растительного сырья, в частности из некоторых лишайников: Roccella tinctoria ((о-ва Кабо-Верде, Канарские о-ва, Мадейра, Азорские о-ва, западное побережье Южной Америки), Roccella fuciformis (Ангола и Мадагаскар), Roccella pygmaea (Алжир), Roccella phycopsis, Lecanora tartarea (Норвегия, Швеция), Variolaria dealbata (Пиренеи и Аверн), Ochrolechia parella (северо-запад Атлантического побережья Европы), Parmotrema tinctorum (Канарские острова), из различных видов рода Parmelia, Dendrographa leucophoea (США, Калифорния). Основными производителями лакмуса являются Мозамбик (из Roccella montagnei) и США (из Dendrographa leucophoea).
Получение
В течение длительного времени производство лакмуса было монополизировано и подробности методов его выделения были неизвестны.
Изначально для получения лакмуса применялся следующий способ:
Современный способ получения орцеинового пигмента и лакмуса запатентованный двумя английскими химиками (G. Gordon и Cuthbert Gordon) в 1758г заключался в следующем:
История
В 1640 году ботаники описали красящее вещество, которое они получали из душистого растения с тёмно-лиловыми цветками — гелиотропа. Химики вскоре стали использовать этот краситель в качестве индикатора (в растворах кислот он становился красным, а в щелочах синим). Изначально лакмус использовали в основном для исследования минеральных вод, но с 1670-х годов им в полной мере заинтересовались химики. Французский химик Пьер Поме писал:
Мнемоническое правило
Для того, чтобы запомнить цвет лакмуса в различных средах, существует стихотворение:
Индикатор лакмус — красный
Кислоту укажет ясно.
Индикатор лакмус — синий,
Щёлочь здесь — не будь разиней,
Когда ж нейтральная среда,
Он фиолетовый всегда.
Но есть также небольшое словосочетание, которое тоже частично раскрывает индикаторные свойства лакмуса: лак краскис (слышится как «лак раскис»). Данное словосочетание означает, что «ЛАКмус КРАСный в КИСлоте».
Среда растворов.Индикаторы
Содержание
Среда растворов.Индикаторы [ править ]
Вода и водные растворы окружают нас повсюду. В воде и в водных растворах присутствуют ионы H+ и OH-.Избыток или недостаток этих ионов определяет среду растовора.

Типы сред водных растворов [ править ]
Водородным показателем рН называется отрицательный десятичный логарифм концентрации ионов водорода. Если концентрация ионов водорода равна 10−7 моль/л, то рН = 7; рН может принимать значения от 0 до 14.
Среды водных растворов [ править ]
Различают три основных типа сред водных растворов: Нейтральная среда — среда, в которой концентрация ионов водорода равна концентрации гидроксид-ионов (рН = 7 ). Кислая среда — среда, в которой концентрация ионов водорода больше концентрации гидроксид-ионов (рН 7 ). При значениях водородного показателя рН: от 0 до 3 среда водного раствора считается сильнокислой, от 4 до 6 — слабокислой, 7 — нейтральной, от 8 до 10 — слабощелочной, от 11 до 14 — сильнощелочной.
Чем меньше рН, тем больше кислотность водного раствора. Чем больше рН, тем больше щелочность водного раствора.
Индикаторы [ править ]
Среду водных растворов экспериментально можно определить различными способами. Одним из способов является применение индикаторов, изменяющих свою окраску при изменении среды раствора.
Индикаторы— вещества, обратимо изменяющие цвет в зависимости от среды раствора. В качестве индикаторов чаще всего на практике используют:
В кислой среде и метилоранж, и лакмус приобретают красный цвет. Вспомним правила смешивания цветов! Из каких двух цветов при смешивании можно получить оранжевый? Из красного и жёлтого. Действительно, в щелочной среде метилоранж приобретает жёлтый цвет. Красный и синий цвета при смешивании дают фиолетовый. Лакмус в щелочной среде становится синим. Оба индикатора более удобны на практике для определения кислой среды.
2)Фенолфталеин является индикатором на щелочную среду. Только в ней он приобретает яркую малиновую окраску. В остальных средах он бесцветный.
3)Универсальный индикатор изменяет окраску в широком диапазоне значений рН раствора.
Значение различных сред растворов и их определения [ править ]
Характер среды раствора имеет большое значение при протекании химических и биологических процессов. В зависимости от реакции среды эти процессы могут идти с разными скоростями и в разных направлениях. Поэтому определение pH среды растворов очень важно в медицине, науке, технике, сельском хозяйстве.
Постоянство концентраций ионов водорода — важный показатель внутренней среды живых организмов.
Cреда водных растворов веществ. Индикаторы
Материалы портала onx.distant.ru
Определение характера среды водных растворов веществ. Индикаторы.
Среда водных растворов
[ Н + ] = [ ОН – ]
[ Н + ] > [ ОН – ]
[ Н + ] ОН – ]
Для характеристики кислотности среды используют водородный показатель рН. Он определяется, как отрицательный десятичный логарифм концентрации ионов водорода. В нейтральной среде рН равен 7, в кислой — меньше 7, в щелочной — больше 7.
| Кислая среда | Нейтральная среда | Щелочная среда |
| [Н + ] > [ОН – ] | [Н + ] = [ОН – ] | [Н + ] – ] |
| pH | pH = 7 | pH > 7 |
Индикаторы
Для определения среды раствора используют специальные вещества, которые изменяют цвет в зависимости от среды раствора: индикаторы. В зависимости от среды эти вещества могут переходить в разные формы с различной окраской.
Чаще всего используют следующие индикаторы: лакмус, метилоранж, фенолфталеин.
Окраска индикаторов в различных средах:
| Индикатор/среда | Кислая | Нейтральная | Щелочная |
| Лакмус | Красный | Фиолетовый | Синий |
| Метилоранж | Красный | Оранжевый | Желтый |
| Фенолфталеин | Бесцветный | Бесцветный | Малиновый |
Растворы кислот и оснований
Характер среды определяется процессами, которые происходят с веществами в растворе. Кислот, основания и соли в воде диссоциируют на ионы. Кислоты диссоциируют на катионы водорода H + и анионы кислотных остатков:
HA = H + + A –
Сильные кислоты диссоциируют в разбавленных растворах практически полностью, поэтому среда разбавленных растворов сильных кислот, как правило, сильно кислотная. Некоторые кислоты (слабые) диссоциируют частично, поэтому среда водных растворов слабых кислот — слабо кислая.
Основания диссоциируют на катионы металлов и гидроксид-анионы ОН – :
МеОH = Ме + + ОН –
Растворы солей
Попадая в воду, соли диссоциируют на катионы металлов (или ион аммония NH4 + ) и анионы кислотных остатков.
Fe 3+ + HOH ↔ FeOH 2+ + H +
CH3COO — + HOH ↔ CH3COOH + OH —
В зависимости от состава соли водные растворы солей могут иметь кислую, нейтральную или щелочную среду.
Типы гидролиза солей в водных растворах:
| Катио н/анион | Катион сильного основания | Катион слабого основания |
| Анион сильной кислоты | Гидролиз не идет | Гидролиз по катиону |
| Анион слабой кислоты | Гидролиз по аниону | Гидролиз по катиону и аниону |
Среда водных растворов солей:
| Катио н/анион | Катион сильного основания | Катион слабого основания |
| Анион сильной кислоты | Нейтральная | Кислая |
| Анион слабой кислоты | Щелочна я | Нейтральная* |
* на практике среда водных растворов солей, образованных слабым основанием и слабой кислотой, определяется силой кислоты и основания
Тип гидролиза и среда водных растворов некоторых солей:
| Катио н/анион | Na + | NH4 + |
| Cl – | NаCl, гидролиз не идет, среда нейтральная | (NH4)2CO3 гидролиз по катиону, среда щелочная |
| CO3 2 – | Na2CO3, гидролиз по аниону, среда щелочна я | Na2CO3, гидролиз по катиону и аниону, среда определяется силой кислоты и основания |
Индикаторы будут по-разному окрашиваться в водных растворах таких солей, в зависимости от среды. Таким образом, с помощью индикаторов можно различить водные растворы некоторых солей.
Окраска лакмуса в водных растворах солей, в зависимости от строения соли:
| Катио н/анион | Катион сильного основания | Катион слабого основания |
| Анион сильной кислоты | Лакмус фиолетовый | Лакмус красный |
| Анион слабой кислоты | Лакмус синий | Окраска лакмуса зависит от силы кислоты и основания |
Окраска лакмуса в водных растворах некоторых солей:
| Катио н/анион | Na + | NH4 + |
| Cl – | NаCl, лакмус фиолетовый | (NH4)2CO3 лакмус красный |
| CO3 2 – | Na2CO3, лакмус синий | Na2CO3, окраска лакмуса зависит от силы кислоты и основания |
Добавить комментарий Отменить ответ
Этот сайт использует Akismet для борьбы со спамом. Узнайте, как обрабатываются ваши данные комментариев.
Какую окраску приобретает лакмус в нейтральной среде
Установите соответствие между формулой соли и окраской лакмуса в её водном растворе: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ФОРМУЛА СОЛИ | ОКРАСКА ЛАКМУСА |





