какую окраску имеет хлорид серебра
Свойства, особенности и применение хлорида серебра
В таблице Менделеева нет такого элемента, как AgCl, или хлорид серебра. Он образуется при соединении хлора одновалентного (Cl) с серебром (Ag) такой же валентности.
Образующий соединение хлор (Cl) является галогеном и выступает активным окисляющим веществом, встретить его в природе отдельно большая редкость. Ag является благородным металлом, чистое серебро химически инертно и потому практически не участвует в каких-либо реакциях. Может существовать в форме слитков, самородков, серебряных жил и россыпей.
Серебро в несколько раз более активно, нежели хлор, и для того чтобы образовался хлорид серебра, следует провести операцию, где серебросодержащая соль будет взаимодействовать с хлоридами. К примеру, взаимодействующими элементами могут быть нитрат серебра и хлорид натрия.
Взаимодействие этих веществ осуществляется в ходе реакции замещения, итогом которой является образование белого осадка. Полученное соединение не отличается стойкостью. Попадая под солнечные лучи, осадок темнеет, выделяются молекулы серебра, вступающие в реакцию с молекулами серы в атмосфере. Именно по этой причине темнеют все серебряные изделия.
Особенности
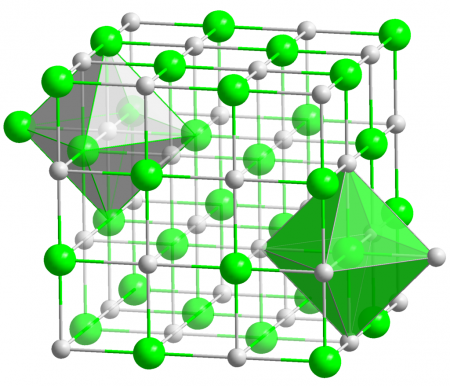
Хлорид серебра имеет кристаллическую структуру. Форма кристаллов кубическая. Расположенный в центре атом соединяется с другими атомами и образует октаэдр. AgCl имеет следующие химические особенности:
Работа с хлоридом серебра
Физические свойства хлористого серебра таковы:
Хлорид серебра — твердое вещество. По шкале твердости соединение оценивается в 2,5 балла. После плавки образуется практически прозрачная масса желто-коричневого цвета, известная как «роговое серебро».
Полученное серебро из хлорида серебра
Применение
AgCl обладает повышенной чувствительностью к свету. Это его свойство используется при изготовлении фотографических эмульсий. Соединение применяется в процессе производства хлор-серебряно-цинковых батарей, а также как покрытие для радаров.
Хлорид серебра входит в состав веществ, из которых изготавливают электропроводящие стекла и линзы для спектрометров. При производстве электродов химических источников тока также используют AgCl. Пытаясь получить рассматриваемое соединение в домашних условиях, действовать следует осторожно. Попав на кожу, вещество может вызвать раздражение.
Свойства хлорида серебра
Если подружить благородный металл серебро и соляную кислоту, получится хлорид серебра — бесцветные кристаллы или белая соль, способная плавиться при температуре 455° С и кипеть без разложения при 1554° С. Популярность пришла на заре развития фотографии. Способность изменять цвет завораживала. Но помимо светочувствительности, соединение хлора с серебром несет в себе много других замечательных свойств.
И целой страны мало
Серебро по латыни аргентум, поэтому обозначено в химии Ag. В честь него названа целая страна Аргентина, хотя рудники и добыча ведется по всему миру не одно тысячелетие. Есть стойкое убеждение, что запасов его гораздо меньше, чем золота, и придет время, когда их положение в иерархии драгоценностей поменяется. Время покажет, оправданы такие ожидания или нет.
А пока серебро широко используется не только ювелирами. Оно, как в чистом виде, так и в соединениях, широко используется в промышленности и в технике.
Формула хлорида серебра очень проста: одновалентный хлор соединяется с одновалентным Ag и на выходе получают вещество, которое записывается символом AgCl. Но в действительности процесс несколько сложнее. Хлор относится к группе галогенов, активных элементов 17-й группы периодической таблицы Д. И. Менделеева. Галоген с греческого «порождающий соль», потому что все галогены — активные окислители, в чистом виде в природе практически не встречаются.
Серебро, наоборот, принадлежит сообществу благородных металлов, включающему помимо него золото и платиновую группу. Все они, в той или иной степени, химически инертны, «неохотно» вступают в химические реакции. В природе существуют в соединениях и в чистом виде, таком как слитки, самородки, жилы и россыпи, за что их ценят ювелиры и монетные дворы.
Оно более активно, чем золото. Чтобы получить его хлорид, запускают взаимодействие растворимых серебросодержащих солей, обычно — нитрата серебра, с хлоридами, той же поваренной солью. В результате реакции замещения происходит выпадение осадка белого цвета. Соединение нестойкое, через некоторое время под воздействием света темнеет, потому что происходит выделение молекул чистого аргентума, которые соединяются с молекулами серы.
Сероводород всегда присутствует в атмосфере, вот почему серебряные вещи тускнеют и покрываются патиной. Соль, меняющая цвет, подтолкнула к идее фотографического изображения.
Вещество одно, свойств много
У хлорида серебра кристаллическая структура кубического вида, где центральный атом образует с соседями октаэдр, почти такой же, как у поваренной соли NaCl (хлорид натрия). Но в отличие от последней, плохо растворим в воде. При 25° C произведение растворимости составляет всего 1,77•10−10. Показатели растворимости AgCl в минеральных маслах нулевые. Он не растворяется в минеральных кислотах, этиловом и метиловом спирте, ацетоне. Зато растворим в водных растворах аммиака и в жидком аммиаке.
Модель молекулы аммиака
Аммиак — активное соединение водорода и азота, при его окислении образуются кислоты азота, которые легко увлекают металлы, создавая с ними соли, относящиеся к азотнокислым. В частности, нитрат серебра (формула AgNO3) — кристаллическое вещество, используемое для гальванического серебрения, в производстве зеркал, в медицине (ляпис) и для получения других соединений серебра, в том числе хлорида.
Светочувствительность AgCl, когда цвет меняется на глазах, быстро нашла применение в фотографии, но развитие химии показало, что бромид серебра обладает лучшими свойствами менять цвет под воздействием света.
Тем не менее, AgCl нашел себя в других областях человеческой деятельности. В первую очередь, в медицине и косметике, ведь антибактерицидные свойства серебра известны давно. Вода, в которую опустили серебряный крестик, не портится и не зацветает, становится святой.
И для людей, и для науки
Любое полезное свойство быстро находит применение. Препараты, в основе которых хлорид серебра, встречаются:
В промышленности используется не менее широко:
AgCl большей частью производится лабораторным способом, но его можно встретить и в природе в виде минерала хлораргирита.
При работе всегда есть опасность раздражения на коже и на слизистых оболочках с последующими осложнениями.
Хлорид серебра, характеристика, свойства и получение, химические реакции
Хлорид серебра, характеристика, свойства и получение, химические реакции.
Хлорид серебра – неорганическое вещество, имеет химическую формулу AgCl.
Краткая характеристика хлорида серебра:
Хлорид серебра – неорганическое вещество белого цвета. При плавлении становится оранжево-желтым. Застывая, расплав образует полупрозрачную массу, называемую в обиходе «роговое серебро».
Химическая формула хлорида серебра AgCl.
Хлорид серебра – неорганическое химическое соединение, соль хлороводородной (соляной) кислоты и серебра, бинарное соединение серебра и хлора.
Практически не растворяется в воде, ацетоне, этаноле, метаноле.
Кристаллогидратов не образует.
Хлорид серебра встречается в природе в виде минерала хлораргирита.
Физические свойства хлорида серебра:
| Наименование параметра: | Значение: |
| Химическая формула | AgCl |
| Синонимы и названия иностранном языке | silver chloride (англ.) |
серебро хлористое (рус.)
хлораргирит (рус.)
Получение хлорида серебра:
Хлорид серебра получают в результате следующих химических реакций:
В ходе реакции используется разбавленный раствор хлорида калия.
В ходе реакции используется разбавленный раствор хлорида натрия.
2Ag + Cl2 → 2AgCl (t = 150-200 °C).
Химические свойства хлорида серебра. Химические реакции хлорида серебра:
Химические свойства хлорида серебра аналогичны свойствам хлоридов других металлов. Поэтому для него характерны следующие химические реакции:
1. реакция взаимодействия хлорида серебра и фтора:
В результате реакции образуются фторид серебра (II) и хлор.
2. реакция взаимодействия хлорида серебра и цинка :
2AgCl + Zn = ZnCl2 + 2Ag.
В результате реакции образуются хлорид цинка и серебро.
3. реакция взаимодействия хлорида серебра и оксида бария :
4AgCl + 2BaO → 2BaCl2 + 4Ag + O2 (t > 324°C).
В результате реакции образуются хлорид бария, серебро и кислород.
4. реакция взаимодействия хлорида серебра и гидроксида калия:
4AgCl + 4KOH → 4KCl + 4Ag + O2 + 2H2O (t > 450 °C).
5. реакция взаимодействия хлорида серебра и сульфида натрия:
В результате реакции образуются сульфид серебра (II) и хлорид натрия.
6. реакция взаимодействия хлорида серебра и йодида натрия:
AgCl + NaI ⇄ AgI + NaCl.
В результате реакции образуются йодид серебра и хлорид натрия. Реакция носит обратимый характер.
7. реакция взаимодействия хлорида серебра и карбоната натрия :
4AgCl + 2Na2CO3 → 4Ag + 4NaCl + 2CO2 + O2 (t = 850-900 °C).
8. реакция взаимодействия хлорида серебра и нитрата бария:
9. реакция взаимодействия хлорида серебра, пероксида водорода и гидроксида калия :
10. реакция разложения хлорида серебра:
Применение и использование хлорида серебра:
Хлорид серебра используется во множестве отраслей промышленности и для бытовых нужд:
– как светочувствительный компонент фотографических эмульсий различных фотографических материалов ;
– входит в состав антимикробных композиций на основе ионов серебра;
– в химической промышленности как реагент для получения сереброорганических соединений;
– как компонент электродов химических источников тока, электропроводящих стёкол;
– как материал для линз в ИК-спектроскопии.
Примечание: © Фото https://www.pexels.com, https://pixabay.com
хлорид серебра реагирует кислота 1 2 3 4 5 вода
уравнение реакций соединения масса взаимодействие хлорида серебра
реакции
Мировая экономика
Справочники
Востребованные технологии
Поиск технологий
О чём данный сайт?
Настоящий сайт посвящен авторским научным разработкам в области экономики и научной идее осуществления Второй индустриализации России.
Он включает в себя:
– экономику Второй индустриализации России,
– теорию, методологию и инструментарий инновационного развития – осуществления Второй индустриализации России,
– организационный механизм осуществления Второй индустриализации России,
– справочник прорывных технологий.
Мы не продаем товары, технологии и пр. производителей и изобретателей! Необходимо обращаться к ним напрямую!
Мы проводим переговоры с производителями и изобретателями отечественных прорывных технологий и даем рекомендации по их использованию.
О Второй индустриализации
Осуществление Второй индустриализации России базируется на качественно новой научной основе (теории, методологии и инструментарии), разработанной авторами сайта.
Конечным результатом Второй индустриализации России является повышение благосостояния каждого члена общества: рядового человека, предприятия и государства.
Вторая индустриализация России есть совокупность научно-технических и иных инновационных идей, проектов и разработок, имеющих возможность быть широко реализованными в практике хозяйственной деятельности в короткие сроки (3-5 лет), которые обеспечат качественно новое прогрессивное развитие общества в предстоящие 50-75 лет.
Та из стран, которая первой осуществит этот комплексный прорыв – Россия, станет лидером в мировом сообществе и останется недосягаемой для других стран на века.
Хлорид Серебра (свойства реакции применение)
Получение в лабораторных условиях

Реакцией растворимых солей с солями хлоридов :
Нагреванием сульфида серебра с хлоридом натрия в кислороде при нагревании 600°C :
Реакции хлорида серебра

4AgCl + 4КОН = 4КСl + 4Ag + O2 + 2Н2O
Нагревание хлорида натрия с оксидом бария при температуре выше 330°C приводит к свободному серебру хлориду бария и кислороду :
4AgCl + 2BaO = 2BaCl2 + 4Ag + O2

Соединение аммиакат серебра с ацетиленом дает стабильный ацетиленид серебра, который считается инициирующим взрывчатым веществом и работа с ним очень опасна так как ацетиленид легко детонирует от трения, удара и нагрева:
Единственный способ утилизации его реакция с серной кислотой.
Подобно ( нашатырному спирту ) реагирует с карбонатом аммония образуя комплексного соединения и углекислого газа :
AgCl + 2KCN = K[Ag(CN)2] + KCl
Реакция с (тиоцианидом, роданидом, сульфоцианидом) калия даёт сложное комплексное соединение при комнатной температуре и хлорид калия :
Применение хлорида серебра
Статья на тему хлорид серебра
Похожие страницы:
Понравилась статья поделись ей
Хлорид серебра I
Хлорид серебра I (хлористое серебро) — AgCl, неорганическое бинарное соединение серебра с хлором, серебряная соль хлороводородной (соляной) кислоты. В нормальных условиях представляет собой белый порошок или бесцветные кристаллы. Встречается в природе в виде минерала хлораргирита.
Содержание
Молекулярная и кристаллическая структура
Кристаллы AgCl принадлежат к кубической сингонии, структура типа NaCl, пространственная группа Fm3m, параметры элементарной ячейки a = 0,5549 нм, Z = 4. Центральный атом образует с соседями октаэдр, координационное число равно 6.
В газовой фазе хлорид серебра существует в форме мономера, димера и тримера.
Физические свойства
Хлорид серебра — белое или бесцветное вещество, плавящееся и кипящее без разложения. В расплавленном состоянии имеет жёлто-коричневый цвет. Застывая, расплав образует полупрозрачную массу, называемую в обиходе «роговое серебро».
Зависимость давления насыщенного пара (P, в барах) для соединения в диапазоне температур (T) от 1185 до 1837 K выражается следующим уравнением:
log10 P = 4,95155 − 8775,980/T−62,718
Получение
Хлорид серебра образуется в виде белого осадка при взаимодействии растворимых солей серебра, обычно — нитрата, с хлоридами (данная реакция является качественной на хлорид-анионы):
Химические свойства
Применение
Безопасность
Соединение может вызвать раздражающий эффект при контакте с кожей и слизистыми оболочками.