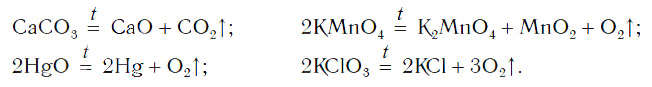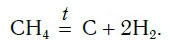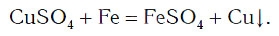какую химическую реакцию называют химической реакцией разложения
Реакции разложения
Фактором, вызывающим разложение, могут являться различные физические и химические воздействия. Соответственно, выделяют различные виды реакций разложения:
* биодеградация (биологический распад, биоразложение) — разложение в результате деятельности живых организмов;
* сольволиз — реакция обменного разложения между растворенным веществом и растворителем:
* алкоголиз — растворителем выступает какой-либо спирт;
* гидролиз — растворителем выступает вода;
* радиолиз — разложение под действием ионизирующих излучений;
* термолиз — под действием повышенной температуры:
* пиролиз — термическое разложение органических соединений без доступа воздуха.
* электролиз — разложение под действием электрического тока.
Связанные понятия
Реа́кция конденса́ции — исторически сложившееся название некоторых реакций с различными механизмами в органической химии. В более узком значении под реакцией конденсации понимают взаимодействие двух и более органических соединений, проходящее с образованием новой межуглеродной связи вида C—C.
Спирты являются обширным и очень разнообразным классом органических соединений: они широко распространены в природе, имеют важнейшее промышленное значение и обладают исключительными химическими свойствами.
Термин внутримолекулярный в химии описывает процесс или характеристику, свойства или явления, ограниченные в структуре одной молекулы.
Бина́рные соедине́ния — химические вещества, образованные двумя химическими элементами. Многоэлементные вещества, в формульной единице которых одна из составляющих содержит несвязанные между собой атомы нескольких элементов, а также одноэлементные или многоэлементные группы атомов (кроме гидроксидов и солей), рассматривают как бинарные соединения.
Вещества, изучаемые химией (chemical substance) — вещества, состоящие из атомов; вещества, в которых выделение атомов невозможно или теряет физический смысл (например, плазма или звёздное вещество), к предмету рассмотрения химией не относят. Состоящее из атомов вещество — основной объект изучения химии. Вещества в химии принято разделять на индивидуальные вещества (простые и сложные), организованные в атомы, молекулы, ионы и радикалы, и их смеси. Простое вещество образовано атомами одного химического.
Урок 13. Типы химических реакций
В уроке 13 «Типы химических реакций» из курса «Химия для чайников» мы узнаем о типах химических реакций; подробно рассмотрим каждый тип и научимся их различать.
Мир химических реакций весьма разнообразен. Самые различные химические реакции постоянно происходят в природе, осуществляются человеком. Можно ли классифицировать химические реакции? Что положить в основу их классификации? Сущность всякой химической реакции состоит в превращении веществ: разрушаются исходные вещества и образуются продукты реакций, меняется число и состав исходных веществ и продуктов реакции. Характер этих изменений и положен в основу классификации химических реакций.
Реакции соединения
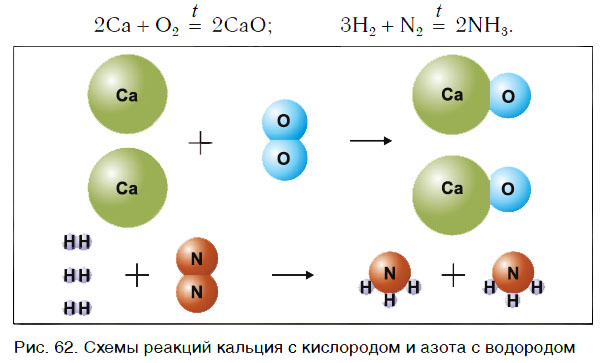
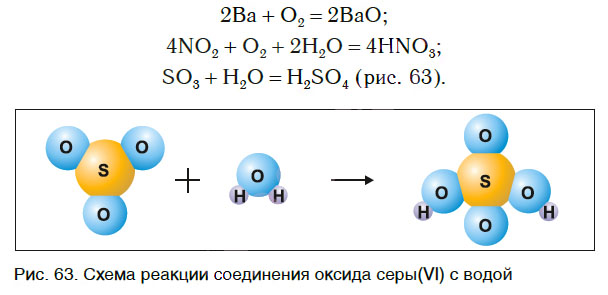
Рассмотрим уравнения следующих реакций (рис. 62):
Чем сходны данные реакции между собой? Тем, что в результате взаимодействия двух веществ получается только одно вещество. Такие реакции получили название реакций соединения.
Реакции соединения — это реакции, в результате которых из двух или нескольких веществ образуется одно новое сложное вещество.
В одних случаях из двух простых веществ получается одно сложное, в других — соединяются два и более простых или сложных веществ:
Реакции разложения
Рассмотрим уравнения следующих реакций:
Можно заметить, что из одного сложного вещества получается два или более новых веществ. Это реакции разложения. В них могут образовываться как простые, так и сложные вещества.
Реакции разложения — это реакции, в результате которых из одного сложного вещества образуется несколько новых веществ.
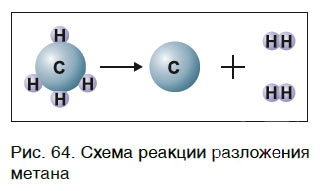
Для начала реакции разложения обычно необходимо нагреть исходные вещества. Например, негашеную известь CaO в промышленности получают нагреванием известняка CaCO3, реакция разложения происходит при температуре около 1000 °С. К такому типу реакций относится и реакция разложения метана CH4 (рис. 64) — составной части природного газа:
Реакции замещения
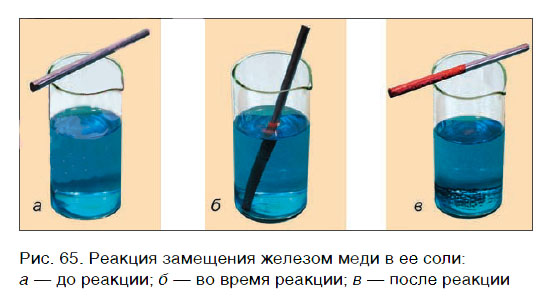
А могут ли взаимодействовать между собой два вещества: одно простое и одно сложное? Проверим это на опыте. В раствор медного купороса опустим небольшой кусочек железа — кнопку, гвоздь, канцелярскую скрепку с хорошо очищенной поверхностью. Через 2—3 мин извлечем железо из раствора и увидим, что на его поверхности образовался темно-красный налет меди. В химическую реакцию вступили простое (Fe) и сложное (CuSO4) вещества, и образовались новое простое (Cu) и новое сложное (FeSO4) вещества:
Из опыта и уравнения химической реакции хорошо видно, что атомы железа заместили атомы меди в сложном веществе (рис. 65). Такие химические реакции относятся к реакциям замещения.
Реакции замещения — это реакции, в результате которых атомы простого вещества замещают атомы одного из элементов в сложном веществе.
Для протекания таких реакций необходимо соблюдать некоторые особые условия. Не все простые вещества обязательно должны взаимодействовать со сложными веществами. В дальнейшем при изучении химии вы познакомитесь с этими условиями, а также с другими типами химических реакций.
Краткие выводы урока:
Надеюсь урок 13 «Типы химических реакций» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии. Если вопросов нет, то переходите к следующему уроку.
Какую химическую реакцию называют химической реакцией разложения
Классификацию органических реакций проводят на основе общих для всех реакций признаков: строение и состав исходных и конечных продуктов; изменение степеней окисления реагирующих частиц; тепловой эффект реакции; ее обратимость и т.п.
Наиболее часто органические реакции классифицируют по следующим признакам:
· по конечному результату реакции (на основе сопоставления строения исходных и конечных продуктов);
· по минимальному числу частиц, участвующих в элементарной реакции;
· по механизму разрыва ковалентных связей в реагирующих молекулах.
Тип многостадийных реакций определяют по самой медленной (лимитирующей) стадии. Различные способы классификации часто сочетаются друг с другом.
1. Классификация реакций по конечному результату
В основе этой классификации лежит сопоставление числа, состава и строения исходных и конечных продуктов по уравнению реакции. В соответствии с конечным результатом различают следующие типы органических реакций:
Если процесс сопровождается изменением степени окисления атома углерода в органическом соединении, то выделяют также реакции окисления и восстановления. Окисление и восстановление органических веществ может проходить по какому-либо из названных выше типов реакций.
Атом или атомная группировка в молекуле органического соединения замещается на другой атом (или атомную группировку):
Реакции этого типа можно рассматривать как реакции обмена, но в органической химии предпочтительней термин «замещение», поскольку в обмене участвует (замещается) лишь меньшая часть органической молекулы.
C2H6 + Cl2 (на свету) → CH 3 CH 2 Cl + HCl хлорирование этана
CH 3 CH 2 Cl + KOH (водн. р-р) → CH 3 CH 2 OH + KCl щелочной гидролиз хлорэтана
В реакциях присоединения молекула органического соединения и молекула простого или сложного вещества соединяются в новую молекулу, при этом другие продукты реакции не образуются:
К реакциям присоединения относятся также реакции полимеризации:
В реакции отщепления (элиминирования) происходит отрыв атомов или атомных групп от молекулы исходного вещества при сохранении ее углеродного скелета.
· отщепление хлороводорода (при действии на хлоралкан спиртовым раствором щёлочи)
· отщепление воды (при нагревании спирта с серной кислотой)
CH3-CH2OH → CH 2 =CH 2 + H 2 O дегидратация этанола
· отщепление водорода от алкана (в присутствии катализатора)
Реакции изомеризации или перегруппировки
В органическом соединении происходит переход (миграция) отдельных атомов или групп атомов от одного участка молекулы к другому без изменения ее качественного и количественного состава:
В этом случае исходное вещество и продукт реакции являются изомерами (структурными или пространственными).
Например, в результате перегруппировки может изменяться углеродный скелет молекулы:
В результате реакции разложения из молекулы сложного органического вещества образуется несколько менее сложных или простых веществ:
К этому типу реакций относится процесс крекинга – расщепление углеродного скелета крупных молекул при нагревании и в присутствии катализаторов:
Реакции разложения при высокой температуре называют пиролизом, например:
СН4 → C + 2H2 пиролиз метана (1000 o C)
Реакции окисления и восстановления
Если атом углерода в органической молекуле окисляется (отдает электроны более электроотрицательному атому), то этот процесс относят к реакциям окисления, т.к. продукт восстановления окислителя (обычно неорганическое вещество) не является конечной целью данной реакции. И наоборот, реакцией восстановления считают процесс восстановления атома углерода в органическом веществе.
Часто в органической химии ограничиваются рассмотрением реакций окисления и восстановления как реакций, связанных с потерей и приобретением атомов водорода и кислорода.
Вещество окисляется, если оно теряет атомы H и (или) приобретает атомы O. Кислородсодержащий окислитель обозначают символом [O]:
Вещество восстанавливается, если оно приобретает атомы H и (или) теряет атомы O. Восстановитель обозначают символом [H]:
Классификация реакций по числу частиц, участвующих в элементарной стадии
По этому признаку все реакции можно разделить на диссоциативные (мономолекулярные) и ассоциативные (бимолекулярные, тримолекулярные).
· Мономолекулярные реакции – реакции, в которых участвует только одна молекула (частица):
К этому типу относятся реакции распада и изомеризации. Процессы электролитической диссоциации также соответствуют этому типу, например:
Это самый распространенный тип элементарных реакций.
· Тримолекулярные реакции – реакции типа
в которых происходит столкновение трех молекул.
Тримолекулярные реакции встречаются довольно редко. Одновременное соударение большего числа частиц маловероятно.
Классификация реакций по механизму разрыва связей
В зависимости от способа разрыва ковалентной связи в реагирующей молекуле органические реакции подразделяются нарадикальные и ионные реакции. Ионные реакции в свою очередь делятся по характеру реагента, действующего на молекулу, наэлектрофильные и нуклеофильные.
Разрыв ковалентной связи может происходить двумя способами, обратными механизмам ее образования.
Разрыв связи, при котором каждый атом получает по одному электрону из общей пары, называется гомолитическим:
В результате гомолитического разрыва образуются сходные по электронному строению частицы, каждая из которых имеет неспаренный электрон. Такие частицы называются свободными радикалами.
Если при разрыве связи общая электронная пара остается у одного атома, то такой разрыв называется гетеролитическим:
Электрофильной называется реакция, в которой молекула органического вещества подвергается действию электрофильного реагента.
Электрофильные («любящие электроны») реагенты или электрофилы – это частицы (катионы или молекулы), имеющие свободную орбиталь на внешнем электронном уровне.
CH2=CH2 + HCl → CH3CH2Cl (электрофил – H + в составе HCl)
Механизм электрофильного присоединения обозначается символом AdE (по первым буквам английских терминов: Ad – addition [присоединение], E – electrophile [электрофил]).
Катион NO2 + образуется в смеси конц. кислот HNO3 и H2SO4.
Обозначение механизма – SE (S – substitution [замещение]).
Нуклеофильной называется реакция, в которой молекула органического вещества подвергается действию нуклеофильного реагента.
Строение некоторых нуклеофильных реагентов
Благодаря подвижности π-электронов, нуклеофильными свойствами обладают также молекулы, содержащие π-связи:
(Между прочим, это объясняет, почему этилен CH2=CH2 и бензол C6H6, имея неполярные углерод-углеродные связи, вступают в ионные реакции с электрофильными реагентами).
Примеры нуклеофильных реакций
Механизм нуклеофильного замещения обозначается символом SN (по первым буквам английских терминов: S – substitution [замещение], N – nucleophile [нуклеофил]).
Обозначение механизма – AdN (Ad – addition [присоединение]).
Классификация химических реакций
Темы кодификатора ЕГЭ: Классификация химических реакций в органической и неорганической химии.
В ходе химической реакции разрушаются химические связи, и образуются новые.
Химические реакции классифицируют по разным признакам. Рассмотрим основные виды классификации химических реакций.
Классификация по числу и составу реагирующих веществ
По составу и числу реагирующих веществ разделяют реакции, протекающие без изменения состава веществ, и реакции, протекающие с изменением состава веществ:
1. Реакции, протекающие без изменения состава веществ (A → B)
К таким реакциям в неорганической химии можно отнести аллотропные переходы простых веществ из одной модификации в другую:
Sромбическая → Sмоноклинная.
2. Реакции, протекающие с изменением состава
Как правило, в названии таких реакций есть приставка «де». Реакции разложения в органической химии происходят, как правило, с разрывом углеродной цепи.
2KI + Cl2 → 2KCl + I2.
Замещаться могут как отдельные атомы, так и молекулы.
В органической химии реакции замещения — это такие реакции, в ходе которых часть органической молекулы замещается на другие частицы. При этом замещенная частица, как правило, соединяется с частью молекулы-заместителя.
По числу частиц и составу продуктов взаимодействия эта реакция больше похожа на реакцию обмена. Тем не менее, по механизму такая реакция является реакцией замещения.
AB + CD = AC + BD
К реакциям обмена относятся реакции ионного обмена, протекающие в растворах; реакции, иллюстрирующие кислотно-основные свойства веществ и другие.
Пример реакции обмена в неорганической химии — нейтрализация соляной кислоты щелочью:
NaOH + HCl = NaCl + H2O
Пример реакции обмена в органической химии — щелочной гидролиз хлорэтана:
Классификация химических реакций по изменению степени окисления элементов, образующих вещества
По изменению степени окисления элементов химические реакции делят на окислительно-восстановительные реакции, и реакции, идущие без изменения степеней окисления химических элементов.
В неорганической химии к таким реакциям относятся, как правило, реакции разложения, замещения, соединения, и все реакции, идущие с участием простых веществ. Для уравнивания ОВР используют метод электронного баланса (количество отданных электронов должно быть равно количеству полученных) или метод электронно-ионного баланса.
В органической химии разделяют реакции окисления и восстановления, в зависимости от того, что происходит с органической молекулой.
Реакции окисления в органической химии — это реакции, в ходе которых уменьшается число атомов водорода или увеличивается число атомов кислорода в исходной органической молекуле.
Реакции восстановления в органической химии — это реакции, в ходе которых увеличивается число атомов водорода или уменьшается число атомов кислорода в органической молекуле.
Классификация реакций по тепловому эффекту
По тепловому эффекту реакции разделяют на экзотермические и эндотермические.
Экзотермические реакции — это реакции, сопровождающиеся выделением энергии в форме теплоты (+Q). К таким реакциям относятся почти все реакции соединения.
Исключения — реакция азота с кислородом с образованием оксида азота (II) — эндотермическая:
Реакция газообразного водорода с твердым йодом также эндотермическая:
Экзотермические реакции, в ходе которых выделяется свет, называют реакциями горения.
Также экзотермическими являются:
Эндотермические реакции — это реакции, сопровождающиеся поглощением энергии в форме теплоты (— Q). Как правило, с поглощением теплоты идет большинство реакций разложения (реакции, требующие длительного нагревания).
Также эндотермическими являются:
Классификация химических реакций по агрегатному состоянию реагирующих веществ (по фазовому составу)
Для классификации реакций по фазовому состоянию полезно уметь определять фазовые состояния веществ. Это достаточно легко сделать, используя знания о строении вещества, в частности, о типах кристаллической решетки.
Вещества с ионной, атомной или металлической кристаллической решеткой, как правило твердые при обычных условиях; вещества с молекулярной решеткой, как правило, жидкости или газы при обычных условиях.
Обратите внимание, что при нагревании или охлаждении вещества могут переходить из одного фазового состояния в другое. В таком случае необходимо ориентироваться на условия проведения конкретной реакции и физические свойства вещества.
Таким образом, паровая конверсия метана — гомогенная реакция.
Классификация химических реакций по участию катализатора
Катализатор — это такое вещество, которое ускоряет реакцию, но не входит в состав продуктов реакции. Катализатор участвует в реакции, но практичсеки не расходуется в ходе реакции. Условно схему действия катализатора К при взаимодействии веществ A + B можно изобразить так: A + K = AK; AK + B = AB + K.
В зависимости от наличия катализатора различают каталитические и некаталитические реакции.
Все реакции, протекающие с участием в клетках живых организмов, протекают с участием особых белковых катализаторов — ферментов. Такие реакции называют ферментативными.
Более подробно механизм действия и функции катализаторов рассматриваются в отдельной статье.
Классификация реакций по способности протекать в обратном направлении
Обратимые реакции — это реакции, которые могут протекать и в прямом, и в и обратном направлении, т.е. когда при данных условиях продукты реакции могут взаимодействовать друг с другом. К обратимым реакциям относятся большинство гомогенных реакций, этерификация; реакции гидролиза; гидрирование-дегидрирование, гидратация-дегидратация; получение аммиака из простых веществ, окисление сернистого газа, получение галогеноводородов (кроме фтороводорода) и сероводорода; синтез метанола; получение и разложение карбонатов и гидрокарбонатов, и т.д.
Необратимые реакции — это реакции, которые протекают преимущественно в одном направлении, т.е. продукты реакции не могут взаимодействовать друг с другом при данных условиях. Примеры необратимых реакций: горение; реакции, идущие со взрывом; реакции, идущие с образованием газа, осадка или воды в растворах; растворение щелочных металлов в воде; и др.