какую функцию выполняют белки мембраны клетки
Мембранные белки. Особенности строения, локализация, функции
» data-shape=»round» data-use-links data-color-scheme=»normal» data-direction=»horizontal» data-services=»messenger,vkontakte,facebook,odnoklassniki,telegram,twitter,viber,whatsapp,moimir,lj,blogger»>
Мембранные белки – особенности строения
Если липиды – относительно низкомолекулярые соединения с молекулярным весом около 1000 дальтон (1 килодальтон, кДа), то белки относятся к высокомолекулярным соединениям. Их молекулярный вес достигает 1000 кДа и более.
Некоторые аминокислоты плохо укладываются в спирали и возникает так называемая β-складчатая структура. Кроме того, остатки цистеина, даже расположенные на большом расстоянии друг от друга, могут сшиваться между собой ковалентными S–S связями. В результате белковая молекула сворачивается в компактную глобулу. Глобулярная структура характерна для белков, функционирующих в гидрофильной среде (в цитоплазме). Имеются и белки, которые в силу особенностей аминокислотного состава (в частности, низкого содержания пролина) принимают форму длинных фибрилл (фибриллярные белки).
Поскольку функции белков определяются особенностями их структуры и упаковки, ученые обращают особое внимание на это обстоятельство. Различают несколько видов белковых структур, различающихся по сложности. Последовательность аминокислот называют первичной структурой, поскольку именно она во многом определяет свойства белковой молекулы. По-видимому, именно в первичной структуре «записана» информация о том, какая будет вторичная структура белка, составленная из α-спиралей и β-складок. Белковые глобулы рассматривают как пример третичной структуры – на ее уровне формируется специфическая ферментативная, рецепторная и другие виды активности белковой молекулы. При ассоциации нескольких глобул определенным образом между собой образуется четвертичная структура, приобретающая способность тонкой регуляции белковых функций. Как происходит образование белковых ассоциатов при формировании четвертичной структуры?
Если полярных участков в молекуле белка недостаточно для того, чтобы изолировать гидрофобные участки глобулы от соприкосновения с водой, то часть из них окажется на поверхности. Для того, чтобы уменьшить невыгодные контакты с водой, гидрофобные белки образуют ассоциаты, состоящие из нескольких субъединиц. Именно такое строение имеет подавляющее число мембранных белков, поэтому можно предположить, что в их составе преобладают аминокислоты с неполярными радикалами. Для ряда мембранных белков это действительно справедливо.
Рис. 24. Структура гликопротеина
Молекула гликопротеина состоит из белкового остова, к которому присоединены сахарные цепочки. Длина и состав цепочек могут варьировать. Заштрихованными фигурами обозначены радикалы аминокислот. Важный белковый компонент мембраны – гликопротеины – белковые молекулы, содержащие углеводные цепочки (рис. 24). Периферические белки или домены интегральных белков, расположенные на наружной поверхности мембраны, почти всегда гликозилированы.
Углеводные цепочки гликопротеинов имеют разнообразную структуру. Роль гликопротеинов в жизни клетки многообразна. Некоторые из них играют роль ферментов, другие обладают гормональной активностью. Предполагают, что одна из функций процесса гликозилирования – обеспечить возможность белкам, синтезированным в аппарате Гольджи, транспорта через клеточную мембрану. Гликопротеины, расположенные на поверхности клеток, ответственны за такие важные процессы, как взаимное распознавание клеток – с их помощью клетки многоклеточного организма устанавливают межклеточные контакты. Они, по-видимому, также служат материалом, склеивающим клетки одного типа между собой. Предполагают также, что от структуры гликопротеинов зависят устойчивость и многие другие свойства клеточной поверхности. Гликозилированные белки обладают резистентностью к протеолизу и поэтому имеют большую длительность жизни. Гликопротеины, находящиеся на поверхности эритроцитов, определяют группу крови.
ЛОКАЛИЗАЦИЯ И ПОДВИЖНОСТЬ БЕЛКОВ В БИСЛОЕ
Мембраны содержат от 20 до 80% белка (по весу). При этом в разных мембранах количество белков существенно различается. Так, в мембранах митохондрий на долю белков приходится около 75%, а в плазматической мембране клеток миелиновой оболочки – около 25%. Так как липидные молекулы имеют небольшой размер (5 Å) и невысокую молекулярную массу, их число в 50 раз больше числа белковых молекул. Поэтому белковые молекулы как бы вкраплены в липидный бислой мембраны.
Белки различаются по своему положению в мембране (рис. 25). Молекулы белков могут глубоко проникать в липидный бислой и пронизывать его (интегральные белки), либо прикрепляться к мембране разными способами (периферические белки). Периферические белки отличаются от интегральных меньшей глубиной проникновения в бислой и более слабыми белок-липидными взаимодействиями (то есть меньшей зависимостью от бислоя). Периферические белки могут обратимо менять свой статус, прикрепляясь к мембране на определенное время (такие белки называют амфипатическими). Прикрепляясь к мембране, они взаимодействуют либо с интегральными белками, либо с поверхностными участками липидного бислоя, приобретая новые свойства. Деление мембранных белков на периферические и интегральные определяется их структурой, количеством гидрофобных аминокислот и их расположением в первичной структуре, то есть всеми теми свойствами, которые обеспечивают взаимодействие белка с бислоем. Для амфипатических белков имеются специальные сигналы, стимулирующие их ассоциацию с мембраной (часто таким сигналом является их фосфорилирование специфическими киназами, изменяющее их третичную структуру и гидрофобность, точнее – лиотропность). К таким белкам, например, относят протеинкиназу С, факторы свертывания крови.
Белки, образующие комплексы с интегральными белками (к ним относится ряд пищеварительных ферментов, участвующих в гидролизе крахмала и белков), прикрепляются к интегральным белкам мембран микроворсинок кишечника. Примерами таких комплексов могут быть сахараза-изомальтаза и мальтаза-гликоамилаза. Полярные или заряженные домены белковой молекулы могут взаимодействовать с полярными «головами» липидов, образуя ионные и водородные связи.
Интересный пример регулируемого взаимодействия с мембраной был обнаружен при изучении аминокислотной последовательности интактной формы микросомного цитохрома b5 (рис. 25). Этот белок участвует в различных окислительно-восстановительных реакциях в качестве переносчика электронов. Его относительно короткий участок пептидной цепи вблизи карбоксильного конца состоит сплошь из гидрофобных аминокислот. Если «гидрофобный якорь» удалить с помощью протеолиза, гемсвязывающий домен теряет связь с мембраной и высвобождается в среду. Локализованный в мембране гидрофобный домен или «якорь» является еще одним характерным элементом структуры мембранных белков. С помощью такой структуры происходит закрепление периферических белков в мембране. Согласно классификации, интегральные белки пронизывают липидный бислой. Размер интегральных мембранных белков в среднем составляет 80 Å, но встречаются и более крупные белки – до 350 Å величиной (белок тилакоидов хлоропластов).
Обычно эти белки обладают выраженной асимметрией и, соответственно, асимметрично расположены в мембране (рис. 25). Некоторые из трансмембранных белков пронизывают мембрану один раз (гликофорин) – битопические, другие имеют несколько участков (доменов), последовательно пересекающих бислой – политопические (рис. 26). Монотопические белки относятся к периферическим белкам (рис. 25).
Рассмотрим битопический белок – гликофорин из мембраны эритроцитов. В его аминокислотной последовательности был обнаружен короткий участок, состоящий из 23 неполярных аминокислот, расположенный примерно в середине цепи. Исследования показали, что молекула гликофорина полностью пронизывает мембрану, причем погруженный в мембрану гидрофобный участок имеет α-спиральную структуру.
Примером политопических белков являются транспортные АТФазы, бактериородопсин. Для бактериородопсина из мембраны Halobacterium halobium по данным рентгеноструктурного исследования фотосинтетических реакционных центров бактерий было показано, что его молекула содержит несколько α-спиральных участков, последовательно пересекающих бислой (рис. 27). Многие мембранные белки состоят из двух частей: из участков, богатых полярными аминокислотами, и участков, обогащенных неполярными аминокислотами. Эти белки упакованы в мембранный бислой так, что их неполярные участки контактируют с гидрофобными участками бислоя.
Анализ аминокислот некоторых мембранных белков показал, что они содержат примерно столько же полярных аминокислот, сколько и обычные водорастворимые белки, тем не менее в воде они растворяются очень плохо. Причина их гидрофобности кроется не в самом аминокислотном составе, а в порядке чередования аминокислотных остатков – гидрофобные аминокислотные радикалы не рассеяны вдоль по полипептидной цепи, а сконцентрированы в гидрофобные домены.
Некоторые мембранные белки увеличивают свою гидрофобность с помощью ковалентной связи с липидными компонентами мембран. Эти белки используют для более прочного контакта с бислоем миристиновую С 14:0 или пальмитиновую С 16:0 жирные кислоты или гликозилфосфатидилинозитол. Белки, связанные с жирными кислотами, локализованы, в основном, на цитоплазматической поверхности плазматической мембраны, а белки, связанные с гликозилфосфатидилинозитолом – на наружной.
В структуре многих мембранных белков, как правило, четко различаются участки, ответственные за их биологическую активность. Очень часто биологически активный участок состоит преимущественно из полярных аминокислот, тогда как не активные домены построены, главным образом, с участием аминокислот с неполярными радикалами. Поэтому вероятно, что полярная часть мембранного белка контактирует с цитоплазмой и с полярными головами липидов и обеспечивает функциональную активность белка, а неполярная часть связывается с углеводородными цепями липидных молекул и обеспечивает структурную устойчивость молекулы. Однако такое правило не является универсальным. Так, белки, превращающие гидрофобные субстраты (к ним относятся, например, гидроксилазы не растворимых в водной фазе ксенобиотиков) имеют гидрофобные карманы, концентрирующие молекулы субстрата для его ферментативной модификации. Таким образом, мы видим, что мембранные белки обычно связываются с мембраной с помощью нековалентных взаимодействий двух типов: – электростатических (на уровне полярных голов фосфолипидов) и гидрофобных (в толще бислоя).
Белки в бислое весьма лабильны и могут совершать различные виды движений, при этом подвижность белков в бислое и их ассоциация контролируется липидами (рис. 28, I). Некоторые мембранные белки перемещаются вдоль бислоя (рис. 28, II). Например, фосфолипаза А, связываясь цитоплазматической поверхностью мембраны, может латерально перемещаться по поверхности бислоя и гидролизовать несколько тысяч фосфолипидов до тех пор, пока не диссоциирует от мембраны. Латеральная диффузия интегральных белков в мембране ограничена их большими размерами, взаимодействием с другими мембранными белками, а также элементами цитоскелета или внеклеточного матрикса. Однако она также имеет вполне измеримую величину.
Вращательная подвижность белков (рис. 28, III) связана с их вращением вокруг оси, перпендикулярной поверхности бислоя. Периферические белки оказывают менее значительное воздействие на состояние и подвижность ацильных цепей фосфолипидов. Напротив, интегральные белки сильно ограничивают подвижность аннулярных липидов, которые их непосредственно окружают в мембране. По этой причине аннулярные липиды называют связанными (иммобилизованными). Они по своему поведению и подвижности отличаются от липидов суммарного липидного бислоя. Белковые молекулы ограничивают подвижность примыкающих к их поверхности липидов, и аннулярный слой оказывается более упорядоченным. Количество связанных липидов зависит от насыщенности мембраны белками.
БЕЛОК-ЛИПИДНЫЕ ВЗАИМОДЕЙСТВИЯ
Анализ белок-липидных взаимодействий в мембране позволяет выделить контакты 4 основных типов (рис. 29).
1 тип: наиболее часто распространен случай, когда внедряющийся в бислой белок вызывает локальное возрастание упорядоченности части липидной массы (создание аннулярного слоя). Так действуют бактериородопсин, грамицидин (пептидный ионофор, увеличивающий проницаемость мембран для ионов) и многие другие интегральные мембранные белки.
2 тип: периферические белки, не проникающие на всю глубину бислоя, вызывают эластическую деформацию одной его стороны. Такое влияние на физико-химические параметры бислоя характеризуется определенным дальнодействием. Именно им определяется облегчение взаимодействия мембранных рецепторов с инсулином и другими гормонами.
4 тип: сочетание гидрофильных и гидрофобных свойств белковой молекулы может обеспечить не только проникновение белка через бислой, но и существенное давление на него, приводящее к изменению геометрии бислоя – сжиманию одних частей и уширению других (например, в случае белка эритроцитарных мембран гликофорина).
Рис. 29. Вызванная белком модификация бислоя
ФУНКЦИИ МЕМБРАННЫХ БЕЛКОВ
Как правило, именно белки ответственны за функциональную активность мембран. К таким белкам относятся разнообразные ферменты, транспортные белки, рецепторы, каналы, белки, образующие поры (аквапорины), то есть разнообразные белковые структуры, которые обеспечивают уникальность функций каждой мембраны. Мембранные белки по биологической роли можно разделить на три группы:
I. Белки-ферменты наиболее распространены среди всех мембранных белков. В их число входят как интегральные (мембранные АТФазы), так и периферические (ацетилхолинэстераза, кислая и щелочная фосфатазы, РНКаза) белки. Ферменты – большие молекулы, в то время как размеры молекул веществ (субстратов), вступающих в ферментативные реакции, обычно в тысячи раз меньше. Фермент взаимодействует с субстратом небольшим участком своей поверхности – активным центром. Специфичность фермента всегда определяется тем, насколько поверхность его активного центра соответствует поверхности субстрата. Этот принцип структурного соответствия повсеместно используется и в работе белков клеточных мембран. В дополнение к этому надо учесть, что конформация внедряющихся в мембрану белков зависит от мембранного бислоя, так что и их ферментативная активность контролируется мембранными липидами. Этот контроль может реализоваться благодаря как влиянию на сродство к субстратам или на их доступность, так и воздействию на длительность жизни (прочность) белковых ассоциатов мембранных ферментов, образующихся в клеточной мембране.
Ферменты входят в состав как плазматических, так и внутриклеточных мембран. Например, на наружной мембране эпителиальных клеток, выстилающих пищеварительные органы, имеются ферменты, осуществляющие расщепление питательных веществ еще до того, как они попадут внутрь клетки (этот процесс, открытый отечественным физиологом А.М. Уголевым носит название «мембранное пищеварение»). Наружная мембрана клеток печени содержит более 20 различных ферментов.
Мембранные ферменты нуждаются в контакте с окружающими их липидами. Когда их извлекают из липидного окружения (например, когда липиды экстрагируются из мембраны неполярными растворителями), работа мембранных ферментов нарушается (меняются особенности кинетики или характера влияния посторонних веществ или же вовсе прекращается). Активность таких мембранных ферментов удается частично восстановить, если к ним добавить липидные мицеллы. Анализ природы липидов, активирующих мембранные ферменты, демонстрирует отсутствие строгой специфичности – определяющим является гидрофильно-липофильный коэффициент липидной смеси. В ряде случаев активировать делипидированный фермент удается даже детергентом. Однако такой реактивированный фермент теряет способность воспринимать регулирующие сигналы извне, которые управляли его работой в «живой» мембране.
Активирующее действие липидов на мембранные ферменты может быть, по меньшей мере, двояким. Во-первых, в присутствии липидов может меняться форма молекулы мембранного фермента, так что его активный центр становится доступным для субстрата. Во-вторых, липиды могут играть роль организатора ансамбля или конвейера, состоящего из многих ферментов. Молекулы мембранных ферментов содержат большие неполярные гидрофобные участки. Поэтому в водной среде они агрегируют, из-за чего большая часть активных центров маскируется. В присутствии липидов мембранные ферменты организуются в ансамбли, окруженные аннулярными липидными молекулами, и их ферментативная активность может проявиться в полной мере. Для нормальной работы мембранных ферментов существенно, чтобы окружающие их липиды находились в жидком агрегатном состоянии.
II. Рецепторными белками называют белки, специфически связывающие те или иные низкомолекулярные вещества. При связывании специфических лигандов рецепторные белки обратимо меняют свою форму. Эти изменения запускают внутри клетки ответные химические реакции. Таким способом клетка воспринимает различные сигналы, поступающие из внешней среды, и отвечает на них. Белки-рецепторы и белки, определяющие иммунную реакцию клетки, – антигены, также могут быть как интегральными, так и периферическими компонентами мембраны (рис. 25). Часто рецепторы входят в состав более сложных мембранных комплексов, содержащих белки-исполнители. Например, холинорецептор воспринимает сигнал от нейромедиатора и передает его на белок-каналообразователь. Эта реакция открывает проницаемость мембраны для ионов натрия и калия и формирует возбуждающий потенциал.
III. Структурные мембранные белки лишены явных ферментативных свойств, возможно потому, что в химическом отношении они мало изучены. Их исследование затрудняется главным образом двумя обстоятельствами. Во-первых, структурные белки как бы «немы», то есть, не обладают известной ферментативной активностью. Во-вторых, структурные белки имеют в составе своих молекул обширные гидрофобные участки. При очистке они легко образуют тесные ассоциаты друг с другом или с липидами, что затрудняет их характеристику.
Основные функции белков в клетке
Благодаря сложности, разнообразию форм и состава, белки играют важную роль в жизнедеятельности клетки и организма в целом.
Белок — это отдельный полипептид или агрегат нескольких полипептидов, выполняющий биологическую функцию.
Полипептид — понятие химическое. Белок — понятие биологическое.
В биологии функции белков можно разделить на следующие виды:
1. Строительная функция
Белки участвуют в образовании клеточных и внеклеточных структур. Например:
2. Транспортная функция
Некоторые белки способны присоединять различные вещества и переносить их к различным тканям и органам тела, из одного места клетки в другое. Например:
Белки транспортируют в крови катионы кальция, магния, железа, меди и другие ионы.
3. Регуляторная функция
Большая группа белков организма принимает участие в регуляции процессов обмена веществ. Гормоны белковой природы принимают участие в регуляции процессов обмена веществ. Например:
4. Защитная функция
5. Двигательная функция
6. Сигнальная функция
7. Запасающая функция
8. Энергетическая функция
9. Каталитическая (ферментативная) функция
Ферменты, или энзимы, — особый класс белков, являющихся биологическими катализаторами. Благодаря ферментам биохимические реакции протекают с огромной скоростью. Вещество, на которое оказывает свое действие фермент, называют субстратом.
Ферменты можно разделить на две группы:
10. Функция антифириза
11. Питательная (резервная) функция.
Решай задания и варианты по биологии с ответами
Организация и функции мембранных белков



Липидам в составе мембран отводят, в первую очередь, структурные свойства — они создают бислой, или матрикс, в котором размещаются активные компоненты мембраны — белки. Именно белки придают разнообразным мембранам уникальность и обеспечивают специфические свойства. Многочисленные мембранные белки выполняют следующие основные функции: обусловливают перенос веществ через мембраны (транспортные функции), осуществляют катализ, обеспечивают процессы фото- и окислительного фосфорилирования, репликацию ДНК, трансляцию и модификацию белков, рецепцию сигналов и передачу нервного импульса и др.
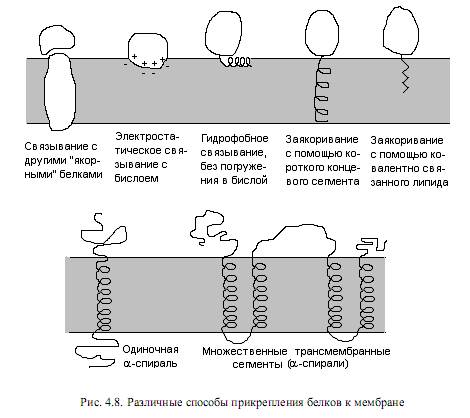
Принято делить мембранные белки на 2 группы: интегральные(внутренние) и периферические (наружные). Критерием такого разделения служит степень прочности связывания белка с мембраной и, соответственно, степень жесткости обработки, необходимой для извлечения белка из мембраны. Так, периферические белки могут высвобождаться в раствор уже при промывке мембран буферными смесями с низкой ионной силой, низкими значениями рН в присутствии хелатирующих веществ, например этилендиаминотетраацетата (ЭДТА), связывающих двухвалентные катионы. Периферические белки выделяются из мембран при таких мягких условиях, поскольку связаны с головками липидов или с другими белками мембраны при помощи слабых электростатических взаимодействий, либо с помощью гидро-фобных взаимодействий — с хвостами липидов. Наоборот, интегральные белки представляют собой амфифильные молекулы, имеют на своей поверхности большие гидрофобные участки и располагаются внутри мембраны, поэтому для их извлечения требуется разрушить бислой. Для этих целей наиболее часто используют детергенты или органические растворители. Способы прикрепления белков к мембране довольно разнообразны (рис. 4.8).
Транспортные белки. Липидный бислой является непроницаемым барьером для большинства водорастворимых молекул и ионов, и их перенос через биомембраны зависит от деятельности транспортных белков. Можно выделить два основных типа этих белков: каналы (поры) и переносчики. Каналы представляют собой туннели, пересекающие мембрану, в которых места связывания транспортируемых веществ доступны на обеих поверхностях мембраны одновременно. Каналы в процессе транспорта веществ не претерпевают каких-либо конформационных изменений, их конформация меняется лишь при открывании и закрывании. Переносчики, наоборот, в процессе переноса веществ через мембрану изменяют свою конформацию. Причем в каждый конкретный момент времени место связывания переносимого вещества в переносчике доступно только на одной поверхности мембраны.
открываются и закрываются в ответ на связывание специфических химических агентов. Например, никотиновый ацетилхолиновый рецептор при связывании с ним нейромедиатора переходит в открытую конформацию и пропускает одновалентные катионы (подрадел 4.7 данной главы). Термины «пора» и «канал» обычно взаимозаменяемы, но под порой чаще понимают неселективные структуры, различающие вещества главным образом по размеру и пропускающие все достаточно малые молекулы. Под каналами чаще понимают ионные каналы. Скорость транспорта через открытый канал достигает 10 6 — 10 8 ионов в секунду.
Ферментные функции мембранных белков. В клеточных мембранах функционирует большое количество разнообразных ферментов. Одни из них локализуются в мембране, находя там подходящую среду для превращения гидрофобных соединений, другие благодаря участию мембран располагаются в них в строгой очередности, катализируя последовательные стадии жизненно важных процессов, третьи нуждаются в содействии липидов для стабилизации своей конформации и поддержания активности. В биомембранах обнаружены ферменты — представители всех известных классов. Они могут пронизывать мембрану насквозь, присутствовать в ней в растворенной форме или, являясь периферическими белками, связываться с мембранными поверхностями в ответ на какой-либо сигнал. Можно выделить следующие характерные типы мембранных ферментов:
1) трансмембранные ферменты, катализирующие сопряженные реакции на противоположных сторонах мембраны. Эти ферменты имеют, как правило, несколько активных центров, размещающихся на противоположных сторонах мембраны. Типичными представителями таких ферментов являются компоненты дыхательной цепи или фотосинтетические редокс-центры, катализирующие окислительно-восстановительные процессы, связанные с транспортом электронов и созданием ионных градиентов на мембране;
2) трансмембранные ферменты, участвующие в транспорте веществ. Транспортные белки, сопрягающие перенос вещества с гидролизом АТР, например, обладают каталитической функцией;
3) ферменты, катализирующие превращение связанных с мембраной субстратов. Эти ферменты участвуют в метаболизме мембранных компонентов: фосфолипидов, гликолипидов, стероидов и др.
4) ферменты, участвующие в превращениях водорастворимых субстратов. С помощью мембран, чаще всего в прикрепленном к ним состоянии, ферменты могут концентрироваться в тех областях мембран, где содержание их субстратов наибольшее. Например, ферменты, гидролизующие белки и крахмал, прикрепляются к мембранам микроворсинок кишечника, что способствует увеличению скорости расщепления этих субстратов.
Белки цитоскелета. Цитоскелет представляет собой сложную сеть белковых волокон разного типа и присутствует только в эукариотических клетках. Цитоскелет обеспечивает механическую опору для плазматической мембраны, может определять форму клетки, а также местоположение органелл и их перемещение при митозе. С участием цитоскелета осуществляются также такие важные для клетки процессы, как эндо- и экзоцитоз, фагоцитоз, амебоидное движение. Таким образом, цитоскелет является динамическим каркасом клетки и определяет ее механику.
Цитоскелет формируется из волокон трех типов:
1) микрофиламенты(диаметр
6 нм). Представляют собой нитевидные органеллы — полимеры глобулярного белка актина и других связанных с ним белков;
2) промежуточные филаменты (диаметр 8— 10 нм). Сформированы кератинами и родственными им белками;
3) микротрубочки (диаметр
23 нм) — длинные трубчатые структуры.
Состоят из глобулярного белка тубулина, субъединицы которого формируют полый цилиндр. Длина микротрубочек может достигать нескольких микрометров в цитоплазме клеток и нескольких миллиметров в аксонах нервов.
Перечисленные структуры цитоскелета пронизывают клетку в разных направлениях и тесно связываются с мембраной, прикрепляясь к ней в некоторых точках. Эти участки мембраны играют важную роль в межклеточных контактах, с их помощью клетки могут прикрепляться к субстрату. Они же играют важную роль в трансмембранном распределении липидов и белков в мембранах.