какую форму имеет нитрат ион
Нитрат-ионы
Синонимы: селитры, азот нитратов, нитратный азот, нитрат-ион.
Азот нитратов или нитратный азот не является полным синонимом нитрат-иона. Дело в том, что в случае нитратного азота концентрация пересчитывается именно на азот. Нитраты в составе имеют один атом азота и три атома кислорода, поэтому массовая концентрация нитрат-ионов не совпадает с массовой концентрацией нитратного азота. Для пересчёта используются следующие формулы:
Концентрация нитратного азота = 0,225 ⋅ Концентрация нитрат-иона
Концентрация нитрат-иона = 4,428 ⋅ Концентрация нитратного азота
Описание: анионы сильной минеральной азотной кислоты. В сочетании с катионом (натрием, калием, кальцием, магнием и т.д.) образуют соли (нитраты натрия, нитраты калия, нитраты кальция, нитраты магния и т.д.). Нитраты практически всех катионов отлично растворяются в воде — это обуславливает их способность перемещаться с грунтовыми водами и загрязнять открытые источники водоснабжения, такие как колодцы, родники и открытые водохранилища на расстояниях до нескольких десятков километров.
Методы определения: потенциометрия, ионная хроматография, и спектрофотометрия.
Методики, используемые в Испытательном центре МГУ для определения концентрации нитрат-иона в природных средах
| Нормативный документ на методику | Метод определения | Оборудование |
|---|---|---|
| Вода | ||
| ПНД Ф 14.1:2:4.132 | ионная хроматография | DIONEX ICS-2000 |
| Почва | ||
| ПНД Ф 16.1.8-98 | ионная хроматография | DIONEX ICS-2000 |
| ГОСТ 26488-85 | спектрофотометрия | Hach Lange DR 2800 |
Контроль измерений проводят на оборудовании: UNICO 2100.
Распространённость: нитраты являются одними из основных соединений азота, который, будучи биогенным элементом, широко распространён в биосфере. Нитраты — это промежуточная стадия трансформации азота, поэтому данные соединения присутствуют во всех природных водах, попадая туда в процессе окисления и трансформации органического вещества. Повышенное содержание нитратов в воде сопряжено с активным применением этой формы азота в качестве минерального удобрения при выращивании практически всех агрономически ценных культур (овощи, зерновые, лен, хлопок и так далее).
Нормирование
Несмотря на то, что азот сам по себе важен и необходим для любого живого организма, нитратная его форма не играет положительной роли в организме человека. Поэтому в вашей питьевой воде по возможности нитратов быть не должно.
Нитраты не играют положительной биологической роли в организме человека.
Повышенное содержание нитратов в воде говорит о смещении баланса цикла азота и о возможном развитии процессов эвтрофикации водоёма. Также рост концентрации нитратов служит индикатором снижения содержания в воде растворённого кислорода — это особенно актуально для владельцев аквариумов. Поливная вода, в свою очередь, может (а в некоторых случаях даже должна) содержать в себе нитратный азот для обеспечения роста и развития растений.
Предельно допустимая концентрация (ПДК) нитрат-иона в различных водных объектах
| Нормирование | ПДК, мг/л |
|---|---|
| Бутилированная вода первой категории СанПиН 2.1.4.1116-02 | 0–20 |
| Бутилированная вода высшей категории СанПиН 2.1.4.1116-02 | 0–5 |
| Вода систем централизованного водоснабжения СанПиН 2.1.4.1074-01 | 0–45 |
| Водные объекты рыбохозяйственного значения Приказ Минсельхоза РФ № 552 | 0–40 |
| Объекты рекреационного водопользования СанПиН 2.1.5.980-00 | — |
| Вода плавательных бассейнов СанПиН 2.1.2.1188-03 | — |
| Хозяйственно-бытовые стоки Постановление Правительства РФ № 644 | — |
| Ливневые стоки Постановление Правительства РФ № 644 | — |
Польза и вред
Опасность для организма представляют не сами нитраты, а продукты их трансформации: нитриты и нитрозамины. Нитратный азот в пищеварительном тракте и полости рта трансформируется в нитритный под действием фермента нитратредуктазы. В присутствии, например, мяса, активно образуются нитрозамины. Образование продуктов уменьшается при попадании нитратов в организм совместно с веществами, обладающими антиоксидантными свойствами — например, с витамином С.
Положительна роль нитратов (спорно)
Через нитриты и при поступлении отдельно от мясной пищи: они окисляются до оксида азота, который поступает в кровь, приводит к расширению сосудов и нормализации кровяного давления.
Отрицательная роль нитратов
При метаболизме до нитритов:
При метаболизме до нитрозаминов:
Методы очистки воды
Ионный обмен. В результате использования ионообменных смол (специфических анионитов) в воде происходит замена нитратов на хлориды. Поскольку нитраты не имеют положительной роли их можно убирать из воды полностью. Этот метод мало распространён, т.е. применяется редко, поскольку аниониты распространены меньше, чем катиониты (смолы для фильтрации катионов).
Обратный осмос. Вместе с другими веществами обратный осмос убирает из воды нитраты. Этот метод используется чаще остальных для очистки воды от нитратов. При использовании реминерализатора убедитесь, что соли в нем не содержат нитраты.
Нитраты относится к веществам, которые характеризуются отрицательным влиянием на организм человека, поэтому необходимо контролировать содержание нитратов в питьевой воде. В связи с особенностями метаболизма, наибольшую опасность нитраты представляют для грудных детей и пожилых людей.
НИТРАТЫ НЕОРГАНИЧЕСКИЕ
Безводные нитраты-кристаллич. соед., нитраты d-элементов окрашены. Условно нитраты могут быть разделены на соед. с преим. ковалентным типом связи (соли Be, Cr, Zn, Fe и др. переходных металлов) и с преим. ионным типом связи (соли щелочных и щел.-зем. металлов). Для ионных нитратов характерны более высокая термич. устойчивость, преобладание кристаллич. структур более высокой симметрии (кубич.) и отсутствие расщепления полос нитрат-иона в ИК спектрах. Ковалентные нитраты имеют более высокую р-римость в орг. р-рителях, более низкую термич. устойчивость, их ИК спектры носят более сложный характер; нек-рые ко-валентные нитраты летучи при комнатной т-ре, а при растворении в воде частично разлагаются с выделением оксидов азота.
Нитраты Na, К (натриевая и калиевая селитры) встречаются в виде прир. залежей.
Анализ нитратов на нитрат-ион основан на его восстановлении до NH 3 сплавом Деварда и поглощении NH 3 титрованным р-ром к-ты либо на осаждении в виде нитроннитрата с помощью нитрона.
Н итраты применяют во мн. отраслях пром-сти. Аммония нитрат (аммиачная селитра)-осн. азотсодержащее удобрение; в качестве удобрений используют также нитраты щелочных металлов и Са. Нитраты-компоненты ракетных топлив. пиротехн. составов, травильных р-ров при крашении тканей; их используют для закалки металлов, консервации пищевых продуктов, как лекарственные средства и для получения оксидов металлов. См. также Калия нитрат, Натрия нитрат и др.
Лит.: Addison С. С., Logan N.. Anhydrous metal nitrates, «Advances Inorganic Chemistry and Radiochemistry», 1964, v. 6, p. 72-142. П.М. Чукуров.



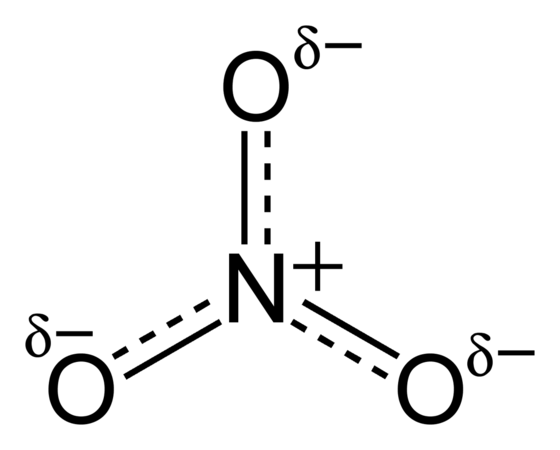
Нитрат-ион – это полиатомный ион с молекулярной формулой NO3 − и молекулярной массой 62.0049 г/моль.
Структура нитрата
Такую структуру часто используют как пример резонанса. Также как изоэлектронный карбонат-ион, нитрат-ион можно изобразить в виде резонансных структур.
Свойства нитратов
Почти все неорганические нитратные соли растворяются в воде при нормальных условиях, типичным примером неорганической нитратной соли является нитрат калия (калиевая селитра).
В органической химии, нитраты (не путать с нитросоединениями и нитритами) – это довольно редкая функциональная группа с химической формулой RONO2, где R обозначает любые органические остатки. Это эфиры азотной кислоты и спирты, которые реагируют с нитроксилами. Примерами являются метилнитраты, которые образуются при реакции метанола с азотной кислотой, нитраты винной кислоты, а также нитроглицерин (название ошибочное, так как это соединение органического нитрата, а не нитросоединение).
Распространение
В природных условиях нитраты можно найти в крупных залежах, в частности в залежах чилийской селитры, огромном источнике нитрата натрия.
Нитриты продуцируются отдельными видами клубеньковых бактерий, а нитратные соединения, необходимые для изготовления пороха, при отсутствии источников неорганического азота, получали путем брожения, используя мочу и навоз.
Применение нитратов
Нитраты используют в основном как удобрения в сельском хозяйстве, так как они высоко растворимы и способны разлагаться биологическим путем. Основными нитратами являются соли аммония, натрия, калия и кальция. С этой целью ежегодно производят 700 тыс. тонн нитратов.
Еще одно применение нитратов в качестве окислителей, особенно при изготовлении взрывных веществ, заключается в быстром окислении углеродных соединений, которые освобождают большой объем тепловой энергии. Для того чтобы убрать пузырьки воздуха с расплавленного стекла или керамики используют нитрат натрия. Смесь солевых расплавов укрепляет некоторые металлы.
Измерение
Свободные нитрат-ионы в растворах можно определить с помощью ионоселективных электродов нитрат-ионов. Такие же электроды используют для измерения pH, частично такие реакции описывает уравнение Нернста.
Токсичность нитратов
Нитратная интоксикация возникает при кишечно-печеночном метаболизме, когда нитраты превращаются в нитриты, которые играют роль запускного механизма. Нитриты окисляют атомы железа в гемоглобине от двухвалентного (2+) к трехвалентному (3+), что отнимает у него возможность транспортировать кислород к клеткам. Этот процесс может привести к общей нехватке кислорода в ткани органов и опасным последствиям, таким как метгемоглобинемия. Не смотря на то, что в животных нитриты превращаются в аммиак, если поглощать большое количество нитритов, со временем они погибают от нехватки кислорода.
Влияние нитратов на здоровье человека
Человек также является объектом токсичности нитратов. У младенцев особенно высокий риск возникновения метгемоглобинемии, так как метаболизм нитратов увеличивает концентрацию триглицеридов намного выше, чем на других стадиях развития. Новорожденных с метгемоглобинемией еще называют “синюшным ребенком”. Несмотря на то, что еще недавно нитраты в питьевой воде считались способствующим фактором заболевания, современные научные исследования вызывают значительные сомнения в том, существует ли причинная связь. Синдром “голубого ребенка” сейчас рассматривают как результат нескольких факторов, которые могут вызывать расстройства желудка, например диарею, непереносимость пищевого белка, отравление тяжелыми металлами и т.д., где нитраты практически не играют роли. Как один из факторов токсикоза, чаще всего ребенок может поглощать нитраты с питьевой водой, в которой уровень нитратов повышен. Однако воздействие нитратов также проявляется при потреблении пищи с высокой концентрацией нитратов, например овощей. Латук может иметь повышенное содержание нитратов в некоторых условиях роста, например при уменьшенном освещении, нехватке необходимых микроудобрений, содержащих молибден (Mo) и железо (Fe) или в связи с пониженной ассимиляцией растения. Высокий уровень нитратов в удобрениях также увеличивает их высокую концентрацию в урожае.
Некоторые люди могут быть более восприимчивыми к влиянию нитратов, чем другие. Дефицит ферментов метгемоглобинредуктазы можно наблюдать у некоторых людей как результат неких врожденных мутаций. У этих людей процесс восстановления метгемоглобина происходит не так быстро, как в людей с нормальной выработкой ферментов, что приводит к повышенному уровню циркуляции метгемоглобина (то есть кровь не насыщается кислородом). Люди с пониженной кислотностью желудка (в том числе некоторые вегетарианцы и последователи строгого вегетарианства) также находятся в группе риска. Потребление зеленолистных овощей в большом количестве, что предусматривает вегетарианская диета, может повысить концентрацию нитратов в организме. Различные заболевания, включая пищевую аллергию, астму, гепатит или камни в желчном пузыре могут быть связаны с пониженной кислотностью желудка, по этому люди с такими заболеваниями тоже подвергаются риску.
Метгемоглобинемия лечится метиленовой синькой, которая превращает трехвалентное железо (3+) в двухвалентное (2+) в пораженных клетках крови.
В пресных водах или эстуарийных системах ближе к берегу, уровень загрязнения нитратами может увеличиваться и вызывать гибель рыбы. Не смотря на то, что нитраты менее токсичны, чем аммиак, превышение концентрации нитратов более чем 30 мг/м3 может препятствовать развитию, ослаблять иммунную систему и вызывать стресс в некоторых водных организмов. Тем не менее, учитывая проблематику принятого Протокола по исследованиям актуального загрязнения нитратами, вопрос о степени загрязнения нитратами остался главной темой недавних дискуссий.
В большинстве случаев повышения концентрации нитратов среди водной экосистемы, первоисточником загрязнения являются дренажные системы сельскохозяйственных или озелененных территорий, которые получают повышенную дозу нитратных удобрений. Этот процесс называется эвтрофикацией и приводит к развитию водорослей. Такой бурный рост водорослей ведет не только к уменьшенному содержанию кислорода и образованию мертвых зон в океане, но и к другим изменениям экосистемы, превышая популяцию отдельных видов над другими. Поскольку нитраты являются частью общей минерализации, этот показатель редко используют для определения качества воды.
Образование нитратов также может стать побочным эффектом септических систем. Если точнее, нитраты появляются природным путем в результате распада или разложения человеческих или животных отходов. Качество воды также зависит от запасов подземных вод с большим количеством септических систем в районе водораздела. Септики вымывают сток в подземные воды или водоносные коллекторы и снабжают водой соседние объекты. Поэтому озера, которые питают подводные источники, подвергаются процессу нитрификации.
Если уровень нитратов в питьевой воде превышает установленную норму, это представляет серьезную угрозу для маленьких детей. Чрезмерное количество нитратов может спровоцировать синдром “голубого ребенка” и если заболевание не лечить, последствия могут быть фатальными. Кипячение воды, загрязненной нитратами еще больше увеличивает их концентрацию и риск заболевания.
Отравление скота нитратами
Беспокоиться по поводу отравления нитратами в первую очередь нужно фермерам, которые занимаются рогатым скотом, а также жвачными животными. Нитраты являются естественными компонентами любого растения в процессе роста, но когда что-то мешает его развитию, корни растения будут продолжать впитывать в себя нитраты с грунтов, и если не возобновить рост – накопление нитратов в растении неизбежно. Таким образом, если растения аккумулируют в себе нитраты при особых обстоятельствах, во время урожая мы получаем продукты с повышенным содержанием нитратов. К факторам, которые провоцируют накопление нитратов в растениях, относят мороз, град, засуха, суховеи, пестициды, гербициды и другие окружающие условия, которые могут замедлять рост растения.
Симптомы отравления нитратами включают учащенное сердцебиение и дыхание, в некоторых случаях кожа может стать синего или коричневого цвета. Корм проверяют на нитраты и проводят лечение, которое заключается в потреблении дополнительного или заменяющего корма с пониженной концентрацией нитратов. Безопасный уровень нитратов для скота:
Нитраты
Соли азотной кислоты называют нитратами, которые в основном используются в качестве удобрений в сельском хозяйстве и как окислители, например при производстве фейерверков или в химическом синтезе.
Соли азотной кислоты являются ионными соединениями, состоящие из положительно заряженных ионов металлов.
Нитраты образуются при взаимодействии металлов, оксидов, карбонатов или гидроксидов металлов с разбавленной азотной кислотой.
Свойства и использование нитратов
Нитраты в основном представляют собой бесцветные кристаллические твердые вещества, которые разлагаются под воздействием термической нагрузки. Нитраты щелочных металлов образуют нитриты и кислород, а нитраты тяжелых металлов превращаются в оксиды.
Как в случае нитрата аммония, термическое разложение может происходить со взрывом. Термическое разложение нитратов играет решающую роль в воспламенении фейерверков.
Нитраты часто являются хорошими окислителями. В отличие от расплавов, водные растворы не обладают окислительным действием.
Удобрения, содержащие нитраты, используются для покрытия азотного дефицита растений. Чтобы предотвратить слишком быстрое вымывание растворимых нитратов из почвы, они используются в соответствующих комбинированных удобрениях, которые выделяют ионы нитрата очень медленно.
Важным сырьем для этих удобрений является нитрат натрия, нитрат калия, нитрат кальция и аммиачная селитра.
Обнаружение нитрат-иона
Нитраты не могут быть обнаружены реакциями осаждения. По этой причине были разработаны тест-полоски, которые вызывают характерные цветовые реакции с нитрат-ионами. Другой простой способ обнаружения нитрат-ионов — это так называемый кольцевой тест.
Раствор, который нужно проверить, смешивают с несколькими каплями раствора сульфата железа (II). Раствор покрывают концентрированной серной кислотой (осторожно!). Серная кислота имеет более высокую плотность, чем водный раствор, и оседает на дне пробирки. На границе раздела образуется кольцо коричневого цвета.
Нахождение в природе и применение
Нитрат калия встречается в природе редко и должен производиться из нитрата натрия. Он также является важным компонентом черного порошка, смеси 10% мелкоизмельченной серы, 15% молотого древесного угля и 75% нитрата калия. Он использовался с XII века в Китае и с XIV века в Европе в качестве взрывчатого вещества и метательного вещества в пушках и мушкетах.
Приблизительно 2300 литров газообразных продуктов реакции образуются из одного килограмма черного пороха.
Нитрат калия используется в салютах для осветительных приборов и как компонент холодных смесей.
Другой важный нитрат — это нитрат серебра, который можно получить путем реакции концентрированной азотной кислоты с серебром. Полученный таким образом нитрат серебра используется для гальванического серебряного покрытия. Он также используется для удаления новообразований и в качестве важного реагента в аналитической химии, например для обнаружения галогенид-ионов (хлорид, бромид, йодид).
Реакция обнаружения основана на том, что раствор нитрата серебра добавляют по каплям к кислому раствору пробы. В присутствии упомянутых галогенидов образуется галогенид серебра, который плохо растворяется в воде и выпадает в виде осадка. Хлорид серебра белый, бромид серебра слегка желтый, а йодид серебра интенсивно желтый.
Большая Энциклопедия Нефти и Газа
Нитрат-ион
Нитрат-ион образует с антипирином в кислой среде нитроантипирин ярко-крас ного цвета ( см. также гл. [2]
Нитрат-ион ведет себя, как если бы его радиус был значительно меньше. Перхлорат-ион ведет себя так, как это можно ожидать: у него склонность к комплексообразованию выражена очень слабо. [3]
Нитрат-ион как лиганд в комплексах двухвалентной меди. [4]
Нитрат-ион в кислом растворе окисляет а-нафтиламин, превращаясь при этом в нитрит-ион, который может быть открыт обычной реакцией с а-нафтиламином и сульфаниловой кислотой. [6]
Нитрат-ион восстанавливается с большим трудом и только при высоких значениях потенциалов. [7]
Нитрат-ион ведет себя, как если бы его радиус был значительно меньше. Перхлорат-ион ведет себя так, как это можно ожидать: у него склонность к комплексообразованию выражена очень слабо. Различие в поведении NOs и С1О4 вытекает из различий в их структуре. [8]
Нитрат-ион является анионом азотной кислоты. Для азотной кислоты характерны окислительные свойства, причем степень восстановления зависит как от ее концентрации, так и от активности восстановителя. Концентрированная азотная кислота проявляет более сильные окислительные свойства, чем разбавленная. [9]
Нитрат-ион можно обнаружить в присутствии ряда других анионов реакций восстановления его до NH3 при действии алюминиевых стружек в щелочной среде. [10]
Нитрат-ион имеет четыре основные частоты колебаний, причем все они при определенных условиях могут наблюдаться в инфракрасном спектре. Однако только двум из них соответствуют достаточно интенсивные полосы поглощения, которыми можно пользоваться в целях идентификации соединений. [12]
Нитрат-ион имеет четыре основные полосы поглощения, причем все они при определенных условиях могут наблюдаться в инфракрасном спектре. [13]
Нитрат-ион NO3 и нитрит-ион NO бесцветны. Этим ионам соответствуют азотная HNO3 и азотистая HNO2 кислоты. Азотная кислота в чистом виде представляет собой бесцветную жидкость с уд. В связи с этим продажная безводная азотная кислота почти всегда бывает окрашена в желтоватый, а иногда в красно-бурый цвет; она дымит на воздухе и обладает характерным запахом. Азотную кислоту, содержащую в растворе значительное количество двуокиси азота, называют дымящей азотной кислотой. [15]