Как называются катализаторы белковой природы
Катализаторы биологические
Смотреть что такое «Катализаторы биологические» в других словарях:
КАТАЛИЗАТОРЫ — вещества, ускоряющие химические реакции. Вещества, замедляющие реакции, называются ингибиторами. Биологические катализаторы называются ферментами. Катализаторами служат синтетические алюмосиликаты, металлы платиновой группы, серебро, никель и др … Большой Энциклопедический словарь
Катализаторы — вещества, ускоряющие химические реакции (ср.: ингибиторы замедлители реакций). Биологические К. называются ферментами. Наиболее распространенными К. являются: синтетические алюмосиликаты, металлы платиновой группы, серебро, никель и др … Российская энциклопедия по охране труда
катализаторы — вещества, ускоряющие химические реакции. Вещества, замедляющие реакции, называются ингибиторами. Биологические катализаторы называются ферментами. Катализаторами служат синтетические алюмосиликаты, металлы платиновой группы, серебро, никель и др … Энциклопедический словарь
Катализаторы — (см. Катализ) вещества, как правило, ускоряющие (в противоположность ингибиторам) скорость химических реакций. Катализаторы не смещают равновесие, а изменяют скорости прямой и обратной реакций, способствуют скорейшему достижению равновесия.… … Начала современного естествознания
ПОЛИМЕРЫ БИОЛОГИЧЕСКИЕ — (биополимеры) природные макромолекулы, играющие осн. роль в биол. процессах. К П. б. относятся белки, нуклеиновые кислоты (НК) и полисахариды. П. б. образуют структурную основу всех живых организмов; все процессы в клетке связаны с… … Физическая энциклопедия
Катализатор — (Catalyst) Определение катализатора, механизм действия катализатора Определение катализатора, механизм действия катализатора, применение катализатора Содержание Содержание 1. в химии Виды катализаторов Механизм действия катализаторов Требования,… … Энциклопедия инвестора
КАТАЛИЗ — ускорение химических реакций под действием малых количеств веществ (катализаторов), которые сами в ходе реакции не изменяются. Каталитические процессы играют огромную роль в нашей жизни. Биологические катализаторы, называемые ферментами,… … Энциклопедия Кольера
Катализ — (от греч. katálysis разрушение) изменение скорости химических реакций в присутствии веществ (катализаторов (См. Катализаторы)), вступающих в промежуточное химическое взаимодействие с реагирующими веществами, но восстанавливающих после… … Большая советская энциклопедия
фермент — Термин фермент Термин на английском enzyme Синонимы Аббревиатуры Связанные термины активный центр катализатора, белки, биологические моторы, биологические нанообъекты, биосенсор, генная инженерия, иммобилизация, кинезин, клетка, лаборатория на… … Энциклопедический словарь нанотехнологий
Биотехнологии — Биотехнология интеграция естественных и инженерных наук, позволяющая наиболее полно реализовать возможности живых организмов или их производные для создания и модификации продуктов или процессов различного назначения. Чаще всего применяется в… … Википедия
Характеристики биологического катализатора и примеры
катализ
Химические реакции включают энергию: исходные молекулы, участвующие в реакции, или реагенты начинаются с определенной степени энергии. Дополнительное количество энергии поглощается для достижения «переходного состояния». Впоследствии энергия высвобождается с продуктами.
Разница энергий между реагентами и продуктами выражается как ΔG. Если уровни энергии продуктов выше, чем у реагентов, реакция является эндергонической, а не спонтанной. Напротив, если энергия продуктов ниже, реакция является экзергонной и спонтанной.
Однако, если реакция является спонтанной, это не значит, что она будет происходить с заметной скоростью. Скорость реакции зависит от ΔG * (звездочка обозначает энергию активации).
Читатель должен помнить об этих понятиях, чтобы понять, как происходит функционирование ферментов..
ферменты
Что такое фермент?
Характеристики ферментов
Ферменты существуют в нескольких формах. Некоторые состоят исключительно из белков, в то время как другие имеют небелковые области, называемые кофакторами (металлы, ионы, органические молекулы и т. Д.).
Таким образом, апофермент представляет собой фермент без его кофактора, и комбинация апофермента и его кофактора называется голоферментом..
Это молекулы значительно большего размера. Однако только небольшой сайт фермента непосредственно участвует в реакции с субстратом, и этот регион является активным сайтом.
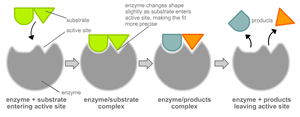
Когда реакция начинается, фермент связывается со своим субстратом, поскольку ключ связан со своим замком (эта модель является упрощением реального биологического процесса, но служит для иллюстрации процесса).
Все химические реакции, которые происходят в нашем организме, катализируются ферментами. На самом деле, если бы этих молекул не существовало, нам пришлось бы ждать сотни или тысячи лет, чтобы реакции завершились. Следовательно, регуляция ферментативной активности должна контролироваться очень специфическим образом..
Номенклатура и классификация ферментов
Существует шесть основных типов ферментов: оксидоредуктазы, трансферазы, гидролазы, лиазы, изомеразы и лигазы; отвечает за: окислительно-восстановительные реакции, перенос атомов, гидролиз, присоединение двойных связей, изомеризацию и связывание молекул соответственно.
Как работают ферменты?
Разница между продуктами и реагентами остается одинаковой (фермент на нее не влияет), так же как и распределение. Фермент облегчает формирование переходного состояния.
Ферментные ингибиторы
Обычно процесс ингибирования является обратимым, хотя некоторые ингибиторы могут оставаться связанными с ферментом почти постоянно.
примеров
В наших клетках и в клетках всех живых существ содержится большое количество ферментов. Однако наиболее известны те, которые участвуют в метаболических путях, таких как гликолиз, цикл Кребса, цепь переноса электронов и другие..
Сукцинатдегидрогеназа является ферментом типа оксидоредуктазы, который катализирует окисление сукцината. В этом случае реакция включает потерю двух атомов водорода..
Разница между биологическими катализаторами (ферментами) и химическими катализаторами
Есть катализаторы химической природы, которые, подобно биологическим, увеличивают скорость реакций. Однако есть заметные различия между молекулами обоих типов..
Ферментативные реакции происходят быстрее
Большинство ферментов работают в физиологических условиях
Поскольку биологические реакции проводятся внутри живых существ, их оптимальные условия окружают физиологические значения температуры и pH. Химикам, с другой стороны, нужны резкие условия температуры, давления и кислотности.
специфичность
Ферменты очень специфичны в реакциях, которые они катализируют. В большинстве случаев они работают только с одним субстратом или с несколькими. Специфика также относится к типу продукции, которую они производят. Ассортимент субстратов химических катализаторов значительно шире.
Силы, которые определяют специфичность взаимодействия между ферментом и его субстратом, являются такими же, которые определяют конформацию одного и того же белка (взаимодействия Ван-дер-Ваальса, электростатические, водородные и гидрофобные связи).
Ферментативная регуляция является точной
Наконец, ферменты обладают большей способностью регуляции, и их активность варьируется в зависимости от концентрации различных веществ в клетке..
Среди регуляторных механизмов мы находим аллостерический контроль, ковалентную модификацию ферментов и изменение количества синтезируемого фермента..
Ферменты – биологические катализаторы.
«Управление общеобразовательной организацией:
новые тенденции и современные технологии»
Свидетельство и скидка на обучение каждому участнику
Глава 1. Что такое ферменты?
1.1. Ферменты – биологические катализаторы…….…………………….2-3
1.2. Типы ферментов……………………………………………………..…3
1.3. Структура ферментов………………………………………………..…3
1.4. Специфичность ферментов и условия их активности. ………….… 4
Глава 2. Значение ферментов в живых организмах.
2.1. Роль ферментов в организме ……………………………………. 4-5
Глава 3. Исследовательская работа.
3.1. Химические результаты исследования ………………………. 5-6
3.2. Механизм работы ферментов…………. ………………………………6
3.3. Исследовательский опрос…………………………………………. 6-7
Глава 4. Заключение.
Актуальность: Известно, ферменты играют важнейшую роль в регуляции химических превращений обмена веществ. Ферменты обнаружены у всех живых существ, начиная от самых примитивных микроорганизмов. Получено около 600 ферментов. Ферменты способны управлять сложнейшими процессами разрушения и сотворения новых веществ в организме. В настоящее время знания о работе ферментов человек поставил себе на службу в медицине, промышленности, сельском хозяйстве и других сферах жизни.
Цель проекта: Провести исследование по обнаружению ферментов в живых организмах, рассмотреть их значение.
Что такое ферменты?
Ферменты – это биологические катализаторы белковой природы, ускоряющие химические реакции в живых организмах и вне их.
Ферменты присутствуют во всех живых клетках и способствуют превращению одних веществ (субстратов) в другие (продукты). Ферменты выступают в роли катализаторов практически во всех биохимических реакциях, протекающих в живых организмах. К 2013 году было описано более 5000 разных ферментов. Они играют важнейшую роль во всех процессах жизнедеятельности, направляя и регулируя обмен веществ организма.
Подобно всем катализаторам, ферменты ускоряют как прямую, так и обратную реакцию, понижая энергию активации процесса. Химическое равновесие при этом не смещается ни в прямую, ни в обратную сторону. Каждая молекула фермента способна выполнять от нескольких тысяч до нескольких миллионов «операций» в секунду.
При этом эффективность ферментов значительно выше эффективности небелковых катализаторов — ферменты ускоряют реакцию в миллионы и миллиарды раз, небелковые катализаторы — в сотни и тысячи раз.
Фермент амилаза необходим для переработки углеводов. Под воздействием амилазы углеводы разрушаются и легко всасываются в кровь. Амилаза присутствует как в слюне, так и в кишечнике. Амилаза тоже бывает разной. Для каждого вида сахаров существует собственный вид этого фермента.
Липаза – это ферменты, которые присутствуют в желудочном соке и вырабатываются поджелудочной железой. Липаза необходима для усвоения организмом жиров.
Протеаза – это группа ферментов, которые присутствуют в желудочном соке и тоже вырабатываются поджелудочной железой. Кроме этого, протеаза присутствует и в кишечнике. Протеаза необходима для расщепления белков.
Активность ферментов определяется их трёхмерной структурой.
Как и все белки, ферменты синтезируются в виде линейной цепочки аминокислот, которая сворачивается определённым образом. Каждая последовательность аминокислот сворачивается особым образом, и получающаяся молекула (белковая глобула) обладает уникальными свойствами. Несколько белковых цепей могут объединяться в белковый комплекс. Третичная структура белков разрушается при нагревании или воздействии некоторых химических веществ.
Ферменты обычно проявляют высокую специфичность по отношению к своим субстратам (субстратная специфичность). Это достигается частичной комплементарностью формы, распределения зарядов и гидрофобных областей на молекуле субстрата и в центре связывания субстрата на ферменте. Ферменты обычно демонстрируют также высокий уровень стереоспецифичности (образуют в качестве продукта только один из возможных стереоизомеров или используют в качестве субстрата только один стереоизомер), региоселективности (образуют или разрывают химическую связь только в одном из возможных положений субстрата) и хемоселективности (катализируют только одну химическую реакцию из нескольких возможных для данных условий). Несмотря на общий высокий уровень специфичности, степень субстратной и реакционной специфичности ферментов может быть различной. Например, эндопептидаза трипсин разрывает пептидную связь только после аргинина или лизина, если за ними не следует пролин, а пепсин гораздо менее специфичен и может разрывать пептидную связь, следующую за многими аминокислотами.
Влияние условий среды на активность ферментов
Активность ферментов зависит от условий в клетке или организме — давления, кислотности среды, температуры, концентрации растворённых солей (ионной силы раствора) и др.
Роль ферментов в организме
Ферменты участвуют в осуществлении всех процессов обмена веществ, в реализации генетической информации. Переваривание и усвоение пищевых веществ, синтез и распад белков, нуклеиновых кислот, жиров, углеводов и других соединений в клетках и тканях всех организмов — все эти процессы невозможны без участия ферментов. Любое проявление функций живого организма — дыхание, мышечное сокращение, нервно-психическая деятельность, размножение и др. — обеспечивается действием ферментов. Индивидуальные особенности клеток, выполняющих определенные функции, в значительной мере определяются уникальным набором ферментов, производство которых генетически запрограммировано. Отсутствие даже одного фермента или какой-нибудь его дефект могут привести к серьезным отрицательным последствиям для организма.
Местонахождение ферментов в организме
В клетке часть ферментов находится в цитоплазме, но в основном ферменты связаны с определенными клеточными структурами, где и проявляют свое действие. В ядре, например, находятся ферменты, ответственные за репликацию — синтез ДНК(ДНК-полимеразы), за ее транскрипцию — образование РНК (РНК-полимеразы). В митохондриях присутствуют ферменты, ответственные за накопление энергии, в лизосомах — большинство гидролитических ферментов, участвующих в распаде нуклеиновых кислот и белков.
Химические результаты исследования
Нами был проведен опыт по изучению механизма действия ферментов на примере вареного куриного филе и сырого.
1. Активность фермента проявилась в пробирке с живыми тканями и не проявилась в пробирке с мёртвыми тканями, потому что в результате денатурации белка, нарушается структура молекулы фермента, её активность снижается, затем прекращается.
2. Измельчение ткани влияет на активность фермента из-за увеличения площади прикосновения, таким образом скорость протекания реакции увеличивается.
Важные отличия ферментов и неорганических катализаторов в том, что реакции с участием неорганических катализаторов протекают, как правило, при высоких давлениях, а ферменты работают при нормальном давлении. Самое главное отличие в том, что скорости реакций, катализируемых ферментами, во много раз больше.
Механизм работы ферментов
Мы провели опрос, среди учащихся МАОУ СШ №55 «Лингвист» по следующим вопросам:
Что такое ферменты?
Какова их роль в организме?
Что влияет на активность ферментов?
Какова химическая природа ферментов?
Чьи работы положили начало ферментологии, как самостоятельному разделу биологической химии?
Из 20 человек лишь 3 ответили правильно на все вопросы. 4 и 5 вопросы оказались самыми трудными для ребят.
Ферменты являются посредниками между организмом и окружающей средой, обеспечивают адаптацию организма к изменяющимся условиям (авторегуляторы).
Ферменты участвуют в осуществлении всех процессов обмена веществ, в реализации генетической информации. Переваривание и усвоение пищевых веществ, синтез и распад белков, нуклеиновых кислот, жиров, углеводов и других соединений в клетках и тканях всех организмов — все эти процессы невозможны без участия ферментов. Любое проявление функций живого организма — дыхание, мышечное сокращение, нервно-психическая деятельность, размножение и др. — обеспечивается действием ферментов. Индивидуальные особенности клеток, выполняющих определенные функции, в значительной мере определяются уникальным набором ферментов, производство которых генетически запрограммировано. Отсутствие даже одного фермента или какой-нибудь его дефект могут привести к серьезным отрицательным последствиям для организма.
Обычно ферменты выделяют из тканей животных, растений, клеток и культуральных жидкостей микроорганизмов, биологических жидкостей (кровь, лимфа и др.). Для получения некоторых труднодоступных ферментов используются методы генетической инженерии. Из исходных материалов ферменты экстрагируют солевыми растворами. Затем их разделяют на фракции, осаждая солями [обычно (NH 4 ) 2 SO 4 ] или, реже, органическими растворителями, и очищают методами гельпроникающей и ионообменной хроматографии. На заключительных этапах очистки часто используют методы аффинной хроматографии. Контроль за ходом очистки ферментов и характеристику чистых препаратов осуществляют, измеряя каталитическую активность ферментов с применением специфических (обычно дающих цветные реакции) субстратов. За единицу количества фермента принимают такое его количество, которое катализирует превращение 1 мк моля субстрата в 1 мин в стандартных условиях. Число единиц фермента, отнесенное к 1 мг белка, называется удельной активностью.
В мире производится около 20 ферментов в объеме 65 тыс. тонн (а существует, как предполагают 25000 ферментов). Например, промышленным способом производят такие ферменты как амилаза, глюкоамилаза, протеаза, инвертаза, пектиназа, каталаза, стрептокиназа, целлюлаза и другие.
Амилазы и протеазы используют в текстильной, хлебопекарной и кожевенной промышленности. Пектолитические ферменты могут быть использованы для мацерации тканей при переработке растительного сырья, например при получении льноволокна. Щелочные протеазы, особенно иммобилизованные, очень эффективно используются в составе моющих средств. Кроме протеолитических ферментов в состав моющих средств вводят липазу, целлюлазу, оксидазу и амилазу для удаления загрязнений крахмального происхождения. Использование иммобилизованной глюкозоизомеразы для непрерывного получения глюкозы является наиболее крупным процессом такого рода в мире.
Микробные ферменты активно используют в клинической диагностике при определении уровня холестерина в крови и мочевой кислоты. Ферменты предлагают использовать для очистки канализационных и водопроводных труб и т.д. и т.п. Ферменты для медицинских или аналитических целей должны быть высокоочищенными.
Иммобилизация и получение связанных ферментных препаратов стало возможным благодаря детальному изучению строения многих ферментов. Раскрыт аминокислотный состав ряда ферментных белков, их пространственная конфигурация, выявлены активные центры, значение различных функциональных групп в проявлении каталитической активности фермента и так далее.
Болезни, связанные с нарушением выработки ферментов
Отсутствие или снижение активности какого-либо фермента (нередко и избыточная активность) у человека приводит к развитию заболеваний (энзимопатий) или гибели организма. Так, передаваемое по наследству заболевание детей — галактоземия (приводит к умственной отсталости) — развивается вследствие нарушения синтеза фермента, ответственного за превращение галактозыв легко усваиваемую глюкозу. Причиной другого наследственного заболевания — фенилкетонурии, сопровождающегося расстройством психической деятельности, является потеря клетками печени способности синтезировать фермент, катализирующий превращение аминокислоты фенилаланинав тирозин. Определение активности многих ферментов в крови, моче, спинно-мозговой, семенной и других жидкостях организма используется для диагностики ряда заболеваний. С помощью такого анализа сыворотки крови возможно обнаружение на ранней стадии инфаркта миокарда, вирусного гепатита, панкреатита, нефрита и других заболеваний.
Если происходит мутация в гене, кодирующем определенный фермент, может измениться аминокислотная последовательность фермента. При этом в результате большинства мутаций его каталитическая активность снижается или полностью пропадает. Если организм получает два таких мутантных гена (по одному от каждого из родителей), в организме перестает идти химическая реакция, которую катализирует данный фермент. Например, появление альбиносов связано с прекращением выработки фермента тирозиназы, отвечающего за одну из стадий синтеза темного пигмента меланина. Фенилкетонурия связана с пониженной или отсутствующей активностью фермента фенилаланин-4-гидроксилазы в печени.
В настоящее время известны сотни наследственных заболеваний, связанные с дефектами ферментов. Разработаны методы лечения и профилактики многих из таких болезней.
1. Тарханов И. Р., Ферменты, в физиологии // Энциклопедический словарь Брокгауза и Ефрона: В 86 томах (82 т. и 4 доп.). — СПб., 1890—1907.
2. Энзимы // Энциклопедический словарь Брокгауза и Ефрона: В 86 томах (82 т. и 4 доп.).
3. Фершт Э. Структура и механизм действия ферментов. М., 1980.
5. Марри Р., Греннер Д., Мейес П., Родуэлл В. Биохомия человека. Т. 1. М., 1993.
13. Березов Т.Т., Коровкин Б.Ф. Биологическая химия. М.: «Медицина», 2004, с. 114-116, 118-120, 129-134, 139-143, 159-163, 165-168.
14. Кушманова О.Д., Ивченко Г.М. Руководство к лабораторным занятиям по биологической химии. М.: М. Медицина, 1983, раб 24 (п. 1), 25.
15. Учебник Химии 11 класс, Кузнецова Н.Е., Литвинова Т.Н., Лёвкин А.Н. с.132.
Биокатализаторы
Термины «фермент» и «энзим» давно используют как синонимы (первый в основном в русской и немецкой научной литературе, второй — в англо- и франкоязычной).
Наука о ферментах называется энзимологией, а не ферментологией (чтобы не смешивать корни слов латинского и греческого языков).
Содержание
История изучения
Термин фермент предложен в XVII веке химиком ван Гельмонтом при обсуждении механизмов пищеварения.
В кон. ХVIII — нач. XIX вв. уже было известно, что мясо переваривается желудочным соком, а крахмал превращается в сахар под действием слюны. Однако механизм этих явлений был неизвестен [1]
В XIX в. Луи Пастер, изучая превращение углеводов в этиловый спирт под действием дрожжей, пришел к выводу, что этот процесс (брожение) катализируется некой жизненной силой, находящейся в дрожжевых клетках.
Более ста лет назад термины фермент и энзим отражали различные точки зрения в теоретическом споре Л. Пастера с одной стороны, и М. Бертло и Ю. Либиха — с другой, о природе спиртового брожения. Собственно ферментами (от лат. fermentum — закваска) называли «организованные ферменты» (то есть сами живые микроорганизмы), а термин энзим (от греч. ἐν- — в- и ζύμη — дрожжи, закваска) предложен в 1876 году В. Кюне для «неорганизованных ферментов», секретируемых клетками, например, в желудок (пепсин) или кишечник (трипсин, амилаза). Через два года после смерти Л. Пастера в 1897 году Э. Бюхнер опубликовал работу «Спиртовое брожение без дрожжевых клеток», в которой экспериментально показал, что бесклеточный дрожжевой сок осуществляет спиртовое брожение так же, как и неразрушенные дрожжевые клетки. В 1907 году за эту работу он был удостоен Нобелевской премии.
Функции ферментов
Подобно всем катализаторам, ферменты ускоряют как прямую, так и обратную реакцию, понижая энергию активации процесса. Химическое равновесие при этом не смещается ни в прямую, ни в обратную сторону. Отличительной особенностью ферментов по сравнению с небелковыми катализаторами является их высокая специфичность — константа связывания некоторых субстратов с белком может достигать 10 −10 моль/л и менее. См. также Каталитически совершенный фермент
Ферменты широко используются в народном хозяйстве — пищевой, текстильной промышленности, в фармакологии.
Классификация ферментов
По типу катализируемых реакций ферменты подразделяются на 6 классов согласно иерархической классификации ферментов (КФ, EC — Enzyme Comission code). Классификация была предложена Международным союзом биохимии и молекулярной биологии (International Union of Biochemistry and Molecular Biology). Каждый класс содержит подклассы, так что фермент описывается совокупностью четырёх чисел, разделённых точками. Например, пепсин имеет название ЕС 3.4.23.1. Первое число грубо описывает механизм реакции, катализируемой ферментом:
Будучи катализаторами, ферменты ускоряют как прямую, так и обратную реакции, поэтому, например, лиазы способны катализировать и обратную реакцию — присоединение по двойным связям.
Соглашения о наименовании ферментов
Обычно ферменты именуют по типу катализируемой реакции, добавляя суффикс -аза к названию субстрата (например, лактаза — фермент, участвующий в превращении лактозы). Таким образом, у различных ферментов, выполняющих одну функцию, будет одинаковое название. Такие ферменты различают по другим свойствам, например, по оптимальному pH (щелочная фосфатаза) или локализации в клетке (мембранная АТФаза).
Кинетические исследования
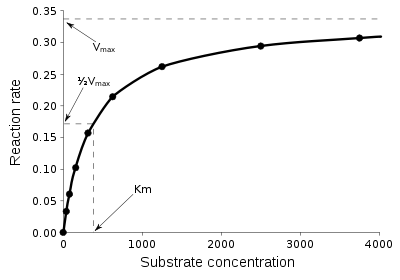
Простейшим описанием кинетики односубстратных ферментативных реакций является уравнение Михаэлиса — Ментен (см. рис.). На сегодняшний момент описано несколько механизмов действия ферментов. Например, действие многих ферментов описывается схемой механизма «пинг-понг».
Структура и механизм действия ферментов
Как и все белки, ферменты синтезируются в виде линейной цепочки аминокислот, которая сворачивается определённым образом. Каждая последовательность аминокислот сворачивается особым образом, и получающаяся молекула (белковая глобула) обладает уникальными свойствами. Несколько белковых цепей могут объединяться в белковый комплекс. Третичная структура белков разрушается при нагревании или воздействии некоторых химических веществ.
Чтобы катализировать реакцию, фермент должен связаться с одним или несколькими субстратами. Белковая цепь фермента сворачивается таким образом, что на поверхности глобулы образуется щель, или впадина, где связываются субстраты. Эта область называется сайтом связывания субстрата. Обычно он совпадает с активным центром фермента или находится вблизи него. Некоторые ферменты содержат также сайты связывания кофакторов или ионов металлов.
У некоторых ферментов есть сайты связывания малых молекул, они могут быть субстратами или продуктами метаболического пути, в который входит фермент. Они уменьшают или увеличивают активность фермента, что создает возможность для обратной связи.
Для активных центров некоторых ферментов характерно явление кооперативности.
Специфичность
Ферменты обычно проявляют высокую специфичность по отношению к своим субстратам. Это достигается частичной комплементарностью формы, распределения зарядов и гидрофобных областей на молекуле субстрата и в центре связывания субстрата на ферменте. Ферменты демонстрируют высокий уровень стереоспецифичности, региоселективности и хемоселективности.
Модель «ключ-замок»
Модель индуцированного соответствия
Модификации
Многие ферменты после синтеза белковой цепи претерпевают модификации, без которых фермент не проявляет свою активность в полной мере. Такие модификации называются посттрансляционными модификациями (процессингом). Один из самых распространенных типов модификации — присоединение химических групп к боковым остаткам полипептидной цепи. Например, присоединение остатка фосфорной кислоты называется фосфорилированием, оно катализируется ферментом киназой. Многие ферменты эукариот гликозилированы, то есть модифицированы олигомерами углеводной природы.
Еще один распространенный тип посттранляционных модификаций — расщепление полипептидной цепи. Например, химотрипсин (протеаза, участвующая в пищеварении), получается при выщеплении полипептидного участка из химотрипсиногена. Химотрипсиноген является неактивным предшественником химотрипсина и синтезируется в поджелудочной железе. Неактивная форма транспортируется в желудок, где превращается в химотрипсин. Такой механизм необходим для того, чтобы избежать расщепления поджелудочной железы и других тканей до поступления фермента в желудок. Неактивный предшественник фермента называют также «зимогеном».
Кофакторы ферментов
Некоторые ферменты выполняют каталитическую функцию сами по себе, безо всяких дополнительных компонентов. Однако есть ферменты, которым для осуществления катализа необходимы компоненты небелковой природы. Кофакторы могут быть как неорганическими молекулами (ионы металлов, железо-серные кластеры и др.), так и органическими (например, флавин или гем). Органические кофакторы, прочно связанные с ферментом, называют также простетическими группами. Кофакторы органической природы, способные отделяться от фермента, называют коферментами.
Фермент, который требует наличия кофактора для проявления каталитической активности, но не связан с ним, называется апо-фермент. Апо-фермент в комплексе с кофактором носит название холо-фермента. Большинство кофакторов связано с ферментом нековалентными, но довольно прочными взаимодействиями. Есть и такие простетические группы, которые связаны с ферментом ковалентно, например, тиаминпирофосфат в пируватдегидрогеназе.