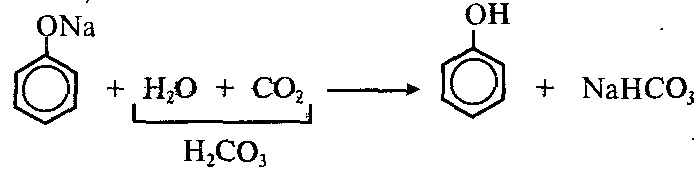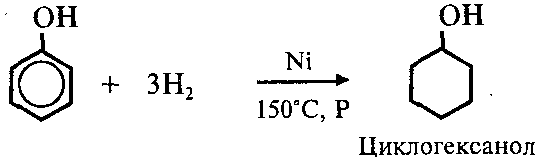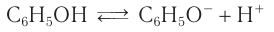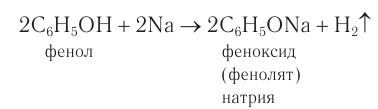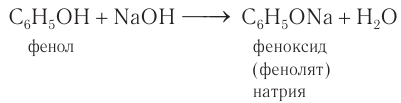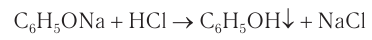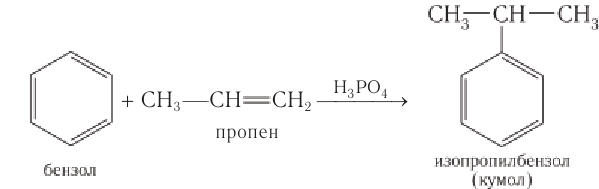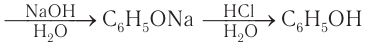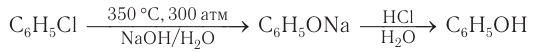Как называть фенолы по номенклатуре
Фенолы — номенклатура, получение, химические свойства
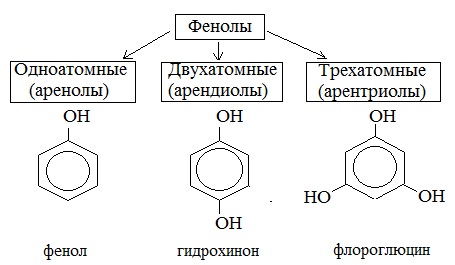
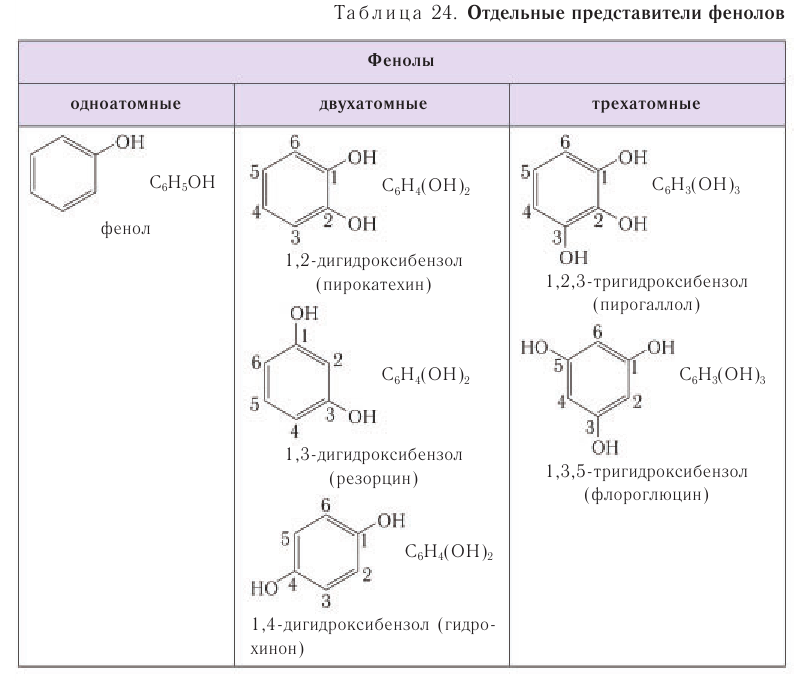
Фенолы — органические вещества,молекулы которых содержат радикал фенил,связанный с одной или несколькими гидроксогруппами. Так же как и спирты, фенолы классифицируют по атомности, т.е. по количеству гидроксильных групп.
Одноатомные фенолы содержат в молекуле одну гидроксильную группу:
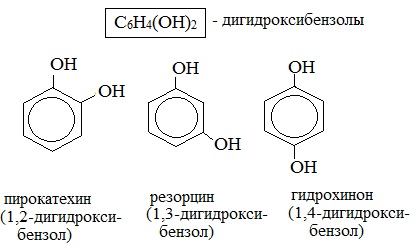
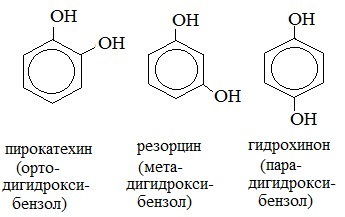
Многоатомные фенолы содержат в молекулах более одной гидроксильной группы:
Существуют и многоатомные фенолы, содержащие три и более гидроксильных групп в бензольном кольце.
Физические свойства фенола
Фенол-твердое, бесцветное кристаллическое вещества, t°плавления=43°С, t°кипения=181°С, с резким характерным запахом.Ядовит.Фенол при комнатной температуре незначительно растворяется в воде. Водный раствор фенола называют карболовой кислотой.При попадании на кожу он вызывает ожоги,поэтому с фенолом нужно обращаться очень осторожно!
Химические свойства фенола
Кислотные свойства фенола
Атом водорода гидроксильной группы обладает кислотным характером. Т.к. кислотные свойства у фенола выражены сильнее, чем у воды и спиртов, то фенол реагирует не только с щелочными металлами, но и со щелочами с образованием фенолятов:
Кислотность фенолов зависит от природы заместителей (донор или акцептор электронной плотности), положения относительно ОН-группы и от количества заместителей. Наибольшее влияние на ОН-кислотность фенолов оказывают группы, расположенные в орто- и пара-положениях. Доноры увеличивают прочность связи О-Н (тем самым уменьшая подвижность водорода и кислотные свойства), акцепторы уменьшают прочность связи О-Н, при этом кислотность возрастает:
Однако кислотные свойства у фенола выражены слабее, чем у неорганический и карбоновых кислот. Так, например, кислотные свойства фенола примерно в 3000 раз меньше,чем у угольной кислоты. Поэтому, пропуская через водный раствор фенолята натрия углекислый газ, можно выделить свободный фенол.
Добавление к водному раствору фенолята натрия соляной или серной кислоты также приводит к образованию фенола:

Качественная реакция на фенол
Фенол реагирует с хлоридом железа (3) с образованием интенсивно окрашенного в фиолетовый цвет комплексного соединения.Эта реакция позволяет обнаруживать его даже в очень ограниченных количествах.Другие фенолы,содержащие одну или несколько гидроксильных групп в бензольном кольце, также дают яркое окрашивание сине-фиолетовых оттенков в реакции с хлоридом железа(3).
Реакции бензольного кольца фенола
Наличие гидроксильного заместителя значительно облегчает протекание реакций электрофильного замещения в бензольном кольце.
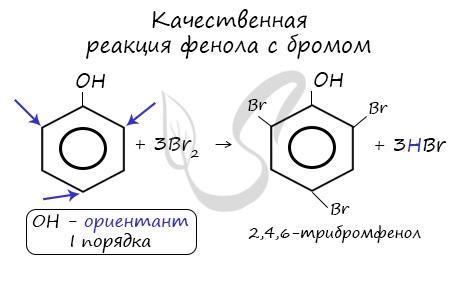
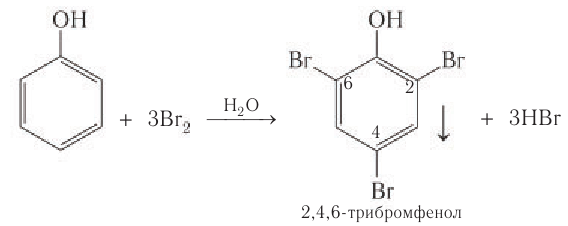
Так, при взаимодействии фенола с бромной водой образуется белый осадок 2,4,6-трибромфенола:
Эта реакция, так же как и реакция с хлоридом железа(3), служит для качественного обнаружения фенола.
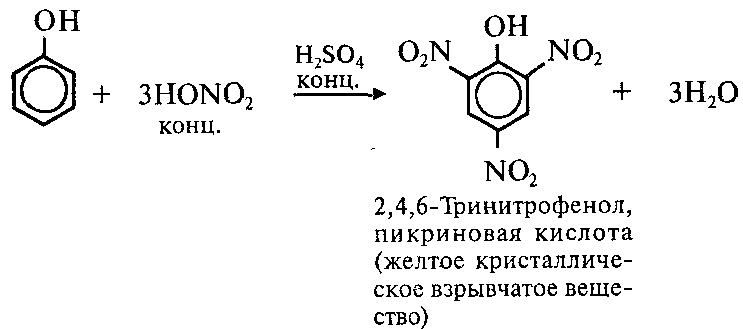
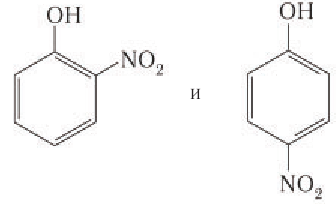
2. Нитрирование фенола также происходит легче, чем нитрирование бензола. Реакция с разбавленной азотной кислотой идет при комнатной температуре. В результате образуется смесь орто- и пароизомеров нитрофенола:
При использовании концентрированной азотной кислоты образуется 2,4,6, тринитритфенол-пикриновая кислота, взрывчатое вещество:
3. Гидрирование ароматического ядра фенола в присутствии катализатора проходит легко:
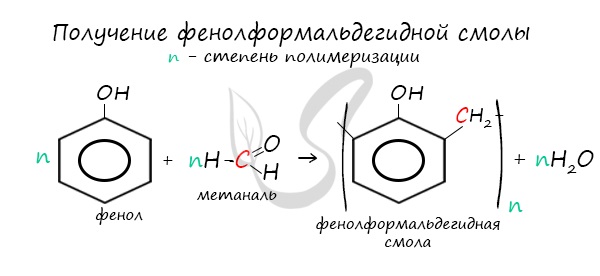
4. Поликонденсация фенола с альдегидами, в частности, с формальдегидом происходит с образованием продуктов реакции — фенолформальдегидных смол и твердых полимеров.
Взаимодействие фенола с формальдегидом можно описать схемой:
В молекуле димера сохраняются «подвижные» атомы водорода, а значит,возможно дальнейшее продолжение реакции при достаточном количестве реагентов:
Реакция поликонденсаци, т.е. реакция получения полимера, протекающая с выделением побочного низкомолекулярного продукта(воды), может продолжаться и далее (до полного израсходования одного из реагентов) с образованием огромных макромолекул. Процесс можно описать суммарным уравнением:
Образование линейных молекул происходит при обычной температуре. Проведение этой же реакции при нагревании приводит к тому, что образующийся продукт имеет разветвленное строение, он твердый и нерастворим в воде.В результате нагревания фенолформальдегидной смолы линейного строения с избытком альдегида получаются твердые пластические массы с уникальными свойствами. Полимера на основе фенолформальдегидных смол применяют для изготовления лаков и красок, пластмассовых изделий, устойчивых к нагреванию, охлаждению,действию воды, щелочей, кислот.Они обладают высокими диэлектрическими свойствами. Из полимеров на основе фенолформальдегидных смол изготавливают наиболее ответственные и важные детали электроприборов, корпуса силовых агрегатов и детали машин,полимерную основу печатных плат для радиоприборов. Клеи на основе фенолформальдегидных смол способны надежно соединять детали самой различной природы,сохраняя высочайшую прочность соединения в очень широком диапазоне температур. Такой клей применяется для крепления металлического цоколя ламп освещения к стеклянной колбе.Таким образом, фенол и продукты на его основе находят широкое применение.
Получение фенола
Применение фенолов
Фенол — твердое вещество, с характерным запахом, вызывает ожоги при попадании на кожу. Ядовит. Растворяется в воде, его раствор называют карболовой кислотой (антисептик). Она была первым антисептиком введенным в хирургию. Широко используется для производства пластмасс, лекарственных средств (салициловая кислота и ее производные), красителей, взрывчатых веществ.
Как называть фенолы по номенклатуре
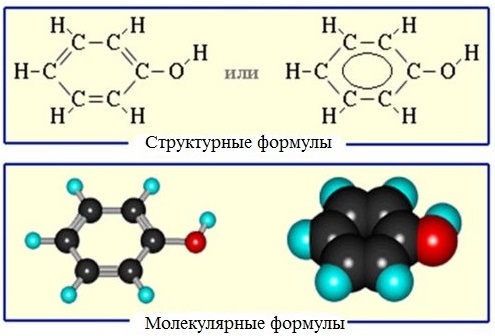
Фенолы – это производные ароматических углеводородов, молекулы которых содержат одну или несколько гидроксильных групп (- ОН), непосредственно соединенных с бензольным кольцом.
Фенолы – это гидроксильные производные бензола.
Общая формула Ar-ОН, где Ar – арил.
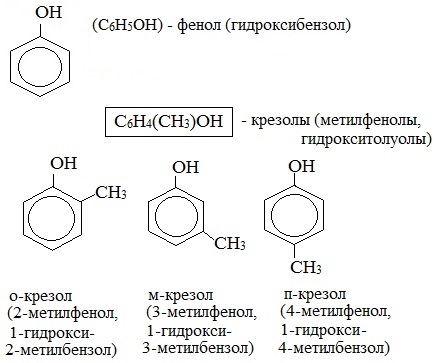
Простейшим и наиболее известным представителем этого класса соединений является фенол.
Молекулярная формула фенола С6Н5ОН.
Радикал фенола С6Н5 называется фенил.
Классификация фенолов
Существуют фенолы и большей атомности.
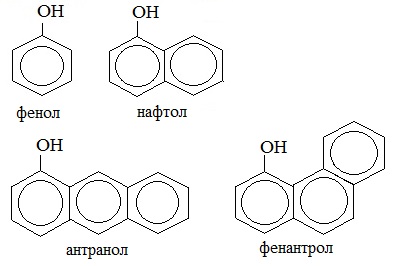
В соответствии с количеством конденсированных ароматических циклов в молекуле различают сами фенолы (одно ароматическое ядро – производные бензола), нафтолы (2 конденсированных ядра – производные нафталина), антранолы (3 конденсированных ядра – производные антрацена) и фенантролы.
Номенклатура фенолов
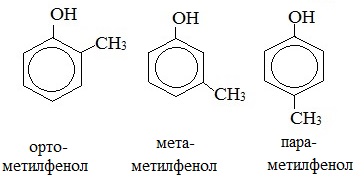
Простейшие одноатомные фенолы
Простейшие двухатомные фенолы
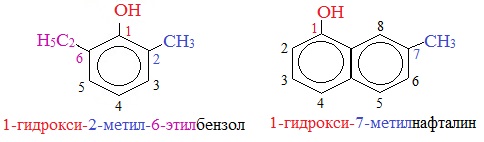
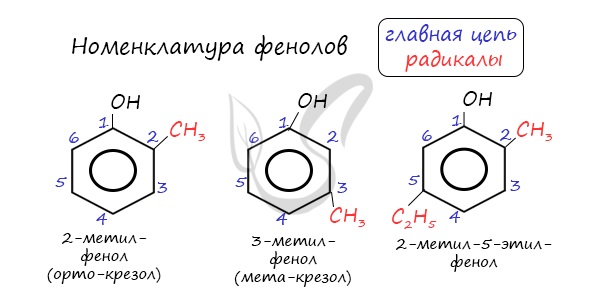
Для более сложных соединений нумеруют атомы, входящие в состав ароматических циклов и с помощью цифровых индексов указывают положение заместителей.
При построении номенклатуры фенолов атомы углерода в бензольном кольце обозначают цифрами от 1 до 6, начиная с атома углерода, связанного с гидроксильной группой.
Изомерия фенолов
Для фенолов характерно несколько видов изомерии.
1. Изомерия положения заместителей в бензольном кольце
2. Изомерия положения групп –ОН в многоатомных спиртах
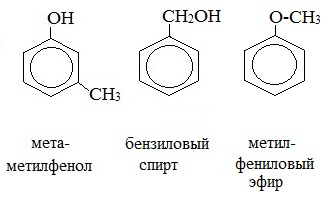
3. Межклассовая изомерия с ароматическими спиртами, простыми эфирами
Фенолы
Номенклатура фенолов
Нумерацию атомов углерода в молекуле фенола начинают в такой последовательности, чтобы заместители получили наименьшие номера (идут кратчайшим путем). В основе названия принято сохранять тривиальное название «фенол».
Напомню, что гидроксильная группа является ориентантом I порядка (орто-, пара-ориентант). Поэтому реакции галогенирования, нитрования протекают в орто- и пара-положениях.
Получение фенолов
При гидролизе галогенбензолов происходит обмен: гидроксогруппа встает на место атома галогена.
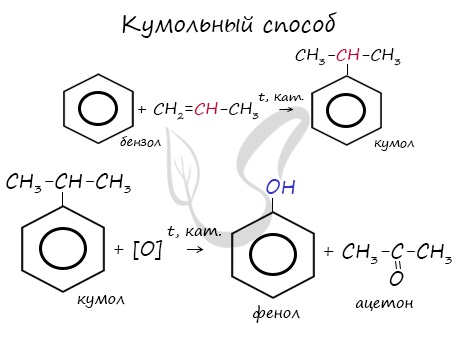
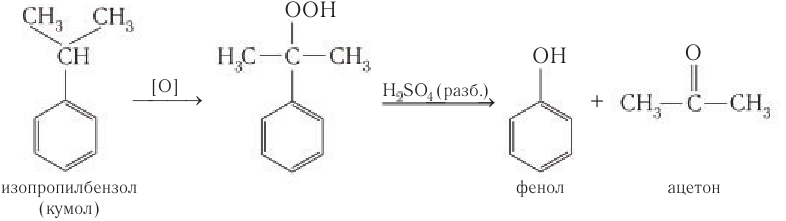
Этим способом получают 95% всего производимого фенола. В ходе этой реакции кумол (изопропилбензол) подвергают окислению, в результате получается фенол и ацетон.
Химические свойства фенолов
При гидрировании разрываются двойные связи бензольного кольца, образуется циклогексанол.
В промышленности получила широкое распространение реакция поликонденсации фенола с формальдегидом, приводящая к образованию смолообразных полимеров (фенолформальдегидные смолы) и воды.
© Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Фенолы
Фенолы – это производные ароматических углеводородов, содержащие одну или несколько гидроксильных групп у атомов углерода бензольного кольца.
Номенклатура и изомерия
Возможны два типа изомерии: изомерия положения заместителей в бензольном кольце и изомерия боковой цепи. Многие фенолы имеют тривиальные названия.
Физические свойства
Большинство одноатомных фенолов при нормальных условиях представляют собой бесцветные кристаллические вещества с невысокой температурой плавления и характерным запахом. Фенолы малорастворимы в воде, хорошо растворяются в органических растворителях, токсичны, при хранении на воздухе постепенно темнеют в результате окисления.
Фенол С6Н5ОН (карболовая кислота) — бесцветное кристаллическое вещество, t o плав.= 43 о С, t o кип. = 182 о С, на воздухе окисляется и становится розовым, при обычной температуре ограниченно растворим в воде, выше 66 о С смешивается с водой в любых соотношениях. Фенол – токсичное вещество, вызывает ожоги кожи, является антисептиком.
Химические свойства
Химические свойства фенолов обусловлены наличием в их молекулах функциональной группы – ОН и бензольного кольца.
I. Реакции с участием гидроксильной группы
Кислотные свойства
1.Диссоциация в водных растворах с образованием фенолят-ионов и ионов водорода.
2.Взаимодействие со щелочами с образованием фенолятов (отличие от спиртов):
3.Взаимодействие с активными металлами с образованием фенолятов (сходство со спиртами):
4.Образующиеся в результате реакций 2) и З) феноляты легко разлагаются при действии кислот. Даже такая слабая кислота, как угольная, вытесняет фенол из фенолятов (следовательно, фенол — еще более слабая кислота, чем угольная):
Феноляты используются в качестве исходных веществ для получения простых и сложных эфиров фенола:
II. Реакции с участием бензольного кольца
1.Реакции замещения
Реакции замещения в бензольном кольце фенолов протекают легче, чем у бензола, и в более мягких условиях.
Соотношение о- и n-изомеров определяется температурой реакции: при комнатной температуре в основном образуется о-фенолсульфокислота, при t о =100 о С – пара-изомер.
2.Реакции присоединения
III. Качественные реакции на фенолы
В водных растворах одноатомные фенолы взаимодействуют с хлоридом железа (III) FeCl3 с образованием комплексных фенолятов, которые имеют фиолетовую окраску; после прибавления сильной кислоты окраска исчезает.
Способы получения
1.Из каменноугольной смолы.
Каменноугольную смолу, содержащую в качестве одного из компонентов фенол, обрабатывают вначале раствором щелочи (образуются феноляты), а затем — кислотой:
2.Сплавление солей аренсульфокислот со щелочью:
3.Взаимодействие галогенпроизводных ароматических УВ со щелочами:
В качестве исходного сырья используют бензол и пропилен, из которых получают изопропилбензол (кумол), подвергающийся дальнейшим превращениям:
Скачать:
Скачать бесплатно реферат на тему: «Реакции фенолов» Реакции-фенолов.docx (207 Загрузок)
Скачать бесплатно реферат на тему: «Получение фенолов» Получение-фенолов.docx (Одна Загрузка)
Скачать рефераты по другим темам можно здесь
Похожее
Добавить комментарий Отменить ответ
Репетитор по химии. Занятия проходят онлайн по Скайпу. По всем вопросам пишите в Ватсапп: +7 928 285 70 42
Содержание:
Фенолы:
К гидроксилпроизводным органическим соединениям, кроме спиртов, относятся фенолы.
Фенолами называют производные ароматических углеводородов, в молекулах которых один или несколько атомов водорода, непосредственно связанных с бензольным кольцом, замещены на гидроксильные группы.
Число гидроксильных групп в молекуле определяет атомность фенолов. Они могут содержать до шести гидроксильных групп в молекуле. По числу гидроксильных групп фенолы, как и спирты, классифицируют как одно- и многоатомные фенолы.
В таблице 24 для ознакомления приведены формулы и названия некоторых фенолов различной атомности.
В данном курсе органической химии вы познакомитесь со строением и свойствами одного представителя класса — фенолом
Строение фенола
Фенол 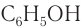
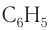
Шаростержневая и масштабная модели молекулы фенола приведены на рисунке 52.
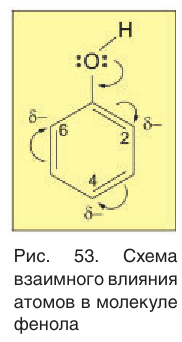
Рассмотрим электронное строение молекулы фенола. Одна из неподеленных электронных пар атома кислорода вступает в сопряжение с 
Сопряжение неподеленной электронной пары атома кислорода с 
Физические свойства фенола
Фенол — бесцветное кристаллическое вещество с резким характерным запахом. Кристаллическое состояние фенола обусловлено наличием прочных водородных связей между его молекулами. При обычной температуре фенол незначительно растворяется в воде, но хорошо раетворяетея в горячей воде. Фенол очень ядовит, при попадании на кожу вызывает cильнейшие ожоги, поэтому работать е ним в школьном химичееком кабинете запрещено.
Химические свойства фенола
Химические свойства фенола обусловлены наличием в молекуле функциональной группы —ОН и бензольного кольца, которые взаимно влияют друг на друга. В молекуле фенола бензольное кольцо влияет на гидроксильную группу, что проявляется в повышенной кислотности фенола по сравнению с насыщенными одноатомными спиртами. Влияние гидроксильной группы на бензольное кольцо обусловливает более легкое замещение в нем атомов водорода на какой-либо заместитель у атомов углерода в положениях 2, 4, 6.
Рассмотрим последовательно химические реакции, протекающие с участием гидроксильной группы и бензольного кольца.
1) Диссоциация в водных растворах. Молекулы фенола диссоциируют в водных растворах по кислотному типу:
Фенол является слабой кислотой (иногда его называют карболовой кислотой), что отличает его от спиртов, которые практически не диссоциируют в водных растворах.
2) Взаимодействие со щелочными металлами. Наличие в молекуле фенола гидроксильной группы, непосредственно связанной с бензольным кольцом, обусловливает определенное сходство по химическим свойствам с одноатомными спиртами. Если в расплавленный фенол поместить кусочек металлического натрия, то происходит реакция замещения атома водорода в гидроксильной группе. При этом образуется соединение, которое по номенклатуре ИЮПАК называют феноксид. Используется и другое название — фенолят, допускаемое номенклатурой ИЮПАК. В реакции со щелочными металлами фенол проявляет кислотные свойства:
3) Взаимодействие со щелочами. Кислотные свойства у фенола, как вам известно, выражены сильнее, чем у одноатомных насыщенных спиртов. Поэтому, в отличие от них, фенол реагирует не только со щелочными металлами, но и с водными растворами щелочей с образованием феноксидов (фенолятов):
Кислотные свойства у фенола выражены слабее, чем у неорганических кислот, даже таких слабых, как угольная. Поэтому добавление к водному раствору фенолята натрия соли угольной кислоты (кислотные свойства фенола примерно в три тысячи раз слабее, чем угольной кислоты) приводит к образованию фенола. Образуется фенол и при добавлении к водному раствору фенолята сильных минеральных кислот:
4) Галогенирование. Реакции галогенирования, в частности бромирования, протекают с замещением атомов водорода в бензольном кольце. В отличие от бензола для бромирования фенола не требуется катализатор, так как влияние гидроксильной группы значительно облегчает протекание реакций замещения в бензольном кольце. При действии на фенол раствора брома в воде образуется белый осадок 2,4,6-трибромфенола (рис 54).
Эта реакция часто используется для качественного обнаружения фенола.
Фенол дает характерное фиолетовое окрашивание с водным раствором хлорида железа(III) вследствие образования комплексной соли железа. Эту реакцию также используют для обнаружения фенола и относят к цветной качественной реакции.
5) Нитрование. Фенол так же, как и бензол, взаимодействует е азотной кислотой, но нитрование фенола протекает легче, чем нитрование бензола. Реакция фенола с разбавленной азотной кислотой идет при комнатной температуре, и в результате образуется смесь изомеров нитрофенола:
Фенолами называют производные ароматических углеводородов, в молекулах которых один или несколько атомов водорода, непосредственно связанных с бензольным кольцом, замещены на гидроксильные группы.
Фенол 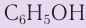
Для фенола характерны реакции гидроксильной группы (со щелочными металлами, щелочами) и бензольного кольца (галогенирование, нитрование).
Получение и применение фенола
Получение: Одним из основных промышленных методов получения фенола является кумольный метод. Он был разработан в 40-е гг. XX в. в Советском Союзе Р. Ю. Удрисом, Б. Д. Кружаловым, П. С. Сергеевым, М. С. Немцовым и до наших дней не утратил своей эффективности. Для получения фенола используются экономически выгодные исходные вещества — бензол и пропей.
Упрощенно синтез фенола можно представить так. Сначала в реакции бензола с пропеном синтезируют изопропилбензол (кумол):
Затем кумол окисляют, продукт окисления кумола разлагают разбавленной серной кислотой и получают при этом фенол и ацетон 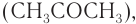
Схема получения из кумола фенола приведена для ознакомления и не требует запоминания.
Ранее фенол выделяли только из каменноугольной смолы, образующейся как побочный продукт коксохимического производства. Каменноугольную смолу обрабатывали щелочами, а, как вам известно, водные растворы щелочей взаимодействуют с фенолом с образованием фенолятов. Затем феноляты обрабатывали минеральными кислотами и получали фенол. Схематически процесс экстрагирования фенола из каменноугольной смолы можно представить так:
каменноугольная смола
Фенол можно получить, используя в качестве исходного вещества бензол. При хлорировании бензола сначала получают хлорбензол, затем хлорбензол под действием водного раствора гидроксида натрия дает фенолят натрия, который в реакции с минеральными кислотами превращается в фенол:
Этот способ получения фенола в настоящее время практически не используется как технически устаревший и экономически нецелесообразный. Однако знакомство с ним представляет интерес как пример генетической связи между углеводородами, галогенпроизводными и гидроксилпроизводными (фенолами).
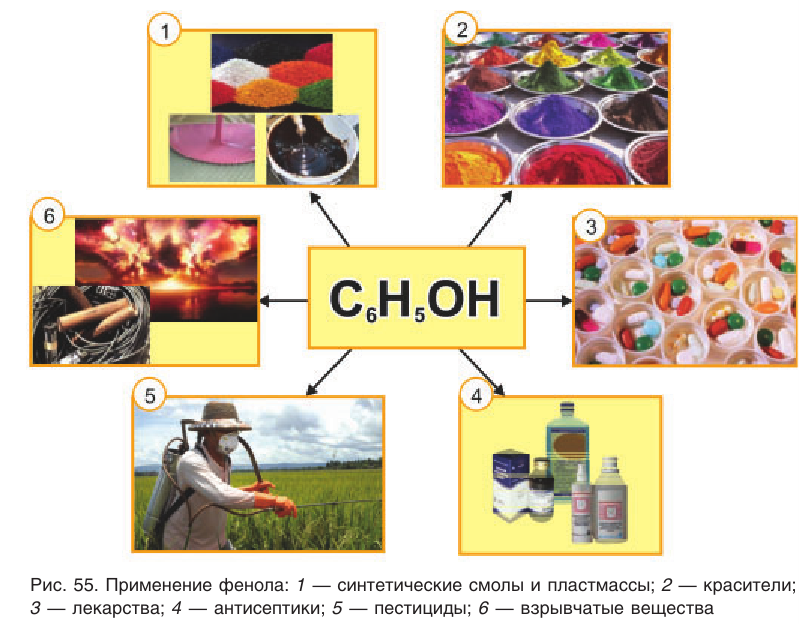
Применение: Фенол и продукты, получаемые на его основе, находят широкое применение (рис. 55). Практически половина производимого фенола расходуется на синтез фенолформальдегидных смол. Полимеры на основе этих смол применяются для изготовления лаков и красок, пластмассовых изделий, устойчивых к действию кислот и щелочей, нагреванию. Из пластмасс на основе фенолформальдегидных смол изготовляют важные детали электро- и радиоприборов, аппаратуры, используемой для работы при высокой температуре и в агрессивных средах. Клеи, полученные на основе фенолформальдегидных смол, надежно соединяют детали, изготовленные из самых различных веществ, сохраняя высокую прочность соединения.
Фенол служит исходным веществом для получения многих лекарственных препаратов, например аспирина, красителей, пестицидов, антисептиков. Он используется в генной инженерии и молекулярной биологии в качестве средства для очистки и выделения молекул ДНК.
Тринитрофенол (пикриновая кислота) находит применение в производстве взрывчатых веществ.
Гидрохинон применяется в фотографии в качестве проявителя, так как он очень легко окисляется.
Пирокатехин используется для получения адреналина — гормона, вырабатываемого надпочечниками.
Резорцин применяется наружно как антисептик при кожных заболеваниях в виде водных и спиртовых растворов; в производстве красителей, стабилизаторов и пластификаторов полимеров.
Фенол и его производные — ядовитые вещества, очень опасные для человека, животных и растительных организмов. Вдыхание паров фенола может привести к ожогам дыхательных путей и последующему отеку легких. При попадании фенола на кожу образуются химические ожоги. Фенол не теряет летучих свойств даже в составе пластмасс, вот поэтому во многих странах мира запрещено производство предметов быта и детских игрушек с использованием фенопластов, представляющих опасность для здоровья людей.
В составе отходов производства могут содержаться чрезвычайно ядовитые вещества, например диоксин:
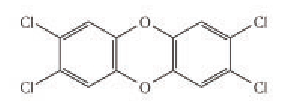
Чтобы предотвратить их попадание в окружающую среду, применяются различные физические и химические методы очистки.
Фенол в основном получают в процессе органического синтеза кумольным методом.
Фенол и его производные применяются в качестве исходных веществ для производства синтетических смол и пластмасс, синтеза красителей, лекарств и многих других ценных продуктов.
При копировании любых материалов с сайта evkova.org обязательна активная ссылка на сайт www.evkova.org
Сайт создан коллективом преподавателей на некоммерческой основе для дополнительного образования молодежи
Сайт пишется, поддерживается и управляется коллективом преподавателей
Whatsapp и логотип whatsapp являются товарными знаками корпорации WhatsApp LLC.
Cайт носит информационный характер и ни при каких условиях не является публичной офертой, которая определяется положениями статьи 437 Гражданского кодекса РФ. Анна Евкова не оказывает никаких услуг.