Как называется в химии nacl
Хлористый натрий
Хлористый натрий
| Хлорид натрия | |
 | |
| Общие | |
|---|---|
| Систематическое наименование | хлорид натрия / Sodium chloride |
| Химическая формула | NaCl |
| Молярная масса | 58.44277 г/моль |
| Физические свойства | |
| Плотность вещества | 2.165 г/см³ |
| Термические свойства | |
| Температура плавления | 800,8 °C |
| Температура кипения | 1465 °C |
| Химические свойства | |
| Растворимость в воде | 35.9 г/100 мл |
| Классификация | |
| номер CAS | [7647-14-5] |
Хлорид натрия известен в быту под названием поваренной соли, основным компонентом которой он является. Хлорид натрия в значительном количестве содержится в морской воде, создавая её солёный вкус. Встречается в природе в виде минерала галита (каменная соль).
Чистый хлорид натрия имеет вид бесцветных кристаллов.
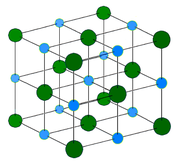
Кристаллическая структура
Хлорид натрия образует кристаллы с кубической симметрией. Более крупные ионы хлора образуют плотную кубическую упаковку, в свободных узлах которой (в вершинах правильного октаэдра) расположены ионы натрия.
Умеренно растворяется в воде, растворимость мало зависит от температуры: коэффициент растворимости NaCl (в г на 100 г воды) равен 35,9 при 21° С и 38,1 при 80° С. Растворимость хлорида натрия существенно снижается в присутствии хлороводорода, гидроксида натрия, солей — хлоридов металлов. Растворяется в жидком аммиаке, вступает в реакции обмена.
| Термодинамические характеристики | |
|---|---|
| ΔfH 0 g | −181,42 кДж/моль |
| ΔfH 0 l | −385,92 кДж/моль |
| ΔfH 0 s | −411,12 кДж/моль |
| ΔfH 0 aq | −407 кДж/моль |
| S 0 g, 1 bar | 229,79 Дж/(моль K) |
| S 0 l, 1 bar | 95,06 Дж/(моль K) |
| S 0 s | 72,11 Дж/(моль•K) |
Диэлектрическая проницаемость NaCl — 6,3
См. также
Полезное
Смотреть что такое «Хлористый натрий» в других словарях:
ХЛОРИСТЫЙ НАТРИЙ — Поваренная соль. Объяснение 25000 иностранных слов, вошедших в употребление в русский язык, с означением их корней. Михельсон А.Д., 1865. ХЛОРИСТЫЙ НАТРИЙ То же, что поваренная соль. Словарь иностранных слов, вошедших в состав русского языка.… … Словарь иностранных слов русского языка
ХЛОРИСТЫЙ НАТРИЙ — (ХН) – кристаллический порошок белого цвета, растворимый в воде; должен храниться в условиях исключающих увлажнение. [Изотов В.С. Химические добавки для модификации бетона: монография / В.С. Изотов, Ю.А. Соколова. М.: Казанский Государственный… … Энциклопедия терминов, определений и пояснений строительных материалов
Хлористый натрий — см. Соль поваренная, Каменная соль и Натрий … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
хлористый натрий — хлорид натрия … Cловарь химических синонимов I
НАТРИЙ — НАТРИЙ. Natrium, химич. элемент, симв. Na, серебристобелый, блестящий, при обыкновенной t° восковой плотности одноатомный металл, делающийся хрупким на холоду и при ярко краснокалильном жаре перегоняющийся; открыт Де.ви (1807) электролизом… … Большая медицинская энциклопедия
хлористый — прилагательное от слова хлор; хлористый этил – жидкость, получаемая из винного спирта и соляной кислоты; ввиду её быстрой испаряемости ею пользуются в медицине для местной анестезии; хлористый кальций – вещество, получаемое при растворении… … Словарь иностранных слов русского языка
ХЛОРИСТЫЙ — ХЛОРИСТЫЙ, хлористая, хлористое (хим.). Находящийся в соединении с хлором, содержащий в себе хлор. Хлористый кальций. Хлористый натрий. Хлористый водород. Толковый словарь Ушакова. Д.Н. Ушаков. 1935 1940 … Толковый словарь Ушакова
НАТРИЙ — (греч. nitron, лат. natrum). Металл белого цвета, составляющий часть поваренной соли, соды, селитры и др. Словарь иностранных слов, вошедших в состав русского языка. Чудинов А.Н., 1910. НАТРИЙ белый блестящий мягкий металл, быстро окисляющийся в… … Словарь иностранных слов русского языка
НАТРИЙ — щелочный металл белого цвета, блестящий, быстро тускнеющий на воздухе; при соединении с водой образует едкий натр, энергично выделяя водород. Физические свойства Н.: уд. вес 0,97, темп pa плавления 97,7°. Чистый Н. хранится только в керосине. В… … Технический железнодорожный словарь
Натрий* — (хим.; нем. Natrium, франц. и англ. Sodium). Сведения о соединениях этого металла ведут свое начало от очень старых времен. Еврейское слово neter (греч. νίτρον, лат. nitrum) встречается в Библии как название вещества, которое, по Соломону,… … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
Хлорид натрия
Хлорид натрия или хлористый натрий (NaCl) — натриевая соль соляной кислоты. Известен в быту под названием поваренной соли, основным компонентом которой и является. Хлорид натрия в значительном количестве содержится в морской воде. Встречается в природе в виде минерала галита (каменной соли). Чистый хлорид натрия представляет собой бесцветные кристаллы, но с различными примесями его цвет может принимать голубой, фиолетовый, розовый, жёлтый или серый оттенок.
Содержание
Нахождение в природе и производство
В природе хлорид натрия встречается в виде минерала галита, который образует залежи каменной соли среди осадочных горных пород, прослойки и линзы на берегах солёных озёр и лиманов, соляные корки в солончаках и на стенках кратеров вулканов и в сольфатарах. Огромное количество хлорида натрия растворено в морской воде. Мировой океан содержит 4 × 10 15 тонн NaCl, то есть из каждой тонны морской воды можно получить в среднем 1,3 кг хлорида натрия. Следы NaCl постоянно содержатся в атмосфере в результате испарения брызг морской воды. В облаках на высоте полтора километра 30 % капель, больших 10 мкм по размеру, содержат NaCl. Также он найден в кристаллах снега.
Наиболее вероятно, что первое знакомство человека с солью произошло в лагунах тёплых морей или на соляных озёрах, где на мелководье солёная вода интенсивно испарялась под действием высокой температуры и ветра, а в осадке накапливалась соль. По образному выражению Пифагора, «соль была рождена благородными родителями: солнцем и морем».
Галит
В природе хлорид натрия чаще всего встречается в виде минерала галита. Он имеет гранецентрированную кубическую решётку и содержит 39,34 % Na, 60,66 % Cl. Другими химическими элементами, входящими в состав примесей, являются: Br, N, H, Mn, Cu, Ga, As, I, Ag, Ba, Tl, Pb, K, Ca, S, O. Плотность 2,1—2,2 г/см³, а твёрдость по шкале Мооса — 2. Бесцветный прозрачный минерал со стеклянным блеском. Распространённый минерал соленосных толщ. Образуется при осаждении в замкнутых водоёмах, а также как продукт сгона на стенках кратеров вулканов. Составляет пласты в осадочных породах лагунных и морских фаций, штокоподобные тела в соляных куполах и тому подобных.
Каменная соль
Каменной солью называют осадочную горную породу из группы эвапоритов, состоящую более чем на 90 % из галита. Галит также часто называют каменной солью. Эта осадочная горная порода может быть бесцветной или снежно-белой, но чаще она окрашена примесями глин, талька (серый цвет), оксидами и гидроксидами железа (жёлтый, оранжевый, розовый, красный), битумами (бурая). Каменная соль содержит хлориды и сульфаты натрия, калия, магния и кальция, бромиды, йодиды, бораты, гипс, примеси карбонатно-глинистого материала, доломита, анкериту, магнезита, битумов и так далее.
По условиям формирования месторождений каменную соль подразделяют на следующие виды:
Морская соль
Морская соль является смесью солей (хлориды, карбонаты, сульфаты и т. д.), образующейся при полном испарении морской воды. Среднее содержание солей в морской воде составляет:
| Соединение | Масс. доля, % |
|---|---|
| NaCl | 77,8 |
| MgCl2 | 10,9 |
| MgSO4 | 4,7 |
| KCl | 2,5 |
| K2SO4 | 2,5 |
| CaCO3 | 0,3 |
| Ca(HCO3)2 | 0,3 |
| другие соли | 0,2 |
При испарении морской воды при температуре от +20 до +35 °C в осадке сначала кристаллизуются наименее растворимые соли — карбонаты кальция и магния и сульфат кальция. Затем выпадают более растворимые сульфаты натрия и магния, хлориды натрия, калия и магния, и после них — сульфаты калия и магния. Последовательность кристаллизации солей и состав осадка может несколько варьироваться в зависимости от температуры, скорости испарения и других условий. В промышленности морскую соль получают из морской воды, в основном методом обычного выпаривания. Она отличается от каменной соли значительно большим содержанием других химических солей, минералов и различных микроэлементов, в первую очередь йода, калия, магния и марганца. Соответственно, она отличается от хлорида натрия и по вкусу — горько-солёный привкус ей придают соли магния. Она используется в медицине: при лечении кожных заболеваний, таких как псориаз. Как лечебное вещество в аптечной и обычной торговой сети, распространённым продуктом является соль из Мёртвого моря. В очищенном виде этот вид соли также предлагается в продуктовой торговой сети — как натуральная и богатая йодом пищевая.
Залежи
Залежи каменной соли найдены во всех геологических системах. Важнейшие из них сосредоточены в кембрийских, девонских, пермских и третичных отложениях. Каменная соль составляет мощные пластовые залежи и ядра сводчатых структур (соляных куполов и штоков), образует прослойки, линзы, гнезда и вкрапления в других породах. Среди озёрных месторождений России крупнейшие — Эльтонское, Баскунчак в Прикаспии, Кучукское озеро, Кулундинское озеро, Эбейты и другие озёра в Западной Сибири.
Производство
В древности технология добычи соли заключалась в том, что соляную рапу (раствор) вытаскивали лошадиным приводом из шахт, которые назывались «колодцами» или «окнами», и были достаточно глубокими — 60—90 м. Извлечённый солевой раствор выливали в особый резервуар — творило, откуда она через отверстия стекала в нижний резервуар, и системой жёлобов подавалась в деревянные башни. Там её разливали в большие чаны, на которых соль вываривали.
На Руси поморы вываривали соль на побережье Белого моря и называли её морянка. В 1137 году новгородский князь Святослав определил налог на соляные варницы.
Беломорской солью, называемой «морянкой», торговали по всей Российской империи до начала XX века, пока её не вытеснила более дешёвая поволжская соль.
Современная добыча хлорида натрия механизирована и автоматизирована. Соль массово добывается выпариванием морской воды (тогда её называют морской солью) или рассола с других ресурсов, таких как соляные источники и соляные озера, а также разработкой соляных шахт и добычей каменной соли.
Для добычи хлорида натрия из морской воды необходимы условия жаркого климата с низкой влажностью воздуха, наличие значительных низменных территорий, лежащих ниже уровня моря, или затопляемых приливом, слабая водопроницаемость почвы испарительных бассейнов, малое количество осадков в течение сезона активного испарения, отсутствие влияния пресных речных вод и наличие развитой транспортной инфраструктуры.
Мировое производство соли в 2009 году оценивается в 260 миллионов тонн. Крупнейшими мировыми производителями являются Китай (60,0 млн тонн), США (46,0 млн тонн), Германия (16,5 млн тонн), Индия (15,8 млн тонн) и Канада (14 млн тонн).
Добыча соли в южной части Мертвого моря, Израиль
Состав хлорида натрия (NaCl), свойства, применение, токсичность
Хлорид натрия представляет собой кристаллическое белое твердое вещество, которое образуется в результате сочетания натрия, серебристо-белого металла, который бурно реагирует с водой, и элемента хлора, ядовитого, едкого, бледно-зеленого газа..
На верхнем изображении показана часть кристаллов NaCl. Как это возможно, что два элемента столь же опасны, как Na и Cl2, может образовываться пищевая соль? Во-первых, химическое уравнение его образования:
Кроме того, Na + отвечает за генерацию и проведение нервных импульсов в нейрональных аксонах, а также за инициацию сокращения мышц.
NaCl использовался с древних времен для придания аромата пище и сохранения мяса благодаря его способности уничтожать бактерии и предотвращать порчу.
Это также необходимо для производства гидроксида натрия (NaOH) и молекулярного хлора (Cl2) путем взаимодействия NaCl с водой при гидролизе:
В катоде (-) Н накапливается2 (г) и NaOH. Между тем Cl накапливается на аноде (+)2 (G). Гидроксид натрия используется при производстве мыла и хлора при производстве пластика ПВХ.
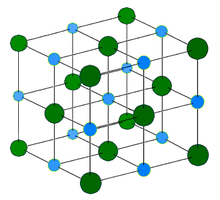
Структура хлорида натрия
Унитарная ячейка
Элементарная ячейка каменной соли является кубической, но какие именно кубы точно представляют ее на изображении выше? Октаэдры дают ответ. Оба покрывают в общей сложности четыре маленьких кубика.
У этих кубиков есть части ионов в их вершинах, краях и гранях. Соблюдая осторожность, ион Na + он расположен в центре и двенадцать из них по краям. Ион на одном ребре может быть разделен на четыре куба. Таким образом, есть 4 иона Na + (12 × 1/4 + 1 = 4).
Хлорид натрия
Хлори́д на́трия — химическое соединение NaCl, натриевая соль соляной кислоты, хлористый натрий.
Хлорид натрия известен в быту под названием поваренной соли, основным компонентом которой он является. Хлорид натрия в значительном количестве содержится в морской воде, создавая её солёный вкус. Встречается в природе в виде минерала галита (каменная соль).
Чистый хлорид натрия имеет вид бесцветных кристаллов, но с различными примесями его цвет может принимать голубой, фиолетовый, розовый, жёлтый или серый оттенок.
Содержание
Нахождение в природе и производство
Галит
В природе хлорид натрия чаще всего встречается в виде минерала галита. Он имеет гранецентрированную кубическую решетку и содержит 39,34 % Na, 60,66 % Cl. Другими химическими элементами, входящими в состав примесей, являются: Br, N, H, Mn, Cu, Ga, As, I, Ag, Ba, Tl, Pb, K, Ca, S, O. Плотность 2,1—2, 2 г / см ³, а твёрдость по шкале Мооса — 2. Бесцветный, прозрачный минерал, со стеклянным блеском. Распространённый минерал соленосных толщ. Образуется при осаждении в замкнутых водоёмах, а также как продукт сгона на стенках кратеров вулканов. Составляет пласты в осадочных породах лагунных и морских фаций, штокоподобные тела в соляных куполах и т. п. [4]
Каменная соль
Каменной солью называют осадочную горную породу из группы эвапоритов, состоящую более чем на 90 % из галита. Галит также часто называют каменной солью. Эта осадочная горная порода может быть бесцветной или снежно-белой, но чаще она окрашена примесями глин, талька (серый цвет), оксидами и гидроксидами железа (желтый, оранжевый, розовый, красный), битумами (бурая). Каменная соль содержит хлориды и сульфаты натрия, калия, магния и кальция, бромиды, йодиды, бораты, гипс, примеси карбонатно-глинистого материала, доломита, анкериту, магнезита, битумов и т. д. [4]
По условиям формирования месторождений каменную соль подразделяют на следующие виды [4] :
Морская соль
Морская соль является смесью солей (хлориды, карбонаты, сульфаты и т. д.), образующейся при полном испарении морской воды. Среднее содержание солей в морской воде составляет:
| Соединение | Масс. доля, % |
|---|---|
| NaCl | 77,8 |
| MgCl2 | 10,9 |
| MgSO4 | 4,7 |
| KCl | 2,5 |
| K2SO4 | 2,5 |
| CaCO3 | 0,3 |
| Ca(HCO3)2 | 0,3 |
| другие соли | 0,2 |
Залежи
Производство
В древности технология добычи соли заключалась в том, что соляную рапу вытаскивали лошадиным приводом из шахт, которые назывались «колодцами» или «окнами», и были достаточно глубокими — 60—90 м. Извлечённую соль выливали в особый резервуар — творило, откуда она через отверстия стекала в нижний резервуар, и системой желобов подавалась в деревянные башни. Там её разливали в большие чаны, на которых соль вываривали.
На Руси поморы вываривали соль на побережье Белого моря и называли её морянка. В 1137 новгородский князь Святослав определил налог на соляные варницы [6] :
 | …на мори от чрена и от салгы по пузу… |  |
Беломорской солью, называемой «морянкой», торговали по всей Российской империи до начала XX века, пока её не вытеснила более дешёвая поволжская соль.
Современная добыча хлорида натрия механизирована и автоматизирована. Соль массово добывается выпариванием морской воды (тогда её называют морской солью) или рассола с других ресурсов, таких как соляные источники и соляные озера, а также разработкой соляных шахт и добычей каменной соли. Для добычи хлорида натрия из морской воды необходимы условия жаркого климата с низкой влажностью воздуха, наличие значительных низменных территорий, лежащих ниже уровня моря, или затопляемых приливом, слабая водопроницаемость почвы испарительных бассейнов, малое количество осадков в течение сезона активного испарения, отсутствие влияния пресных речных вод и наличие развитой транспортной инфраструктуры.
Добыча соли в южной части Мертвого моря, Израиль
Кристаллы каменной соли
Плантация морской соли в Дакаре
Соляные кучи на солончаке Уюни, Боливия
Применение
В пищевой промышленности и кулинарии
В пищевой промышленности и кулинарии используют хлорид натрия, чистота которого должна быть не менее 97 %. Его применяют как вкусовую добавку и для консервирования пищевых продуктов. Такой хлорид натрия имеет товарное название поваренная соль, порой также употребляются названия пищевая, столовая, а также уточнение названия в зависимости от её происхождения — каменная, морская, и по составу добавок — йодированная, фторированная и т. д. Такая соль является кристаллическим сыпучим продуктом с солёным вкусом без привкуса, без запаха (за исключением йодированной соли), в котором не допускаются посторонние примеси, не связанные с методом добывании соли. Кроме хлорида натрия, поваренная соль содержит небольшое количество солей кальция, магния, калия, которые придают ей гигроскопичности и жёсткости. Чем меньше этих примесей в соли, тем выше её качество.
Выделяют сорта: экстра, высший, первый и второй. Массовая доля хлористого натрия в сортах,%:
Массовая доля влаги в выварочной соли сорта «экстра» 0,1 %, в высшем сорте — 0,7 %. Допускают добавки йодида калия (йодистого калия), йодата калия, фторидов калия и натрия. Массовая доля йода должна составлять (40,0 ± 15,0) × 10 −4 %, фтора (25,0 ± 5,0) × 10 −3 %. Цвет экстра и высшего сортов — белый, однако для первого и второго допускается серый, желтоватый, розовый и голубоватый оттенки в зависимости от происхождения соли. Пищевую поваренную соль производят молотой и сеяной. По размеру зёрен молотую соль подразделяют на номера: 0, 1, 2, 3. Чем больше номер, тем больше зерна соли.
В кулинарии хлорид натрия потребляют как важнейшую приправу. Соль имеет характерный вкус, без которого пища кажется человеку пресной. Такая особенность соли обусловлена физиологией человека. Однако зачастую люди потребляют соли больше, чем нужно для физиологических процессов.
Хлорид натрия имеет слабые антисептические свойства — 10-15 % содержание соли предотвращает размножение гнилостных бактерий. Этот факт обусловливает её широкое применение как консерванта.
В медицине
В коммунальном хозяйстве. Техническая соль
Зимой хлорид натрия, смешанный с другими солями, песком или глиной — так называемая техническая соль — применяется как антифриз против гололеда. Ею посыпают тротуары, хотя это отрицательно влияет на кожаную обувь и техническое состояние автотранспорта в виду коррозийных процессов.
Регенерация Nа-катионитовых фильтров
Nа-катионитовые фильтры широко применяются в котельных установках всех мощностей для смягчения воды при водоподготовке. Катионитовым материалом на современных водоподготовительных установках служат в основном глауконит, сульфанованные угли и синтетические смолы. Наиболее распространены сульфоугли.
Регенерацию Nа-катионитовых фильтров осуществляют 6—8%-м раствором поваренной соли, в результате действие сульфоуголя восстанавливается. Реакции идут по уравнениям:
CaR2 + 2NаСl = 2NаR + CaСl2. МgR2 + 2NаСl = 2NаR + МgСl2.
Химическая промышленность
Получение хлора и гидроксида натрия
В промышленности путём электролиза раствора хлорида натрия получают хлор. Процессы, происходящие на электродах [13] [14] :
Если между анодом и катодом нет диафрагмы, то растворенный в воде хлор начинает реагировать с гидроксидом натрия, образуя хлорид и гипохлорит натрия NaClO [14] :
2 NaOH + Cl2 → NaCl + NaClO + H2O
Поэтому для получения гидроксида натрия применяют диафрагму и соответствующий метод получения NaOH называют диафрагменным. В качестве диафрагмы применяют асбестовый картон. В процессе электролиза раствор хлорида натрия постоянно подается в анодное пространство, а из катодного пространства непрерывно вытекает раствор хлорида и гидроксида натрия. Во время выпаривания последнего хлорид кристаллизуется, поскольку его растворимость в 50 % растворе NaOH ничтожно мала (0,9 %). Полученный раствор NaOH выпаривают в железных чанах, затем сухой остаток переплавляют.
Для получения чистого гидроксида натрия (без добавок хлорида натрия) применяют ртутный метод, где используют графитовый анод и ртутный катод. Вследствие того, что перенапряжение выделения водорода на ртути очень большое, на ней вновь появляются ионы натрия и образуется амальгама натрия [14] [16] :
Амальгаму позже разлагают горячей водой с образованием гидроксида натрия и водорода, а ртуть перекачивают насосом обратно в электролизер:
Суммарная реакция процесса такая же, как и в случае диафрагменного метода.
Получение металлического натрия
Металлический натрий получают электролизом расплава хлорида натрия. Происходят следующие процессы:
Получение соляной кислоты и сульфата натрия
Среди многих промышленных методов получения соляной кислоты, то есть водного раствора хлороводорода (HCl), применяется реакция обмена между хлоридом натрия и серной кислотой:
Этот метод применяется также для получения хлороводорода в лабораторных условиях.
Физические и физико-химические свойства
Температура плавления 800,8 С, кипения 1465 С.
Смесь измельченного льда с мелким порошком хлорида натрия является эффективным охладителем. Так, смесь состава 30 г NaCl на 100 г льда охлаждается до температуры −20 ° C. Это происходит потому, что водный раствор соли замерзает при температуре ниже 0 ° C. Лед, имеющий температуру около 0 ° C, плавится в таком растворе, поглощая тепло окружающей среды.
| Термодинамические характеристики | |
|---|---|
| ΔfH 0 g | −181,42 кДж/моль |
| ΔfH 0 l | −385,92 кДж/моль |
| ΔfH 0 s | −411,12 кДж/моль |
| ΔfH 0 aq | −407 кДж/моль |
| S 0 g, 1 bar | 229,79 Дж/(моль·K) |
| S 0 l, 1 bar | 95,06 Дж/(моль·K) |
| S 0 s | 72,11 Дж/(моль·K) |
Диэлектрическая проницаемость NaCl — 6,3
Плотность и концентрация водных растворов NaCl
| Концентрация, % | Концентрация, г/л | Плотность, г/мл |
|---|---|---|
| 1 | 10,05 | 1,005 |
| 2 | 20,25 | 1,012 |
| 4 | 41,07 | 1,027 |
| 6 | 62,47 | 1,041 |
| 8 | 84,47 | 1,056 |
| 10 | 107,1 | 1,071 |
| 12 | 130,2 | 1,086 |
| 14 | 154,1 | 1,101 |
| 16 | 178,5 | 1,116 |
| 18 | 203,7 | 1,132 |
| 20 | 229,5 | 1,148 |
| 22 | 256 | 1,164 |
| 24 | 283,2 | 1,18 |
| 26 | 311,2 | 1,197 |
Лабораторное получение и химические свойства
При действии серной кислоты выделяет хлороводород. С раствором нитрата серебра образует белый осадок хлорида серебра.
Учитывая огромные природные запасы хлорида натрия, необходимости в его промышленном или лабораторном синтезе нет. Однако, его можно получить различными химическими методами как основной или побочный продукт.
Структура
В кристаллической решетке между атомами преобладает ионная химическая связь, что является следствием действия электростатического взаимодействия противоположных по заряду ионов