Как называется соли угольной кислоты
Как называется соли угольной кислоты
При растворении углекислого газа в воде образуется очень слабая угольная кислота Н2СО3. Углекислый газ в воде находится преимущественно в виде гидратированных молекул СО2 и лишь в незначительной степени в форме угольной кислоты. При этом в растворе устанавливается равновесие:
Угольная кислота – слабая неустойчивая кислота, которую в свободном состоянии из водных растворов выделить нельзя.
Тем не менее, при разложении гидрокарбоната аммония в газовой фазе обнаружены частицы Н2СО3, довольно устойчивые в отсутствии воды.
Проявляет свойства слабых кислот. Будучи двухосновной, образует два типа солей карбонаты и гидрокарбонаты.
Карбонат-ион имеет форму правильного плоского треугольника.
Три гибридные орбитали атома углерода участвуют в образовании трех связей с атомами кислорода, оставшаяся р-орбиталь углерода перекрывается с аналогичной орбиталью кислорода.
Карбонаты двухвалентных металлов трудно растворимы в воде, но их растворимость повышается в присутствии углекислого газа за счет образования гидрокарбонатов:
Карбонаты металлов (кроме щелочных металлов) при нагревании декарбоксилируются с образованием оксида:
Температура распада карбонатов повышается по мере усиления электроположительного характера металла и ионного характера связи, карбонаты щелочных металлов не разлагаются.
Гидрокарбонаты разлагаются до карбонатов:
Качественной реакцией на карбонат и гидрокарбонат ионы является их взаимодействие с сильной кислотой, наблюдается образование углекислого газа с характерным вскипанием:
Соли угольной кислоты.
Основное значение из всех солей угольной кислоты имеет сода, из которой получают различные кристаллогидраты: Na2CO3·10H2O (самый устойчив, носит название кристаллической соды), Na2CO3·7H2O, Na2CO3·H2O.
При прокаливании кристаллической соды получают безводную кальцинированную соду: Na2CO3.
Также используют питьевую соду – NaHCO3, которая легко распадается:
Соду на производстве получают методом Сольвэ, который состоит из нескольких этапов:
1. Делают концентрированный раствор поваренной соли и насыщают его аммиаком при охлаждении.
2. Прохождение CO2 через раствор при давлении:
Питьевая сода не растворяется в холодном насыщенном растворе, и поэтому ее отфильтровывают. При прокаливании получают кальцинированную соду, а углекислый газ, который при этом выделяется, используют в производстве:
В данном методе получения соды только один побочный продукт – хлорид натрия.
Одним из важных соединений угольной кислоты является поташ. Его нельзя получить по методу Сольве, в связи с малой растворимостью гидрокарбоната NaHCO3 в насыщенном растворе, а гидрокарбонат калия (KHCO3) имеет хорошую растворимость в таких растворах:
И реакция будет полностью обратимой, поэтому проводят следующую реакцию:
Как называется соли угольной кислоты
Угольная кислота и её соли. Значение и применение карбонатов. Переход карбонатов в гидрокарбонаты и обратно. Распознавание карбонат-иона.
Угольная кислота и её соли
Угольная кислота слабая, существует только в водном растворе: CO2 + H2O « H2CO3
Характерны все свойства кислот.
Угольная кислота образует соли двух типов:
CaCO 3 карбонат кальция (мел, мрамор, известняк)
Физические свойства карбонатов:
Все карбонаты – твёрдые кристаллические вещества. Большинство из них в воде не растворяются. Гидрокарбонаты растворяются в воде.
Химические свойства солей угольной кислоты:
Общие свойства солей:
1) Вступают в реакции обмена с другими растворимыми солями
2) Разложение гидрокарбонатов при нагревании
3) Разложение нерастворимых карбонатов при нагревании
4) Карбонаты и гидрокарбонаты могут превращаться друг в друга:
Специфические свойства солей угольной кислоты:
Качественная реакция на CO 3 2- карбонат – ион «вскипание» при действии сильной кислоты:
1. Осуществите превращения
Вычислите объём углекислого газа, который выделится при обжиге карбоната кальция массой 150 г (н.у.)
Как называется соли угольной кислоты
Урок посвящен изучению свойств и способов получения некоторых неорганических соединений углерода. В нем рассмотрены такие вещества, как оксид углерода (II) (или угарный газ), оксид углерода (IV) (или углекислый газ), угольная кислота, а также карбонаты и гидрокарбонаты.
I. Оксид углерода(II) – СО (угарный газ, окись углерода, монооксид углерода)
Физические свойства:
Бесцветный ядовитый газ без вкуса и запаха, горит голубоватым пламенем, легче воздуха, плохо растворим в воде. Концентрация угарного газа в воздухе 12,5—74 % взрывоопасна.
Строение молекулы:
Формальная степень окисления углерода +2 не отражает строение молекулы СО, в которой помимо двойной связи, образованной обобществлением электронов С и О, имеется дополнительная, образованная по донорно-акцепторному механизму за счет неподеленной пары электронов кислорода (изображена стрелкой):
Получение:
Основным антропогенным источником угарного газа CO в настоящее время служат выхлопные газы двигателей внутреннего сгорания. Угарный газ образуется при сгорании топлива в двигателях внутреннего сгорания при недостаточных температурах или плохой настройке системы подачи воздуха (подается недостаточное количество кислорода для окисления угарного газа CO в углекислый газ CO2). В естественных условиях, на поверхности Земли, угарный газ CO образуется при неполном анаэробном разложении органических соединений и при сгорании биомассы, в основном в ходе лесных и степных пожаров.
1) В промышленности (в газогенераторах):
CO2 + C = 2CO – 175 кДж
В газогенераторах иногда через раскалённый уголь продувают водяной пар:
смесь СО + Н2 – называется синтез – газом.
Химические свойства:
При обычных условиях CO инертен; при нагревании – восстановитель;
1) Взаимодействие с кислородом: 2C +2 O + O2 t ˚ C → 2C +4 O2↑
2) Взаимодействие с оксидами металлов: CO + MexOy = CO2 + Me
C +2 O + CuO t ˚ C → Сu + C +4 O2↑
3) Взаимодействие с хлором (на свету)
CO + Cl2 свет → COCl2 (фосген – ядовитый газ)
4)* Взаимодействие с расплавами щелочей (под давлением)
CO + NaOH P → HCOONa (формиат натрия)
Влияние угарного газа на живые организмы:
Угарный газ опасен, потому что он лишает возможности кровь нести кислород к жизненно важным органам, таким как сердце и мозг. Угарный газ объединяется с гемоглобином, который переносит кислород к клеткам организма, в следствии чего тот становится непригодным для транспортировки кислорода. В зависимости от вдыхаемого количества, угарный газ ухудшает координацию, обостряет сердечно-сосудистые заболевания и вызывает усталость, головную боль, слабость, Влияние угарного газа на здоровье человека зависит от его концентрации и времени воздействия на организм. Концентрация угарного газа в воздухе более 0,1% приводит к смерти в течение одного часа, а концентрация более 1,2% в течении трех минут.
Применение оксида углерода:
Главным образом угарный газ применяют, как горючий газ в смеси с азотом, так называемый генераторный или воздушный газ, или же в смеси с водородом водяной газ. В металлургии для восстановления металлов из их руд. Для получения металлов высокой чистоты при разложении карбонилов.
II. Оксид углерода (IV) СO2 – углекислый газ
Учебный видео-фильм: “Углекислый газ”
Физические свойства:
Благодаря тому, что оксид углерода (IV) не поддерживает горения, им заполняют огнетушители.
Строение молекулы:
Все четыре связи ковалентые полярные.
Получение:
1. Термическим разложением солей угольной кислоты (карбонатов). Обжиг известняка – в промышленности:
2. Действием сильных кислот на карбонаты и гидрокарбонаты –
Способы собирания: вытеснением воздуха
3. Сгорание углеродсодержащих веществ:
4. При медленном окислении в биохимических процессах (дыхание, гниение, брожение)
Химические свойства:
1) С водой даёт непрочную угольную кислоту:
2)Рреагирует с основными оксидами и основаниями, образуя соли угольной кислоты:
Качественная реакция на углекислый газ:
Помутнение известковой воды Ca(OH)2 за счёт образования белого осадка – нерастворимой соли CaCO3:
III. Угольная кислота и её соли
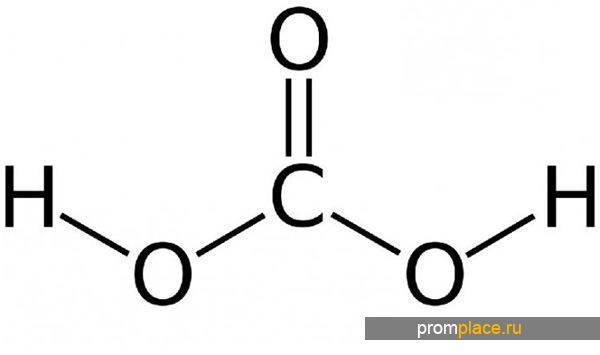
Химическая формула — H2CO3
Структурная формула – все связи ковалентные полярные:
Кислота слабая, существует только в водном растворе, очень непрочная, разлагается на углекислый газ и воду:
Химические свойства:
Для угольной кислоты характерны все свойства кислот.
2) с активными металлами
3) с основными оксидами
5) Очень непрочная кислота – разлагается
Соли угольной кислоты – карбонаты и гидрокарбонаты
Угольная кислота образует два ряда солей:
В природе встречаются:
CaCO3
Мел Мрамор Известняк
NaHCO3 – питьевая сода
Na2CO3 – сода, кальцинированная сода
Na2CO3 x 10H2O – кристаллическая сода
Физические свойства:
Все карбонаты – твёрдые кристаллические вещества. Большинство из них в воде не растворяются. Гидрокарбонаты растворяются в воде.
Химические свойства солей угольной кислоты:
Общие свойства солей:
1) Вступают в реакции обмена с другими растворимыми солями
2) Разложение гидрокарбонатов при нагревании
3) Разложение нерастворимых карбонатов при нагревании
4) Карбонаты и гидрокарбонаты могут превращаться друг в друга:
Специфические свойства:
1) Качественная реакция на CO 3 2- карбонат – ион «вскипание» при действии сильной кислоты:
IV. Задания для закрепления
Задание №1. Закончите уравнения реакций, составьте электронный баланс для каждой из реакций, укажите процессы окисления и восстановления; окислитель и восстановитель:
Задание №2. Вычислите количество энергии, которое необходимо для получения 448 л угарного газа согласно термохимическому уравнению
CO2 + C = 2CO – 175 кДж
Задание №3. Закончите уравнения осуществимых химических реакций:
Угольная кислота появляется в результате разложения углекислого газа в водной среде. Этим веществом искусственно насыщают минеральные воды. Формула угольной кислоты Н2СО3. Поэтому при открытии бутылки с газированной водой, можно увидеть активные пузырьки. Основное получение угольной кислоты происходит в воде.
Уравнение
СО2 (г) + Н2О СО2 • Н2О (раствор) Н2СО3 Н+ + HCO3- 2H+ + CO32-.
Сама по себе угольная кислота представляет слабое непрочное соединение, которое невозможно выделить в свободном состоянии из воды.
Структурная формула
Но стоит отметить тот факт, что во время разложения гидрокарбоната аммония, формируются устойчивые соединения угольной кислоты. Такие крепкие химические связи образуются только в период, когда гидрокарбонат аммония вступает в газовую фазу реакции.
Вещество является интересным объектом для изучения. Его изучают австралийские ученые уже более 6 лет. В безводном состоянии эта кислота напоминает прозрачные кристаллы, которые имеют высокую стойкость к низким температурам, но при нагревании кристаллы угольной кислоты начинают разлагаться.
Особенности солей угольной кислоты
Эта кислота считается двухосновной, поэтому может создавать соли двух видов:
Соли угольной кислоты помогли человечеству в строительстве, медицине и даже кулинарии. Потому что они встречаются в составе:
Гидрокарбонаты и карбонаты кислоты могут вступать в реакции с кислотами, во время этих реакции возможно выделение углекислого газа. Также эти вещества могут быть взаимозаменяемыми, они способны разлагаться под воздействием температуры.
Реакции угольной кислоты:
2NaHCO3 → Na2CO3 +H2O +CO2
Na2CO3 + H2O + CO2 →2NaHCO3
Химические свойства
Данная кислота по своей структуре способна входить в реакции со многими веществами.
Свойства угольной кислоты раскрываются в реакциях:
Na2O + CO2 → Na2CO3
2NaOH + CO2 → Na2CO3 + H2O
NaOH + CO2 → NaHCO3
Угольная кислота представляет собой слабый электролит, так как слабая летучая кислота не может выступать в роли мощного электролита в отличие от, например, соляной кислоты. Этот факт можно увидеть в результате добавление лакмуса в раствор угольной кислоты. Изменение цвета будет незначительным. Поэтому можно утверждать, что угольная кислота может поддерживать 1 уровень диссоциации.
Применение
Данное вещество можно увидеть в составе газированных вод. Но соли угольной кислоты широко применяют:
Отечественный и мировой рынок предлагает в продаже различные препараты и химические вещества, в состав которых входит угольная кислота:
Карбамид используют в качестве удобрения для плодовых и декоративных растений. Его средняя цена составляет 30-40 рублей за 1 кг. Фасуют готовую продукцию в полиэтиленовые пакеты и мешки, весом 1, 5,25,50 кг.
Литиевую соль угольной кислоты используют в составе керамических изделий, ситаллов. Этот материал используется для производства камер сгорания для реактивных двигателей, его добавляют в глазури, эмали, грунтовки для различных металлов. Литиевую соль добавляют в грунтовки для обработки алюминия, чугуна и стали.
Это химическое вещество добавляют в процессе стекловарения. Стекла, в состав которых была добавлена литиевая соль, имеют повышенную проницаемость светлового потока. Иногда литиевую соль угольной кислоты используют в процессе производства пиротехники.
Производители
Средняя цена 1 кг такого вещества в России составляет 3900-4000 рублей. Главным заводом-изготовителем этого вещества считается московский завод ООО Компонент-Реактив. Также литиевую соль угольной кислоты производят в компаниях: ООО КурскХимПром, ООО ВитаХим, ООО Русхим, ЗАО Химпэк.
Мел производится для технических и кормовых целей. Средняя цена кормового мела составляет 1800 рублей за 1 тонну. Фасуется в основном по 50 кг, 32 кг. Производители: ООО Меловик, ООО МТ Ресурс, ООО Зооветснаб, ООО Агрохиминвест.
Кальцинированная сода применяется для стирки, удаления пятен и отбеливания. Средняя цена на этот продукт на розничном рынке варьируется в пределах 16-30 рублей за 1 кг. Производители: ООО Новэра, ЗАО ХимРеактив, ООО ХимПлюс, ООО СпецБурТехнологии, ООО СпецКомплект и др.