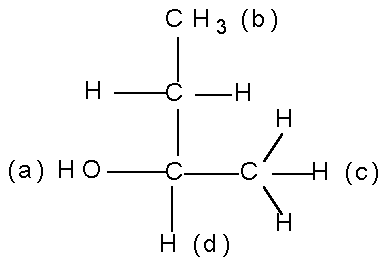
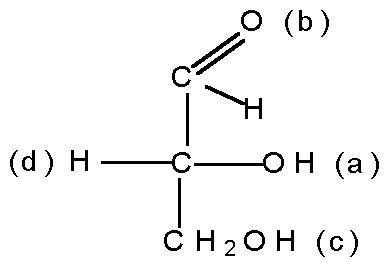
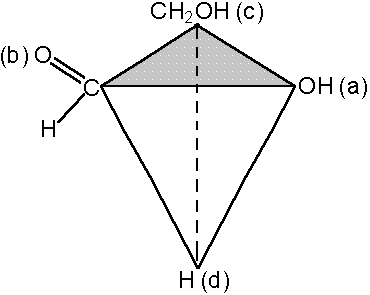
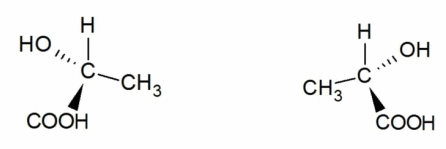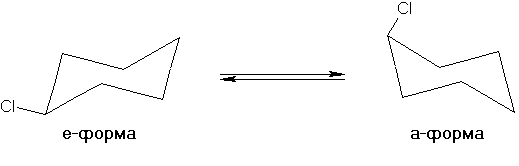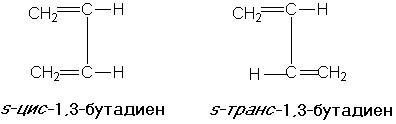Как называется реакция получения изомеров
Изомерия в органической химии
Изомеры – это вещества, имеющие одинаковый состав (число атомов каждого типа), но разное взаимное расположение атомов – разное строение.
Изомерия – это явление существования веществ с одинаковым составом, но различным строением.
Например, формуле C4H10 соответствуют два изомерных соединения н-бутан с линейным углеродным скелетом и изобутан (2-метилбутан) с разветвленным скелетом:

При этом температура кипения н-бутана –0,5 о С, а изобутана –11,4 о С.
Виды изомерии
Структурные изомеры отличаются друг от друга взаимным расположением атомов в молекуле; стереоизомеры — расположением атомов в пространстве.
Структурная изомерия
Структурные изомеры – соединения с одинаковым составом, но различным порядком связывания атомов, т.е. с различным химическим строением. Молекулярная формула у структурных изомеров одинаковая, а структурная различается.
1. Изомерия углеродного скелета: вещества различаются строением углеродной цепи, которая может быть линейная или разветвленная.
Например, молекулярной формуле С5Н12 соответствуют три изомера:

2. Изомерия положения обусловлена различным положением кратной связи, функциональной группы или заместителя при одинаковом углеродном скелете молекул.

2.2. Изомерия положения кратной связи может быть вызвана различным положением кратной (двойной или тройной) связи в непредельных соединениях. Например, в бутене-1 и бутене-2:

2.3. Межклассовая изомерия – ещё один вид структурной изомерии, когда вещества из разных классов веществ имеют одинаковую общую формулу.
Например, формуле С2Н6О соответствуют: спирт (этанол) и простой эфир (диметиловый эфир):


Пространственная изомерия
Пространственные изомеры – это вещества с одинаковым составом и химическим строением, но с разным пространственным расположением атомов в молекуле. Виды пространственной изомерии – геометрическая (цис—транс) и оптическая изомерия.
1. Геометрическая изомерия (или цис-транс-изомерия).
Геометрическая изомерия характерна для соединений, в которых различается положение заместителей относительно плоскости двойной связи или цикла. Например, для алкенов и циклоалканов.
Двойная связь не имеет свободного вращения вокруг своей оси.
Поэтому заместители у атомов углерода при двойной связи могут быть расположены либо по одну сторону от плоскости двойной связи (цис-изомер), либо по разные стороны от плоскости двойной связи (транс-изомер). При этом никаким вращением нельзя получить из цис-изомера транс-изомер, и наоборот.
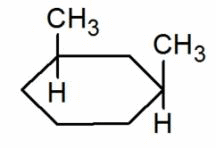
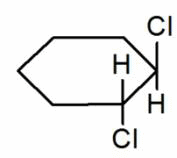
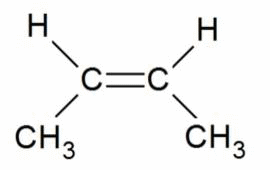
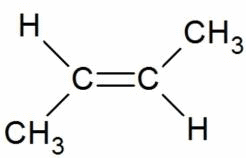
Например, бутен-2 существует в виде цис— и транс-изомеров

1,2-Диметилпропан также образует цис-транс-изомеры:

Геометрические изомеры различаются по физическим свойствам (температура кипения и плавления, растворимость, дипольный момент и др.). Например, температура кипения цис-бутена-2 составляет 3,73 о С, а транс-бутена-2 0,88 о С.
При этом цис—транс-изомерия характерна для соединений, в которых каждый атом углерода при двойной связи С=С (или в цикле) имеет два различных заместителя.
Таким образом, для соединений вида СH2=СHR и СR2=СHR’ цис—транс-изомерия не характерна.
2. Оптическая изомерия
Оптические изомеры – это пространственные изомеры, молекулы которых соотносятся между собой как предмет и несовместимое с ним зеркальное изображение.
Оптическая изомерия свойственна молекулам веществ, имеющих асимметрический атом углерода.
Асимметрический атом углерода — это атом углерода, связанный с четырьмя различными заместителями.

Такие молекулы обладают оптической активностью — способностью к вращению плоскости поляризации света при прохождении поляризованного луча через раствор вещества.
Например, оптические изомеры образует 3-метилгексан:
Как называется реакция получения изомеров
До появления теории химического строения А. М. Бутлерова оставалось неизвестным существование веществ, которые имеют один и тот же состав и одну и ту же молекулярную массу, но различающиеся расположением атомов. Эти вещества обладали разными свойствами. Способность атомов углерода к образованию четырёх ковалентных связей, в том числе и с другими атомами углерода, открывает возможность существования нескольких соединений одного элементного состава. Такое явление было названо изомерией.
Для пентана существует три изомера:
Температуры кипения бутана и пентана отличаются между собой, что служит доказательством того, что свойства соединений находятся в зависимости от строения их молекул.
это вещества, которые имеют одинаковую молекулярную формулу, но различное химическое строение (различные структурные формулы), а, следовательно, обладают различными свойствами.
В органической химии существует несколько типов изомерии. Самым простым является структурная изомерия.
называют изомеры, отвечающие различным структурным формулам органических соединений (с разным порядком соединений атомов).
В этом случае изомеры отличаются друг от друга только порядком связи между атомами в молекуле. Структурная изомерия имеет несколько разновидностей.
Изомерия углеродного скелета зависит от порядка соединения между собой атомов углерода в цепи (см. изомеры бутана и пентана).
Для правильного составления изомеров углеродного скелета необходимо соблюдать некоторые правила:
1. Записать углеродный скелет согласно числу атомов углерода.
2. Отрывают крайние атомы углерода (`»C»_1` или `»C»_5`) и располагают их у оставшихся в цепи атомов углерода, добиваясь максимально возможного числа перестановок. В результате чего первоначально записанный углеродный скелет укорачивается и принимает разветвлённое строение:
Следует иметь в виду, что произвольное укорачивание углеродной цепи исходного углеводорода не приводит к появлению нового изомера, а зачастую представляют собой одно и то же соединения.
3. Соблюдая условие четырёхвалентности атомов углерода, необходимо заполнить оставшиеся валентности атомами водорода
(*н – означает углеводород нормального (неразветвленного) строения).
Другой разновидностью структурной изомерии является
Например, положения кратной связи:
| `»CH»_2=»CH»-«CH»_2-«CH»=»CH»_2` | `»CH»_2=»CH»-«CH»=»CH»-«CH»_3` |
| пентадиен-1,4 | пентадиен-1,3 |
Или изомерия положения функциональной группы:
Если гидроксильных групп две, то число изомеров может также определяться взаимным расположением этих групп:
| `»HOCH»_2-«CH»_2-«CH»_2″OH»` | `»HOCH»_2-«CH»(«OH»)-«CH»_3` |
| пропандиол-1,3 | пропандиол-1,2 |
Ещё одним видом изомерия является
| `»CH»_3-«CH»_2-«OH»` | `»CH»_3-«O»-«CH»_3` |
Другим примером межклассовой изомерии являются карбоновые кислоты и сложные эфиры, например:
| `»CH»_3-«CH»_2″COOH»` | `»CH»_3-«COOCH»_3` | `»HCOOC»_2″H»_5` |
| Пропановая кислота | Метилацетат | Этилформиат |
Виды пространственной изомерии
называют соединения, имеющий одинаковый состав и одинаковый порядок соединения атомов, но отличающиеся расположением атомов в пространстве.
Геометрическая изомерия характерна для соединений, содержащих двойную связь или цикл. В таких молекулах часто возможно провести условную плоскость таким образом, что заместители у различных атомов углерода могут оказаться по одну сторону (цис-) или по разные стороны (транс-) от этой плоскости. Если изменение ориентации этих заместителей относительно плоскости возможно только за счёт разрыва одной из химических связей, то говорят о наличии геометрических изомеров.
Энантиомеры имеют одинаковые температуры плавления и кипения, растворимость, показатель преломления и другие характеристики. Их отличия проявляются только при изучении вращения веществом плоскости поляризации света или при взаимодействии с другим хиральным соединением. Способность вращать плоскость поляризации света называется оптической активностью. Смесь равных количеств энантиомеров называется рацематом.
Изомер
Содержание
Исторические сведения
В итоге полемики Ю. Либиха и Ф. Вёлера было установлено (1823), что существуют два резко различных по свойствам вещества состава AgCNO — циановокислое (AgNCO) и гремучее (AgONC) серебро. Ещё одним примером послужили винная и виноградная кислоты, после исследования которых Й. Берцелиус в 1830 ввел термин ИЗОМЕРИЯ и высказал предположение, что различия возникают из-за «различного распределения простых атомов в сложном атоме» (т. е. молекуле). Подлинное объяснение изомерия получила лишь во 2-й половине XIX в. на основе теории химического строения А. М. Бутлерова (структурная изомерия) и стереохимического учения Я. Г. Вант-Гоффа (пространственная изомерия).
Структурная изомерия
Структурная изомерия — результат различий в химическом строении. К этому типу относят:
Изомерия углеводородной цепи (углеродного скелета)
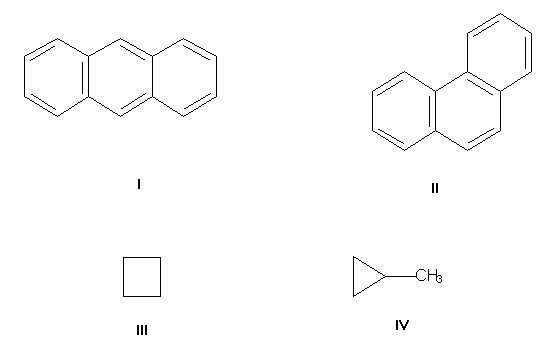
Изомерия углеродного скелета, обусловленная различным порядком связи атомов углерода. Простейший пример — бутан СН3-СН2-СН2-СН3 и изобутан (СН3)3СН. Др. примеры: антрацен и фенантрен (формулы I и II соответственно), циклобутан и метилциклопропан (III и IV).
Валентная изомерия
Валентная изомерия (особый вид структурной изомерии), при которой изомеры можно перевести друг в друга лишь за счет перераспределения связей. Например, валентными изомерами бензола (V) являются бицикло[2.2.0]гекса-2,5-диен(VI, «бензол Дьюара»), призман (VII, «бензол Ладенбурга»), бензвален (VIII).
Изомерия функциональной группы
Различается характером функциональной группы. Пример: Этанол (CH3-CH2-OH) и Диметиловый эфир (CH3-O-CH3)
Изомерия положения
Тип структурной изомерии, характеризующийся различием положения одинаковых функциональных групп или двойных связей при одинаковом углеродном скелете. Пример: 2-хлорбутановая кислота и 4-хлорбутановая кислота.
Пространственная изомерия (стереоизомерия)
Энантиомерия (оптическая изомерия)
Пространственная изомерия (стереоизомерия) возникает в результате различий в пространственной конфигурации молекул, имеющих одинаковое химическое строение. Этот тип изомеров подразделяют на энантиомерию (оптическую изомерию) и диастереомерию.
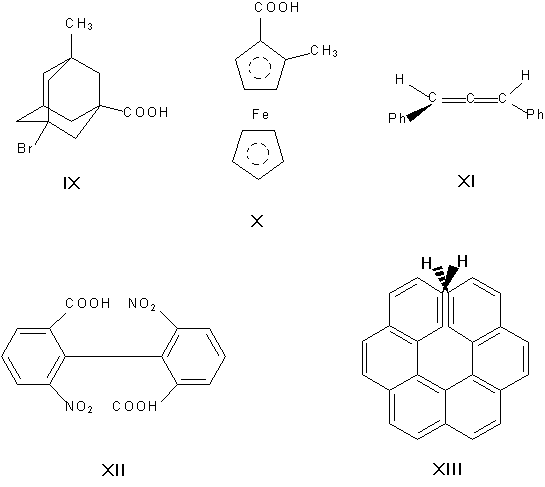
Асимметрическими могут быть и др. атомы, например атомы кремния, азота, фосфора, серы. Наличие асимметрического атома не единственная причина энантиомерии. Так, имеют оптические антиподы производные адамантана (IX), ферроцена (X), 1,3-дифенилаллен (XI), 6,6′-динитро-2,2′-дифеновая кислота (XII). Причина оптическое активности последнего соединения — атропоизомерия, то есть пространственная изомерия, вызванная отсутствием вращения вокруг простой связи. Энантиомерия также проявляется в спиральных конформациях белков, нуклеиновых кислот, гексагелицене (XIII).
(R)-, (S)- номенклатура оптических изомеров (правило наименования)
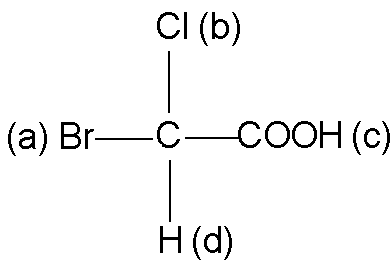
Четырём группам, присоединенным к ассиметрическому атому углерода Cabcd, приписывается различное старшинство, отвечающее последовательности: a>b>c>d. В простейшем случае старшинство устанавливается по порядковому номеру атома, присоединенного к ассиметрическому атому углерода: Br(35), Cl(17), S(16), O(8), N(7), C(6), H(1).
Например, в бромхлоруксусной кислоте:
Старшинство заместителей при ассиметрическом атоме углерода следующее: Br(a), Cl(b), C группы COOH (c), H(d).
У бутанола-2 кислород является старшим заместителем (а), водород — младшим (d):
Требуется решить вопрос о заместителях CH3 и CH2CH3. В этом случае старшинство определяется порядковым номером или номерами других атомов в группе. Первенство остается за этильной группой, так как в ней первый атом С связан с другим атомом С(6) и с другими атомами Н(1), тогда как в метильной группе углерод соединен с тремя атомами Н с порядковым номером 1. В более сложных случаях продлжают сравнивать все атомы, пока не доходят до атомов с различными порядковыми номерами. Если имеются двойная или тройная связи, то находящиеся при них атомы считаются соответственно за два и за три атома. Так, группу —COH рассматривают как С (O, O, H), а группу —COOH — как С(О, О, ОН); карбоксильная группа старше альдегидной, поскольку содержит три атома с порядковым номером 8.
В D-глицериновом альдегиде старшей является группа ОН(а), затем следует CHO(b), CH2OH(c) и Н(d):
Следующий этап заключается в определении, является ли расположение групп правым, R (лат. rectus), или левым, S (лат. sinister). Переходя к соответствующей модели, её ориентируют так, чтобы младшая группа (d) в перспективной формуле оказалась внизу, и затем рассматривают сверху вдоль оси, проходящей через заштрихованную грань тетраэдра и группу (d). В D-глицириновом альдегиде группы
расположены в направлении правого вращения, и следовательно, он имеет R-конфигурацию:
В отличие от D,L номенклатуры обозначения (R)- и (S)- изомеров заключают в скобки.
Диастереомерия
σ—диастереомерия
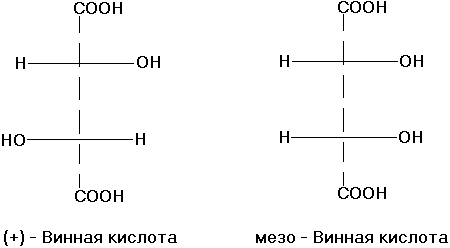
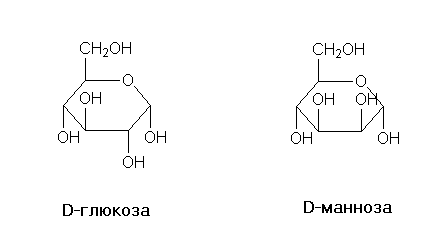
Диастереомерными считают любые комбинации пространственных изомеров, не составляющие пару оптических антиподов. Различают σ и π-диастереомеры. σ-диастериомеры отличаются друг от друга конфигурацией части имеющихся в них элементов хиральности. Так, диастериомеры являются (+)-винная кислота и мезо-винная кислота, D-глюкоза и D-манноза, например:
Для некоторых типов диастереомерия введены специальные обозначения, например трео- и эритро-изомеры — это диастереомерия с двумя асимметрическим атомами углерода и пространств, расположением заместителей у этих атомов, напоминающим соотвующую треозу (родственные заместители находятся по разные стороны в проекционных формулах Фишера) и эритрозу (заместители — по одну сторону):
Эритро-изомеры, которых асимметрические атомы связаны с одинаковыми заместителями, называются мезо-формами. Они, в отличие от остальных σ-диастереомеров, оптически неактивны из-за внутримолекулярной компенсации вкладов во вращение плоскости поляризации света двух одинаковых асимметрических центров противоположной конфигурации. Пары диастереомеров, различающиеся конфигурацией одного из нескольких асимметрических атомов, называются эпимерами, например:
Термин «аномеры» обозначает пару диастереомерных моносахаридов, различающихся конфигурацией гликозидного атома в циклической форме, например аномерны α-D- и β-D-глюкозы.
π—диастереомерия (геометрическая изомерия)
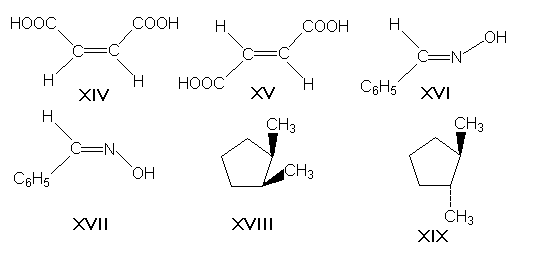
π-диастериомерами, называемые также геометрическими изомерами, отличаются друг от друга различным пространственным расположением заместителей относительно плоскости двойной связи (чаще всего С=С и С=N) или цикла. К ним относятся, например, малеиновая и фумаровая кислоты (формулы XIV и XV соответственно), (Е)- и (Z)-бензальдоксимы (XVI и XVII), цис- и транс-1,2-диметилциклопентаны (XVIII и XIX).
Конформеры. Таутомеры
Явление неразрывно связано с температурными условиями его наблюдения. Так, например, хлорциклогексан при комнатной температуре существует в виде равновесной смеси двух конформеров — с экваториальной и аксиальной ориентацией атома хлора:
Однако при минус 150 °С можно выделить индивидуальную а-форму, которая ведет себя в этих условиях как устойчивый изомер.
С др. стороны, соединения, в обычных условиях являющиеся изомерами, при повышении температуры могут оказаться находящимися в равновесии таутомерами. Например, 1-бромпропан и 2-бромпропан — структурные изомеры, однако при повышении температуры до 250 °С между ними устанавливается равновесие, характерное для таутомеров.
Изомеры, превращающиеся друг в друга при температуре ниже комнатной, можно рассматривать как нежесткие молекулы.
Существование конформеров иногда обозначают термином «поворотная изомерия». Среди диенов различают s-цис- и s-транс — изомеры, которые, по существу, являются конформерами, возникающими в результате вращения вокруг простой (s-single) связи:
Изомерия также характерна для координационных соединений. Так, изомерны соединения, различающиеся по способу координации лигандов (ионизационная изомерия), например, изомерны:
Здесь, по существу, имеется аналогия со структурной изомерии органических соединений.
Процесс взаимопревращения энантиомеров называется рацемизацией: она приводит к исчезновению оптической активности в результате образования эквимолярной смеси (—)- и (+)-форм, то есть рацемата. Взаимопревращение диастереомеров приводит к образованию смеси, в которой преобладает термодинамически более устойчивая форма. В случае π-диастереомеров — обычно транс-форма. Взаимопревращение конформационных изомеров называется конформационным равновесием.
Явление изомерии в огромной степени способствует росту числа известных (и ещё в большей степени числа потенциально возможных) соединений. Так, возможное число структурно-изомерных дециловых спиртов более 500 (известно из них около 70), пространств, изомеров здесь более 1500.
При теоретическом рассмотрении проблем изомерии все большее распространение получают топологические методы; для подсчёта числа изомеров выведены математические формулы. Для обозначения пространств, изомеров разных типов разработана номенклатура стереохимическая, собранная в разделе Е Номенклатурных правил ИЮПАК по химии.
Виды изомерии в органической химии
Изомерия в химии — что это за явление
В современной естественной науке важно обращать внимание на такое явление как изомерия. Без понимания свойств веществ-изомеров почти невозможно изучать законы и закономерности химии.
Впервые на явление изомерии обратили внимание двое ученых в 1823 году. Ю. Либих и Ф. Велер поспорили из-за различий в свойствах фульмината серебра (AgCNO). Ученые заметили, что у циановокислого и гремучего серебра одна и та же формула.
Подробнее явление изучил Й. Берцелиус. Исследовав винную и виноградные кислоты (у обеих формула C 4 H 6 O 6 ) он в 1830 году ввел термин «изомерия». Его предположение заключалось в следующем: вещества с одинаковым составом могут различаться из-за разного распределения атомов в молекуле.
Наконец, во второй половине XIX века Я. Вант-Гофф открыл пространственную изомерию, а А. Бутлеров — структурную изомерию. Так сформировалась современная теория изомерии.
Определение понятия
Изомерия — явление, суть которого заключается в существовании химических соединений, которые одинаковы по качественному и количественному составу, но различаются по строению или расположению атомов в пространстве. Вследствие этого они обладают разными физическими и химическими свойствами.
Из данного определения следует определение веществ-изомеров.
Изомеры — это химические соединения с одинаковым составом, но разные по строению или пространственному расположению атомов и свойствам.
Как правило, большое количество изомеров характерно для представителей широко известного класса аминокислот. За счет различных заместителей при α-углеродном атоме им также свойственна и оптическая изомерия, которая будет рассмотрена далее.
Виды изомерии в органической химии
В классификации изомерии выделяют два основных типа изомеров:
Структурная изомерия
Структурные изомеры — вещества, которые одинаковы по качественному и количественному составу, но различающиеся строением, т. е. порядком расположения атомов. Структурные изомеры имеют одинаковые молекулярные, но разные структурные формулы.
Выделяют несколько видов изомерии по структуре молекулы.
1. Изомерия углеродной цепи.
Углеродная цепь или углеродный скелет представляет собой остов молекулы, состоящий из углеродных атомов. Если порядок соединения атомов углерода в молекуле отличается, то вещества являются структурными изомерами по углеродной цепи.
2. Валентная изомерия.
Валентные изомеры различаются распределением химических связей внутри молекулы. К примеру, для бензола ( C 6 H 6 ), помимо стандартной молекулы в форме плоского шестиугольника, известно еще три валентных изомера. Они представлены на изображении ниже.
3. Изомерия положения функциональной группы.
В молекулах органических соединений, не относящихся к классу углеводородов, можно выделить две составляющие части: углеводородный фрагмент (радикал) и функциональная группа.
4. Межклассовая изомерия.
Межклассовые изомеры — вещества, имеющие одинаковый количественный и качественный состав, но относящиеся к различным классам органических соединений. Поскольку молекулы таких изомеров содержат различные функциональные группы, такой вид изомерии также называют изомерией функциональной группы.
5. Изомерия положения кратной связи
Подобно изомерии положения функциональной группы, изомеры данного вида отличаются расположением элемента в углеродной цепи. В данном случае такой элемент — кратная связь. Рассмотрим изомеры бутена по положению двойной связи:
СН–СН–СН=СН — это бутен-1
СН–СН=СН–СН — это бутен-2
Пространственная изомерия (стереоизомерия)
Структурные формулы пространственных изомеров могут быть одинаковыми, но молекулы при этом будут отличаться расположением атомов в пространстве, т.е. будут иметь различные пространственные формулы. Химики выделяют два вида пространственной изомерии:
Рассмотрим подробнее каждый из типов.
1. Оптическая изомерия (энантиомерия).
Оптическую изомерию также называют зеркальной. Оптические изомеры (энантиомеры) — это молекулы, которые являются зеркальными отражениями друг друга. Такой вид изомерии возникает, когда у одного атома углерода появляется четыре разных заместителя. Эти атомы углерода называются ассиметрическими, или хиральными (от греч. хиро — рука, поскольку наши руки также являются зеркальными отражениями друг друга). Таким образом оптические изомеры различаются порядком расположения заместителей вокруг асимметричного центра. На практике такие изомеры различаются по направлению вращения плоскости поляризации плоскополяризованного света. Один из оптических антиподов является правовращающим (вращает плоскость поляризации вправо, его обозначают знаком «+»), а другой — левовращающим (вращает плоскость поляризации влево, обозначают знаком «−»).
Оптическая изомерия характерна для многих классов природных органических соединений (углеводов, аминокислот). Например, на рисунке представлены оптические изомеры аминокислоты аланина:
2. Геометрическая изомерия.
Геометрическая изомерия также называется цис,транс-изомерией, показывает разное положение заместителей относительно цикла или двойной связи.
Когда заместители находятся по одну сторону двойной связи (плоскости цикла), то вещество называют цис-изомером. Если заместители расположены по разные стороны, то речь идет о транс-изомерах. Пример — это цис-бутен-2 и транс-бутен-2.
На изображении ниже транс-бутен-2 представлен слева, а цис-бутен-2 — справа.
У одного и того же вещества могут быть разные типы изомеров. Так, многим представителем класса алкенов свойственны межклассовая, геометрическая и изомерия углеродного скелета. Среди альдегидов встречается структурная изомерия — углеродного скелета и межклассовая. Для циклоалканов характерна межклассовая изомерия, цис-, транс-изомерия и др.