Как называется процесс окисления жиров
Окисление жиров
Окисление жиров атмосферным кислородом в той или иной степени происходит уже при их получении и переработке. При хранении в неблагоприятных условиях жиры приобретают неприятные вкус и запах и часто оказываются непригодными для пищевых целей. Этот процесс называется прогорканием и происходит в результате окисления жиров кислородом воздуха, а также биохимическим путем.
Глубина окислительных процессов и скорость окисления находятся в прямой зависимости от количества входящих в жиры глицеридов полиненасыщенных жирных кислот и степени их ненасыщенности. Преимущественно окисляется группа —СН2-, соседняя с двойной связью (а-положение), а с наибольшей скоростью — расположенная между двумя двойными связями. В результате воздействия кислорода воздуха на жиры происходит накопление различных продуктов распада, ухудшающих органолептические и реологические свойства. Жиры, в которых начались окислительные процессы, имеют пониженную стойкость при дальнейшем хранении. Совершенно неокисленные жиры трудно поддаются воздействию молекулярного кислорода. Скорость окисления зависит также от интенсивности соприкосновения жира с воздухом и от температуры. Механизм реакций окисления органических веществ, в том числе и жиров, объясняют перекисная теория Баха-Энглера и теория цепных реакций Н. Н. Семенова.
Согласно перекисной теории, первоначальными продуктами окисления жиров являются неустойчивые перекисные соединения различных типов, способные при распаде образовывать ряд более стабильных продуктов окисления.
При окислении насыщенных жирных кислот образуются насыщенные гидропероксиды, а при окислении ненасыщенных жирных кислот — ненасыщенные гидропероксиды. В этом случае окисление происходит не вследствие присоединения кислорода к двойной связи кислоты, а в результате отрыва водорода от метиленовой группы, расположенной по соседству с двойной связью. При окислении линолевой кислоты могут образовываться гидропероксиды с двумя сопряженными двойными связями. Образование циклических пероксидов происходит в результате присоединения кислорода по месту двойной связи кислоты.
Перекисные соединения неустойчивы. Они разлагаются под влиянием различных агентов с образованием вторичных, более устойчивых соединений — гидроксикислот, эпокисей, адьдегидов, кетонов, сополимерных и других веществ. Например, при термическом распаде гидроперекисей в присутствии непредельных кислот в числе других продуктов образуются гидроксикислоты и эпокиси. Гидропероксиды, гидроксикислоты и эпокиси кислот не имеют вкуса и запаха. Носителями неприятного вкуса и запаха окисленных жиров (прогорклых) являются кетоны, альдегиды и низкомолекулярные кислоты, образующиеся на последующих стадиях окисления жира.
В настоящее время большое распространение получила разработанная академиком Н. Н. Семеновым цепная теория окисления жиров, дающая объяснение механизму этого процесса. По этой теории окисление связано с цепным развитием реакции через свободные радикалы, имеющие свободные валентности и обладающие повышенной реакционной способностью. Радикалы эти постоянно переходят в устойчивое валентно-насыщенное состояние. При этом они сами расходуются на образование новых веществ и других свободных радикалов и атомов. Последние взаимодействуют в таком же порядке. Таким образом, этот процесс обусловливает протекание цепной реакции. Пероксиды являются первичными продуктами окисления. До их образования реакции протекают очень медленно. По мере накопления пероксидов они создают начальные радикалы, зарождающие новые цепи. Это приводит к автоускорению процесса окисления.
Цепные реакции окисления имеют ряд характерных особенностей:
1. Скорость реакции значительно увеличивается в присутствии небольших количеств веществ, способных образовывать свободные радикалы, например металлов переменной валентности (Со, Мп, Fe, Си др.).
2. Скорость реакции увеличивается при повышении температуры хранения и воздействии света, особенно ультрафиолетовых лучей, способствующих возникновению свободных радикалов.
3. Соотношение скорости окисления эфиров олеиновой, линолевой и линоленовой кислот составляет 1: 27 : 77.
4. Скорость реакции может быть резко заторможена добавлением небольших количеств веществ, получивших название ингибиторов окисления (антиокислителей).
Ингибиторы окисления препятствуют или задерживают окисление жиров. Действие их связано с возникновением менее активного радикала, который не вступает в реакцию с молекулой исходного окисляющегося вещества.
Природными антиокислителями являются токоферолы (в растительных маслах их содержится от 0,01 до 0,28%), госсипол хлопковых семян, сезамол кунжутных семян и некоторые фосфатиды. Получили распространение фенольные ингибиторы окисления, сложные эфиры
галловой кислоты. Достаточно ввести их в количестве около 0,01%, как стойкость некоторых жиров увеличивается более чем в 10 раз. Очень эффективны для защиты некоторых жиров хорошо растворяющиеся в них антиокислители — бутилгидокситолуол и бутилгидоксианизол (Е 321 и Е 320).
Некоторые вещества могут усиливать ингибирующее действие антиокислителей. Они получили название синергистов. Действие синергистов основано на способности дезактивировать ионы металлов переменной валентности (Pb, Си, Со, Mn, Fe и др.), играющих роль катализаторов окисления. Антиокислители и синергисты должны отвечать следующим требованиям:
• предохранять жиры и масла от окисления в течение длительного времени;
• растворяться в жирах;
• не вносить посторонних вкуса и запаха;
• не оказывать в применяемых концентрациях вредного воздействия на организм человека.
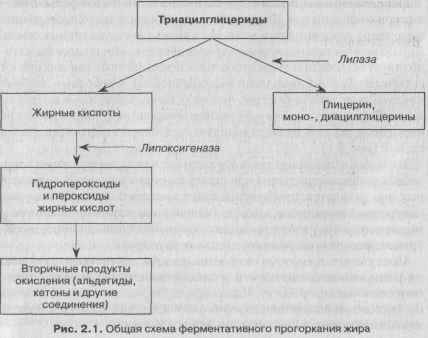
Окисление липидов может проходить и под действием ферментов — липаз и линоксигеназ. Ферментативное окислительное прогоркание характерно для липидного комплекса хранящихся масличных семян. Липаза осуществляет гидролиз триглицеридов, липоксигеназа катализирует образование гидропероксидов ненасыщенных жирных кислот (главным образом линолевой и линоленовой). Свободные жирные кислоты окисляются быстрее, чем их остатки, входящие в молекулы жира. Ферментативное прогоркание начинается с гидролиза жира ферментом липазой. В общем виде этот процесс может быть представлен схемой (рис. 2.1).
Присутствие продуктов окисления в жирах значительно ухудшает их физиологическое действие и органолептические показатели, а также затрудняет их переработку. Поэтому предотвращение окислительных процессов при получении, переработке и хранении жиров и контроль за этими процессами имеют очень важное значение.
Автор текстов Анисимова Елена Сергеевна. Авторские права защищены. Продавать текст нельзя.
Курсив не зубрить. Замечания присылать по электронной почте exam_bch@mail.ru
ПАРАГРАФ 45:
«;-ОКИСЛЕНИЕ».
формулы см. в файле «45 ФОРМУЛЫ КРАТКО».
45.0. Определение:
;-окисление – это превращение жирной кислоты в несколько молекул ацетилКоА. Остальное см. далее.
45.1. Непосредственные продукты процесса и их использование.
Этот процесс даёт несколько молекул ацетилКоА, НАДН и ФАДН2. (Это непосредственные продукты ;-окисления).
АцетилКоА после этого используется в ЦТК, что даёт ЭНЕРГИЮ (с помощью дыхательной цепи).
В печени избыток ацетилКоА может использоваться для синтеза кетоновых тел, которые хороши тем, что транспортируются в ткани для выработки энергии, в том числе в головном мозге (при голоде это существенная поддержка для мозга), но опасны при избытке (так как приводят к ацидозу – см. кетозы в п.47).
НАДН и ФАДН2 поступают в дыхательную цепь для выработки энергии в форме АТФ и ТЕПЛА.
45.2. Локализация процесса (в каких клетках и органеллах протекает).
Во всех клетках, кроме эритроцитов и нейронов. В МИТОХОНДРИЯХ (поэтому процесса нет в эритроцитах).
45. 4. Откуда в клетках берутся жирные кислоты для окисления?
Источник жирных кислот для ;-окисления – образование жирных кислот при расщеплении жира (то есть при липолизе). Когда говорят, что жир является энергетическим резервом, имеют в виду, что он может при расщеплении давать жирные кислоты, окисление которых и даёт энергию.
При расщеплении жира в клетках белой жировой ткани жирные кислоты поступают в кровь, с током крови транспортируются к разным клеткам с помощью транспортных белков плазмы крови – АЛЬБУМИНОВ.
Кроме того, жирные кислоты поступают в кровь при расщеплении жира хиеломикронов, которые присутствуют в крови после приёма жирной пищи. См. п.49-51.
При расщеплении жира в клетках бурого жира жирные кислоты не поступают в кровь, а окисляются в тех же клетках ради образования энергии в форме тепла (благодаря разобщению окислительного фосфорилирования – см. п.27 и 44).
45.5. Регуляция ;-окисления жирных кислот гормонами. И её значение.
Регуляция гормонами.
;-окисление активируется при СТРЕССЕ под влиянием катехоламинов адреналина и норадреналина и при ГОЛОДЕ под влиянием гормона голода глюкагона, чтобы дать энергию (АТФ) в этих состояниях.
Кроме того, стимуляция процесса этими гормонами приводит к образованию в печени избытка ацетилКоА, что приводит к синтезу кетоновых тех и создаёт риск кетоза. Поэтому избыток гормонов, стимулирующих ;-окисление, создаёт опасность кетоза.
В состоянии сытости ;-окисление жирных кислот снижается под влиянием ИНСУЛИНА (гормона покоя и сытости).
Замедляя ;-окисление, инсулин предотвращает накопление кетоновых тел (кетоз) – поэтому при снижении количества инсулина при диабете первого типа риск кетоза повышается – из-за активации ;-окисления на фоне снижения тормозящего влияния инсулина. При кетоацидотической коме главным лекарством является инсулин – см. п.103.
45.6. Реакции ;-окисления жирных кислот. См. формулы в «45 формулы».
1. Процесс происходит в митохондриях, поэтому сначала жирную кислоту нужно перенести из гиалоплазмы в митохондрию.
Перед переносом жирной кислоты в митохондрию её нужно АКТИВИРОВАТЬ.
Активация (активирование) жирных кислот заключается в их реакции с коферментом А (переносчиком ацилов). СМ. РЕАКЦИИ В ТАБЛИЦЕ К ПАРАГРАФУ 45 – только так, «с картинками», есть смысл читать описание реакций.
При реакции с коферментом А атом углерода карбоксильной группы соединяется с атомом серы кофермента А сложноэфирной связью, при этом атом серы присоединяется «вместо» ОН атомов карбоксильной группы. Образуется соединение остатка жирной кислоты (то есть части молекулы жирной кислоты без ОН атомов карбоксильной группы, которая называется ацилом) с коферментом А, которое называется – ациломКоА. (Не путать с ацетиломКоА – у ацетила 2 атома углерода, а ацил – это более широкое понятие – ацилами называются остатки карбоновых кислот с любым количеством атомов углерода – хоть 4, хоть 16).
Образование связи между ацилом и коферментом А происходит с затратой энергии, которая выделяется при расщеплении АТФ до АМФ и ФФн (то есть при отщеплении от АТФ двух фосфатов). В таких случаях затраты АТФ считают за ДВЕ молекулы АТФ. Так как АМФ вступает в реакцию с АТФ, которая приводит к образованию 2 молекул АТФ – в этой реакции и происходит превращение второй молекулы АТФ в АДФ).
Фермент. Ферменты, которые катализируют синтезы с затратой АТФ, называются синТЕтазами. Синтетаза, которая катализирует синтез ацилКоА, называется синтетазой ацилаКоА или ацилКоА/синтетазой.
2. Ацил переносится с кофермента А на КАРНИТИН, который осуществляет перенос ацила через мембрану митохондрии:
ацилКоА + карнитин ; КоА + ацил/карнитин.
На внутренней стороне мембраны митохондрии ацил переносится на молекулу кофермента А, которая находится внутри митохондрии:
Ацил/карнитин + кофермент А ; ацилКоА + карнитин.
После этого ацилКоА, находящийся в митохондрии, вступает в реакции окисления.
(реакции 3.1-3.3 – пример процесса так называемого КОСВЕННОГО КИСЛЕНИЯ – то есть «окисления кислородом воды»;
другие примеры косвенного окисления – превращение сукцината к оксалоацетат в ЦТК и превращение этанола в уксусную кислоту)
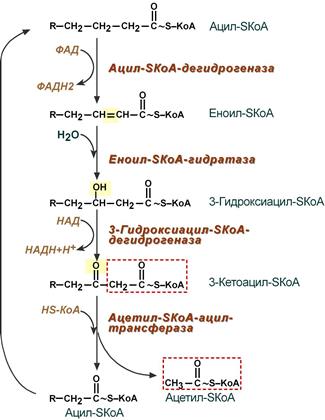
3.1. От ацилКоА отщепляются 2 атома водорода (от 2-го и от 3-го атомов углерода), в результате чего образуется соединение с двойной связью между 2-м и 3-м атомом углерода, которое называется еноиломКоА. («ен» означает двойную связь).
Отщеплённые 2 атома водорода переносятся на кофактор ФАД (содержащий витамин В2), в результате чего ФАД превращается в ФАДН2. От ФАДН2 атомы водорода передаются по дыхательной цепи на кислород. В результате из водорода и кислорода образуется одна молекула воды. А за счёт энергии, выделяющееся при работе дыхательной цепи (при переносе электронов) образуются 1,5 молекулы АТФ.
Если кислорода нет, если В2 нет, то ;-окисление протекать не может.
Процесс отщепления водорода называется дегидрированием.
Ферменты, катализирующие отщепление атомов водорода от субстрата и их перенос на НАД+ или ФАД (или НАДФ+), называются дегидрогеназами. Дегидрогеназа, отщепляющая водород от ацилаКоА, называется дегидрогеназой ацилаКоА или ацилКоА/дегидрогеназой.
3.2. ЕноилКоА вступает в реакцию с молекулой воды (НОН);
при этом ОН присоединяется к 3-му атому углерода еноилаКоА, а атом Н воды – ко 2-му атому углерода еноилаКоА («по» двойной связи).
В результате вещество с ОН (гидрокси) группой в 3-м (;) положении, которое называется ;-гидрокси/ациломКоА.
Реакция присоединения НОН «по» двойной связи называется гидратацией, а катализрующий её фермент называется гидратазой. Гидратаза еноилаКоА называется еноилКоА/гидратазой.
3.3. От ;-ГИДРОКСИацилКоА отщепляются 2 атома водорода (от кислорода ОН группы и от 3-го атома углерода), в результате чего образуется соединение с двойной связью между атомом кислорода и 3-м атомом углерода (С=О), то есть с КЕТОгруппой, которое называется ;-КЕТОациломКоА.
Отщеплённые 2 атома водорода переносятся на кофактор НАД+ (содержащий витамин рр), в результате чего НАД превращается в НАДН,Н+. От НАДН,Н+ атомы водорода передаются по дыхательной цепи на кислород. В результате из водорода и кислорода образуется одна молекула воды. А за счёт энергии, выделяющееся при работе дыхательной цепи (при переносе электронов) образуются 2,5 молекулы АТФ.
Если кислорода нет, если РР нет, то ;-окисление протекать не может.
Процесс отщепления водорода называется дегидрированием.
Ферменты, катализирующие отщепление атомов водорода от субстрата и их перенос на НАД+ или ФАД (или НАДФ+), называются дегидрогеназами. Дегидрогеназа, отщепляющая водород от ;-гидрокси/ацилаКоА, называется дегидрогеназой ;-гидрокси/ацилаКоА или ;-гидрокси/ацилКоА/дегидрогеназой.
Таким образом, превращение ацилКоА в кетоацилКоА даёт 4 молекулы АТФ – за счёт реакций 3.1 и 3.3.
3.4. В молекуле ;-КЕТОацилаКоА происходит расщепление связи между 2-м и 3-м атомами углерода,
в результате молекула расщепляется на два фрагмента – двухуглеродный и 14-тиуглеродный (если рассматривать окисление 16-ти углеродной пальмитиновой кислоты).
Это расщепление молекулы происходит при её реакции с молекулой кофермента А (КоА-SH).
К двухуглеродному отщеплённому фрагменту присоединяется атом водорода (ко второму атому углерода, «по месту расщеплённой связи»), в результате чего фрагмент превращается в молекулу ацетилКоА. Это ПЕРВАЯ из 8 молекул ацетилКоА, которые образуются при ;-окислении пальмитата.
Ко второму фрагменту присоединяется атом серы кофермента А (к бывшему 3-му атому углерода расщеплённой молекулы),
в результате чего фрагмент превращается в 14-углеродную молекулу ацилКоА.
4. 14-углеродный ацилКоА подвергается тем же реакциям, которым подвергся 16-углеродный ацилКоА (то есть реакциям 3.1-3.4), в результате чего образуются: ВТОРАЯ молекула ацетилКоА и 12-углеродная молекула ацилКоА. А также 4 молекулы АТФ за счёт двух коферментов.
12-углеродная молекула ацилКоА в свою очередь тоже подвергается реакциям, аналогичным 3.1-3.4, в результате чего образуются ТРЕТЬЯ молекула ацетилКоА и 10-углеродная молекула ацетилКоА, а также 4 молекулы АТФ.
И т.д. – всё это происходит до тех пор, пока не получится 4-углеродная молекула ацилКоА, которая после реакций 3.1-3.4 даёт 2 молекулы ацетилКоА (отщепляется СЕДЬМАЯ молекула ацетилКоА и остаётся молекула ацетилКоА, которая является восьмой).
45.7. Подсчёт АТФ от ;-окисления одного пальмитата.
Таким образом, при окислении одной молекулы пальмитиновой кислоты реакции 3.1-3.4 происходят СЕМЬ раз –
семь раз отщепляется молекула ацетилКоА,
7 раз образуется по 4 молекул АТФ (за счёт 7 молекул ФАДН2 и 7 молекул НАДН, Н+, с помощью дыхательной цепи, с использование кислорода), то есть всего образуется 28 молекул АТФ.
8 молекул ацетилКоА поступают в ЦТК, что приводит (с помощью дыхательной цепи) к образованию ещё 10 молекул АТФ от каждой молекулы ацетилКоА, то есть 8*10=80 молекул АТФ.
Если витаминов ЦТК и ДЦ мало (РР, В2, пальмитата, В1, липоевой кислоты), то энергии мало.
Таким образом, всего при окислении пальмитата образуется 28+80=108 молекул АТФ.
Нужно вычесть из 108 молекул АТФ те 2 молекулы АТФ, которые были затрачены на активацию жирной кислоты.
В итоге получается, что одна молекула пальмитата даёт 108 – 2=106 молекул АТФ.
45.8. Подсчёт АТФ от использования одной молекулы жира.
Молекула жира при расщеплении (липолизе – п.44) даёт одну молекулу глицерина и 3 молекулы жирных кислот.
Поэтому жир даёт 106*3 молекул АТФ = 318 АТФ.
Плюс АТФ от окисления глицерина (17,5). В итоге более 300 (335,5) молекул АТФ от одной молекулы жира – это в 10 раз больше, чем от полного аэробного окисления одной молекулы глюкозы (32 АТФ – п.32).
45.10. Как запомнить реакции процесса 45 и 46.
1. Выучить формулу жирной кислоты: СН3 – (СН2 )14 – СООН. Или не 14, а 16.
2. Выучить формулу эфира жирной кислоты с коферментом А, то есть ацилКоА:
СН3 – (СН2 )14 – С(О)SКоА.
3. Запомнить последовательность метаболитов: ацилКоА, еноилКоА, ГИДРОКСИацилКоА и КЕТОацилКОА.
4. Знать, что ен – это двойная связь, что гидрокси – это ОН группа, что кето – это С=О группа.
Научиться рисовать ацил с этими группами.
Помнить, что ;- это ТРЕТИЙ атом углерода, а не второй.
И что процесс называется ;-окислением именно потому, что окисление происходит «по» бета-положению, то есть по 3-му атому углерода.
5. Найти отличия между формулами начального и конечного метаболита реакции и на основе этого отличия догадаться, какие атомы присоединились к веществу или отсоединились от вещества. Как в детской игре «найди 2 отличия между похожими картинками».
6. Помнить, что если отщепились атомы водорода, то они переносятся на кофермент (см. 3.1 и 3.3).
7. Помнить, что если атомы водорода присоединились к метаболиту, то скорее всего они перенесены на него от кофермента (см. п.46).
Для окисления жирных кислот существует свой путь
Окисление жирных кислот (β-окисление)
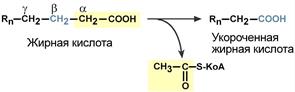
Для преобразования энергии, заключенной в жирных кислотах, в энергию связей АТФ существует метаболический путь окисления жирных кислот до СО2 и воды, тесно связанный с циклом трикарбоновых кислот и дыхательной цепью. Этот путь называется β-окисление, т.к. происходит окисление 3-го углеродного атома жирной кислоты (β-положение) в карбоксильную группу, одновременно от кислоты отщепляется ацетильная группа, включающая С 1 и С 2 исходной жирной кислоты.
Элементарная схема β-окисления
Реакции β-окисления происходят в митохондриях большинства клеток организма (кроме нервных клеток). Для окисления используются жирные кислоты, поступающие в цитозоль из крови или появляющиеся при липолизе собственных внутриклеточных ТАГ. Суммарное уравнение окисления пальмитиновой кислоты выглядит следующим образом:
Пальмитоил-SКоА + 7ФАД + 7НАД + + 7Н2O + 7HS-KoA → 8Ацетил-SКоА + 7ФАДН2 + 7НАДН
Этапы окисления жирных кислот
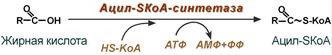
1. Прежде, чем проникнуть в матрикс митохондрий и окислиться, жирная кислота должна активироваться в цитозоле. Это осуществляется присоединением к ней коэнзима А с образованием ацил-SКоА. Ацил-SКоА является высокоэнергетическим соединением. Необратимость реакции достигается гидролизом дифосфата на две молекулы фосфорной кислоты.
Реакция активации жирной кислоты
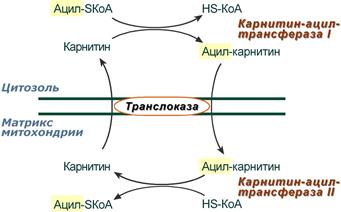
2. Ацил-SКоА не способен проходить через митохондриальную мембрану, поэтому существует способ переноса жирной кислоты в комплексе с витаминоподобным веществом карнитином (витамин В11). На наружной мембране митохондрий имеется фермент карнитин-ацилтрансфераза I.
Карнитин-зависимый транспорт жирных кислот в митохондрию
Последовательность реакций β-окисления жирных кислот
Расчет энергетического баланса β-окисления
Ранее при расчете эффективности окисления коэффициент P/O для НАДH принимался равным 3,0, для ФАДH2 – 2,0.
По современным данным значение коэффициента P/O для НАДH соответствует 2,5, для ФАДH2 – 1,5.
При расчете количества АТФ, образуемого при β-окислении жирных кислот необходимо учитывать:
Окислительные изменения и гидролиз жиров
В жировой ткани сразу после убоя не обнаруживаются перекиси, так как они не являются нормальным продуктом обмена в организме животного. При производстве и хранении жиров возможны окислительные процессы в жире, скорость и направленность которых зависит от природных свойств жира и условий окисления. Большое влияние на стойкость жиров к окислению оказывает способ их производства. Наличие перекисей обнаружено в свежеизготовленных жирах, так как окисление происходит при подготовке сырья и вытопке жира. Накопление перекисей зависит от способа производства жиров. Глубина изменений, происходящих при производстве жира, определяет в дальнейшем скорость порчи жиров при хранении. Чем выше исходное качество жира, тем больше его стойкость при хранении. Небольшие количества прогоркшего жира, попавшие в свежий, могут привести к быстрой его порче. Высокой стойкостью к окислению обладают жиры, изготовленные с применением вакуума или инертного газа.
Перекисное число жира, вытопленного в открытом котле, 0,013—0,035, а в центробежной машине — 0—0,025% йода. Скорость порчи жира при хранении зависит от химического состава сырья. Многочисленными исследованиями установлены основные факторы, влияющие на подверженность жира окислению: состав жира, в частности содержание ненасыщенных жирных кислот, содержание катализаторов, легко окисляющихся металлов (солей железа, меди, свинца, олова), а также органических веществ, содержащих железо (белков, гемоглобина и др.); парциальное давление кислорода, поверхность, находящаяся в соприкосновении с кислородом; условия хранения жиросодержащих продуктов (температура, освещенность, содержание влаги); равновесие окислительных и аитиокислительных веществ в жире.
Образование в жире перекисей ускоряется при передержке жиросырья перед вытопкой, повышенной температуре, присутствии кислорода, контакте с металлическим оборудованием. Загрязнение медью и железом, происходящее при коррозии оборудования, резко ускоряет окисление. Предполагается, что металлы, особенно медь и двухвалентное железо, катализируют окисление природных антиокислителей и этим сокращают индукционный период. Медь ускоряет окисление жира при концентрации от 0,002 до 0,005 мг% от массы жира. Если расплавленный говяжий жир пропускают через краны, изготовленные из бронзы, скорость окисления жира возрастает в 6 раз.
Свет не только ускоряет окисление при непосредственном воздействии, но и способствует увеличению образования перекисей после прекращения его воздействия. Самоокисление жира ускоряется благодаря ультрафиолетовому свету. Даже сравнительно желтый свет лампы с вольфрамовой нитью накала воздействует на жир; значительно активнее флюоресцентное освещение. Колебания интенсивности света при обработке, хранении и реализации жира могут быть значительны, начиная с солнечного света до искусственного освещения, которое в 1000 раз слабее. Особо следует избегать воздействия на жир дневного света из-за высокой интенсивности и воздействия ультрафиолетового облучения.
Окислительная порча начинается с присоединения активированных молекул кислорода и образования перекисей и развивается по принципу цепных реакций. Окисление жира может происходить в результате его контакта с кислородом воздуха и при воздействии с ранее адсорбированным кислородом.
Современные представления о механизме реакции окисления основаны на перекисной теории Баха—Зиглера и теории вырожденно-разветвленных цепных реакций Н. Н. Семенова. Торможение процессов окисления антиокислителями подтверждает цепной характер реакции окисления. Согласно теории окисления первым продуктом окисления являются перекиси; аналитически обнаруживаются гидроперекиси.
Перекиси стимулируют окисление других молекул, что обусловливает цепной характер окисления:
Окисление жиров происходит через образование свободных радикалов и относится к классу медленно развивающихся цепных разветвленных реакций. В цепной реакции могут быть выделены следующие стадии: зарождение цепи (образование свободного радикала), развитие цепи и обрыв ее, а в разветвленных цепных реакциях — еще и разветвление цепи.
В результате поглощения света молекула жирной кислоты получает энергию hv и переходит в возбужденное состояние:
Возбужденное состояние обусловливает нестабильность молекулы (R*Н) и распад на радикалы:
Получаемые свободные радикалы обладают высокой активностью, и если в системе имеется кислород, то его молекулы вступают в реакцию и образуются реактивные перекисные радикалы:
Образовавшиеся радикалы реагируют с новыми молекулами окисляемого вещества и образуются гидроокиси и новый свободный радикал R:
который вновь вступает в реакцию с кислородом, и, таким образом, возникает цепная реакция.
С молекулой кислорода может также взаимодействовать свободный атом водорода, в результате чего образуется свободный радикал:
Обрыв цепи может произойти в результате рекомбинации свободных радикалов, при развитии которой два свободных радикала образуют одну неактивную молекулу:
Ȯ—OH + Ȯ—OH → H—O—O—O—Ȯ—H → HOOH + O2
В процессы автоокисления жиров легче всего вовлекаются ненасыщенные жирные кислоты, содержащие двойные связи и активно поглощающие кванты света:
При взаимодействии свободного радикала с кислородом образуется перекисный радикал, который реагирует с новой молекулой ненасыщенной жирной кислоты, отрывая от нее атом водорода, превращается в гидроперекись.
При образовании гидроперекиси появляется новый свободный радикал, вступающий в реакцию и продолжающий цепь окислительных изменений. При этом в реакции включаются все новые молекулы жирной кислоты. Гидроперекиси отличаются низкой стойкостью, и в результате разнообразных реакций из них образуются вторичные продукты распада — альдегиды, кетоны, низкомолекулярные кислоты, сообщающие жиру прогорклый вкус и резкий, неприятный запах. В химии жиров карбонильным соединениям уделяется большое внимание и «карбонильный индекс» предлагается как показатель прогорклости пищевого жира взамен перекисного числа.
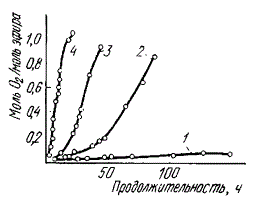
Высокой подверженностью к окислению отличаются ненасыщенные жирные кислоты (особенно арахидоновая) и насыщенные жирные кислоты с короткой цепью (C6—C10). Подверженность окислению различных видов жира обусловлена различным содержанием ненасыщенных жирных кислот. Жир свиней и птицы окисляется быстрее, чем говяжий и бараний. Высокомолекулярные жирные кислоты более устойчивы к таким изменениям. Модельные эксперименты, проведенные с отдельными жирными кислотами, показали, что чем больше в составе молекулы двойных связей, тем более коротким является индукционный период и тем быстрее протекает окисление.
| Жирные кислоты | Число двойных связей | Индукционный период, ч | Относительная скорость окисления |
| Стеариновая | 0 | — | 1 |
| Масляная | 1 | 82 | 100 |
| Линолевая | 2 | 19 | 1200 |
| Линоленовая | 3 | 1,34 | 2500 |
Зависимость скорости окисления эфиров жирных кислот на воздухе при температуре 37° С от количества двойных связей в них: 1 — этилолеат; 2 — этиллинолеат; 3 — этиллиноленат; 4 — метиларахидонат
На рисунке показана зависимость скорости окисления эфиров ненасыщенных жирных кислот от количества двойных связей. В жировой ткани убойных животных важное значение имеет окисление, катализируемое гематином. Некоторые авторы считают, что окислительные процессы в липидах мышечной ткани почти всецело зависят от Mb и Hb и их производных. Гемовые соединения Mb и Hb и цитохромы являются главными катализаторами окисления жиров, особенно в гетерогенных системах, содержащих водную и липидную фазы. При содержании в жире-сырце остатков крови при вытопке Mb и Hb разрушаются с образованием парагематинов, что вызывает потемнение жира.
Катализируемое гематином окисление не имеет столь большого значения для топленых жиров длительного хранения, так как в них не содержится гемовых соединений в количествах, необходимых для развития процессов окисления. Такое окисление может играть определенную роль в шпике, особенно если в результате шпарки при чрезмерно высоких температурах в кожных и подкожных кровеносных сосудах остается значительное количество крови, которая при хранении медленно проникает в жировую ткань, вызывая каталитическое действие гемоглобина.
Особенно подвержены окислению липиды мышечной ткани, которые представляют собой составные части различных клеточных структур: мышечных волокон, митохондрий и микросом. Катализированное гематином окисление обладает более коротким индукционным периодом, чем самоокисление, что объясняется относительно низкой энергией активации катализированного гематином окисления. Коагуляция белков уменьшает каталитическую активность пигментов мяса. После замораживания окисление жира, катализируемое гематином, практически прекращается, но оно ускоряется после размораживания мяса.
Установлено, что фосфаты тормозят катализируемое Mb и Hb окисление жиров в мясе, причем даже 0,01%-ный раствор трифосфата тормозит окисление жиров в вареном мясе. Нитрозомиоглобин также является катализатором окисления. Однако его окислительная активность снижается при нагреве в результате денатурации. Попытки создать ингибиторы гемовых окислителей пока не имели успеха. Наряду с этим аскорбиновая кислота является хорошей защитой от способности НЬ катализировать окисление жира. Посол мяса, увеличивая сопротивляемость к гнилостной порче, одновременно часто увеличивает чувствительность жира к окислению. Это обусловлено окислительным действием соли.
Окислительные изменения жиров ускоряются ферментами микроорганизмов. Развитие микрофлоры на жиросырье значительно снижает стабильность топленого жира к атмосферному окислению. Говяжье жиросырье после трехдневного хранения при повышенной влажности приобретает запах порчи и при вытопке дает жир с индукционным периодом от 3 до 15 ч при 70° С. В то же время при вытопке в парном состоянии индукционный период составил 150 ч при 70° С.
В начальной стадии окисления отсутствуют изменения органолептических и химических показателей жира. Этот период, различный по продолжительности, обусловлен тем, что в начальной стадии в жире содержится значительное количество возбужденных молекул или свободных радикалов. Кроме этого, в нем содержатся естественные антиокислители, препятствующие окислению.
При окислении жиров образуются вещества, обусловливающие прогорклый, металлический или другой посторонний оттенок аромата и вкуса продуктов. Продукты окисления — перекиси, альдегиды, кетоны, оксикислоты и свободные низшие жирные кислоты ухудшают вкус и запах жира. Гептиловый альдегид обнаруживается органолептически при концентрации 1 мг%. В формировании вкуса и запаха жира, подвергнутого окислительной порче, участвуют также жирные кислоты: капроновая, каприловая, масляная, акриловая, уксусная, муравьиная и др.
Снижение пищевой ценности жиров при окислении обусловлено тем, что сопровождается снижением содержания в жире ненасыщенных жирных кислот, распадом витаминов, все это происходит до появления обнаруживаемых органолептически признаков порчи. В окисляющихся жирах снижается содержание витаминов А и Е; разрушается каротин. Окисление каротина и других липохромов проходит быстрее при температуре вытопки выше 60° С. При окислении в результате контакта с пигментами мяса и крови разрушаются витамины комплекса В. Предполагается, что отрицательное влияние на организм окисленных жиров обусловлено их прямым токсическим действием или разрушением ими жизненно важных компонентов продукта. В прогорклых жирах содержатся токсические вещества, вызывающие нарушение обмена, расстройство нормальной жизнедеятельности организма. Установлена токсичность гидроперекисей, выделенных в чистом виде. Имеются данные, что образование глубоких продуктов распада жиров сопровождается накоплением канцерогенных веществ.
Употребление в пищу окисленных жиров может явиться причиной атеросклероза, так как окисленные липиды образуют комплексы с белками, которые откладываются в аорте, а холестерин и его эфиры осаждаются на этих комплексах.
Важным показателем, характеризующим качество жира, показывающим степень его окисленности во всех случаях, когда нет условий для разложения перекисей, является перекисное число. Наиболее широко в промышленности применялась шкала зависимости между перекисным числом и качеством жира, разработанная А. А. Зиновьевым. По этой шкале качество топленых животных жиров определяют по перекисному числу. При перекисном числе выше 0,1 животные жиры по органолептическим показателям непригодны для хранения.
| Качество жиров | Переписное число, % йода |
| Свежий | не >0,03 |
| Свежий, непригодный к длительному хранению | от 0,03 до 0,05 |
| Сомнительной свежести (порча, обнаруживаемая органолептически) | от 0,06 до 0,1 |
| Испорченный | выше 0,1 |
Величина предельного перекисного числа в ГОСТе для топленого жира может быть уменьшена при создании более совершенного оборудования. Снижение интенсивности окислительных процессов достигается охлаждением, ограничением доступа воздуха, хранением в темноте, дезактивацией металлических примесей, способствующих окислению, инактивацией ферментов нагреванием и регулированием содержания влаги. Развитие окисления затормаживается при применении любого вида упаковки, снижающей контакт жира с кислородом воздуха. Наиболее совершенной является вакуумная упаковка с введением в пакет инертного газа. Хранение бекона при —10° С в атмосфере CO2 позволяет удлинить срок хранения на 12 мес.
При хранении жиросырья окисление развивается вначале в поверхностных слоях и медленно проникает внутрь. Установлено, что в поверхностных слоях бекона, сохраняемого в течение 3 мес, количество перекисей в 25 раз больше, чем на глубине 1 см.
Скорость окисления жира возрастает примерно в 2 раза при повышении температуры на 10° С. При варке окисление резко возрастает, хотя оно не всегда сопровождается увеличением перекисного числа из-за чувствительности перекисей к нагреву. Более интенсивное прогоркание жира вареного мяса обусловлено инактивацией при тепловой обработке веществ, обладающих антиокислительным действием.
Наиболее эффективное удлинение сроков хранения жиров и сохранение их качества достигаются применением антиокислителей. Механизм действия антиокислителей основан на взаимодействии со свободными радикалами, которые передают энергию антиокислителю и выводятся из цепи окисления, в результате чего цепь обрывается.
где R — жирная кислота; А — антиокислитель; hv — энергия.
В результате взаимодействия с кислородом активная молекула антиокислителя теряет энергию и переходит в неактивный окисленный продукт:
Некоторые антиокислители разрушают возникшие перекиси. В состав жиров входят природные антиокислители (каротин, токоферол, лецитин), однако в процессе производства и очистки происходят потери природных антиокислителей, что снижает устойчивость жиров к окислению. При изучении антиокислительных свойств некоторых каротиноидов и витамина А установлено, что β-каротин и витамин А являются ингибиторами спонтанного окисления жиров. Токоферолы представляют собой естественные антиокислители жиров; жиры тем устойчивее к прогорканию, чем больше в них содержится токоферолов. Животные жиры очень бедны токоферолом; в растительных жирах их содержание значительно выше. Значительный распад токоферолов происходит при вытопке; недостаток токоферолов в организме животного является эндогенным фактором порчи жира.
Пищевой антиокислитель должен иметь такую величину молекул, чтобы они легко могли проникать через клетки животной ткани, а также обладать растворимостью в жирах, обеспечивающей проникновение в водную и жировую фазы. К антиокислителям предъявляют следующие требования: наличие эффективного антиокислительного действия, они не должны сообщать жиру постороннего привкуса, запаха и цвета при длительном хранении, отсутствие вредного физиологического действия, устойчивость к воздействию высоких температур. Этим требованиям в наибольшей степени отвечают бутилоксианизол и бутилокситолуол. В практике применяют смеси антиокислителей, а также композиции антиокислителей с синергистами, например при совместном применении бутилоксианизола и бутилокситолуола наблюдается заметный синергетический эффект.
Лецитин обладает способностью легко окисляться и является синергистом антиокислителей. Исследовано влияние добавок, усиливающих действие антиокислителей. При наличии водной фазы лучшие результаты дали полифосфаты. Эффективность действия антиокислителей возрастает с увеличением концентрации. Установлено следующее соотношение эффективности: α-токферол
Если вы нашли ошибку, пожалуйста, выделите фрагмент текста и нажмите Ctrl+Enter.