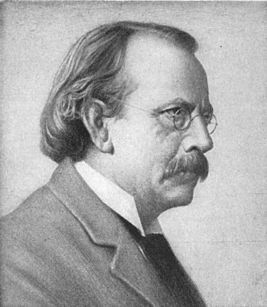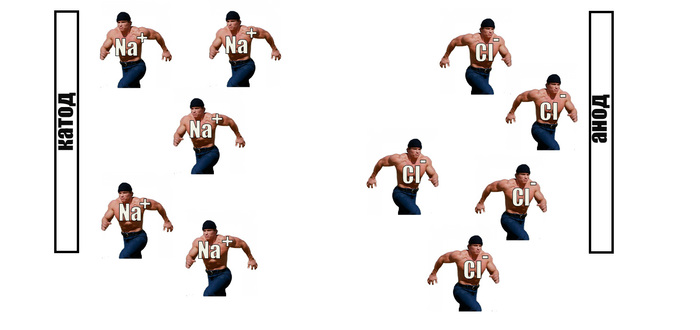Как называется первая модель атома
Первые модели атома



До конца XIX в. в науке господствовало убеждение, что все физические тела состоят из очень маленьких частиц — молекул, невидимых глазу, но доступных наблюдению в мощный микроскоп. Однако сами молекулы состоят из еще более мелких частиц — атомов. Например, молекула воды состоит из одного атома кислорода и двух атомов водорода. Атомы, считалось в науке прошлых столетий, — это последний предел делимости вещества. Они представляют собой простейшие, мельчайшие и неделимые частицы, которые лежат в основе любого физического тела. Кроме того, если они неделимы, значит, также постоянны и неизменны. Само вещество может меняться или превращаться как угодно благодаря всевозможным атомным взаимодействиям. Сами же атомы пребывают всегда в одном и том же состоянии. Будучи неделимой вечной мировой основой, они не могут распадаться на части, рождаться, исчезать, переходить в другие формы и т.д. Слово «атом», которое переводится с греческого как «неделимый», было впервые употреблено древним философом Демокритом. Его идеи об атомах как последнем пределе вещества с небольшими изменениями существовали более двух тысяч лет. Они легли в основу механицизма классического естествознания, были в нем развиты и продолжены. В конце XIX в. эти представления доживали свои последние дни. Открытия в физике, сделанные на рубеже XIX и XX столетий, разрушили многовековые представления об атомах, произвели настоящую революцию в науке.
В самом конце XIX в. английский физик Джон Томсон открыл существование в атоме отрицательно заряженных частиц, которые получили название электронов. Поскольку атом в целом электрически нейтрален, то было сделано предположение, что помимо электронов в нем существуют также положительно заряженные частицы. Опыты английского физика Эрнеста Резерфорда привели его к выводу о том, что в любом атоме существует ядро — положительно заряженная частица, размер которой (10-12 см или одна стомиллиардная часть миллиметра) очень мал по сравнению с размерами всего атома (10-8 см или одна десятимиллионная часть миллиметра). Ядро меньше атома в 10000 раз, но в нем почти полностью сосредоточена вся атомная масса. Кроме того, было обнаружено, что атомы одних элементов могут самопроизвольно превращаться в атомы других в результате ядерных излучений. Это явление, впервые открытое французским физиком Антуаном Анри Беккерелем, получило название радиоактивности (от лат. radiare — испускать лучи и activus — деятельный).
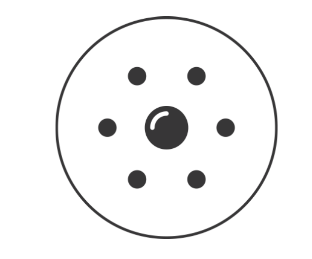
Эти открытия убедительно показали, что атомы — это не простейшие, неделимые и неизменные частицы вещества, а сложные, делимые и способные к превращению микрообъекты, имеющие определенное устройство. Одним из первых попытался выяснить строение атома Томсон. С его точки зрения атом представляет собой положительно заряженную массу, в которую вкраплены электроны, подобно тому, как изюм вкраплен в булку. Причем положительный заряд атома равен сумме отрицательных зарядов всех электронов, в силу чего атом электрически нейтрален. Здесь необходимо сказать, что поскольку атом вследствие своих малых размеров (приблизительно одна десятимиллионная часть миллиметра) недоступен никакому непосредственному наблюдению (даже с помощью сложнейших приборов), то о его устройстве можно говорить только умозрительно. Умозрительная картина или модель атома, описывающая его структуру (строение), предложенная Томсоном, стала условно называться «булка с изюмом».
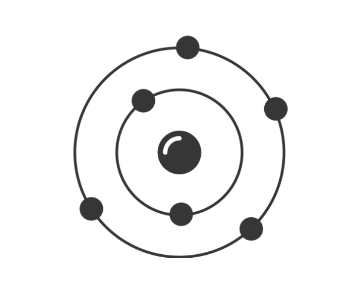
Другую модель атома построил Резерфорд. Она получила название планетарной. Нам хорошо известно, что наша Солнечная система состоит из огромного центра — Солнца и вращающихся на разных расстояниях вокруг него девяти планет, одной из которых является наша Земля. Причем размеры и масса каждой планеты ничтожно малы по сравнению с размером и массой Солнца, то есть почти все вещество Солнечной системы сосредоточено в нем. Между Солнцем и планетами действуют силы тяготения (взаимного притяжения), хорошо известные ньютоновской механике. Эти силы обеспечивают равномерное и стройное движение планет вокруг общего центра. Резерфорд предположил, что строение атома сходно с устройством Солнечной системы: в центре его находится положительно заряженное ядро, вокруг которого по разным круговым орбитам движутся отрицательно заряженные электроны. Вместо сил тяготения, действующих в Солнечной системе, в атоме действуют электрические силы: положительный заряд атомного ядра уравновешивается суммой зарядов электронов, и поэтому атом электрически нейтрален. У Резерфорда получилось, что каждый атом — это целый сложно устроенный мир, только очень малых размеров. По этому поводу русский поэт Валерий Брюсов написал такие стихи:

Быть может эти электроны —
Миры, где пять материков,
Искусства, знанья, войны, троны
И память сорока веков!
Еще, быть может, каждый атом —
Вселенная, где сто планет;
Там все, что здесь, в объеме сжатом,
Но также то — чего здесь нет.
Их меры малы, но все та же
Их бесконечность, как и здесь;
Там скорбь и страсть, как здесь, и даже
Там та же мировая спесь.
Модель атома Резерфорда наглядно описывала его строение. Однако впоследствии она столкнулась со множеством противоречий, и стало понятно, что она не совсем подходит для объяснения атомного устройства. Согласно одному из законов диалектики — перехода количественных изменений в качественные — при значительном изменении масштабов (увеличении или уменьшении) изучаемых нами объектов, принципы и законы, действующие в одних условиях, могут совершенно не действовать в других; правила одних областей реальности могут не соответствовать правилам других. Если атом — это столь малая величина, то почему бы не предположить, что для него существуют совершенно иные правила и законы, чем для нашего видимого макромира, что микромир строится абсолютно на других принципах, и все наши макропредставления бессильны что-либо описать или объяснить в микрообластях действительности.
Резерфордовская модель атома, просто и наглядно говорившая о его устройстве, была родом из макромира, ведь она сравнивала его с Солнечной системой, использовала понятия ядра, центра, движущихся частиц-электронов, орбит движения (а это все макропонятия или макропредставления). Видимо, об атоме надо было говорить как-то иначе, неким другим, специфическим языком, потому что в его лице мы имеем дело с совершенно иной реальностью.
Новую модель атома построил известный датский физик Нильс Бор. По его представлениям электрон — это не столько точка или твердый шарик, движущийся вокруг атомного ядра, сколько некий сгусток энергии, как бы размазанный вокруг ядра, но не равномерно, а с большей или меньшей плотностью на различных участках. Кроме того, надо говорить не об орбите движения электрона, а его стационарном (неизменном) состоянии, в котором он может находиться, не излучая энергии. Если же это положение меняется, то есть электрон как бы переходит из одного стационарного состояния в другое, то он излучает или поглощает порцию энергии. Как видим, модель, предложенная Бором, была более сложной и менее понятной, чем резерфордовская, но и она не смогла с успехом объяснить атомное строение, потому что во многом использовала макроязык и макропонятия. Выяснилось, что процессы, происходящие в атоме, в принципе невозможно представить в виде какой-либо механической модели по аналогии с событиями в макромире. Даже понятия пространства и времени в существующей в макромире форме оказались неподходящими для описания микрофизических явлений. Отказавшись полностью от понятного естественного языка и наглядных моделей при изучении микромира, наука все более стала пользоваться абстрактным языком математики. Атом физиков-теоретиков постепенно превращался в ненаблюдаемый набор уравнений.
Мы уже говорили о том, что к концу XIX в. наука установила два различных вида существования материи — вещество и поле, которые во всем друг от друга отличаются и представляют собой противоположности (вещество обладает корпускулярными свойствами, а поле — волновыми). На рубеже позапрошлого и прошлого столетий выяснилось, что два эти вида материи не исключают друг друга. Как то ни удивительно, но одни и те же объекты могут характеризоваться и свойствами вещества, и свойствами поля одновременно, то есть иметь как корпускулярные, так и волновые качества. Известный немецкий физик Макс Планк, исследуя процессы теплового излучения, пришел к ошеломляющему выводу о том, что при излучении энергия отдается или поглощается не непрерывно и не в любых количествах, но небольшими и неделимыми порциями, которые он назвал квантами (от лат. quantum — сколько). Квант — это порция энергии. Вдумаемся в это словосочетание. Его первая часть — слово «порция» — подразумевает нечто определенное, ограниченное, вещественное, имеющее некие размеры, то есть частицу или корпускулу. Вторая часть — слово «энергия» — подразумевает нечто непрерывное, безразмерное, невещественное, то есть поле. Стало быть, квант — это такой объект физической реальности, в котором совпадают или одновременно представлены и вещество, и поле, объект, отличающийся корпускулярно-волновым дуализмом.
Эйнштейн перенес идею о квантах на область света и создал новое учение о нем. Вспомним, что Ньютон считал свет потоком корпускул, Гюйгенс и Юнг рассматривали его как волны cветоносного эфира, а Фарадей и Максвелл — как колебания электромагнитного поля. Эйнштейн совместил все эти представления и создал теорию, по которой свет имеет корпускулярно-волновую природу. Он распространяется квантами, то есть энергетическими порциями, которые были названы фотонами (от греч. photos — свет). С одной стороны, фотон — это именно порция энергии и поэтому является своего рода частицей или корпускулой, а с другой стороны, фотон — это порция именно энергии, и поэтому является своего рода волной. Свет по Эйнштейну — это поток энергетических зерен, световых квантов или своеобразный фотонный дождь. Эйнштейновское представление о световых квантах помогло понять и наглядно представить явление фотоэффекта, сущность которого заключается в выбивании электронов из вещества под действием световых волн (каждый электрон вырывается одним фотоном). Все это убедительно подтвердило идею Эйнштейна, что свет ведет себя не только как волна, но и как поток корпускул. В опытах по дифракции и интерференции проявляются его волновые свойства, а при фотоэффекте — корпускулярные. Фотонная теория Эйнштейна относится к наиболее экспериментально подтвержденным физическим теориям.
Идея о квантах была перенесена и на представления об атоме, в результате чего появилась специфическая дисциплина — квантовая механика — наука, описывающая процессы, происходящие в микромире. Одним из ее основных утверждений является мысль о том, что микрообъекты (электроны, например) обладают, подобно свету, и корпускулярными, и волновыми свойствами, и только при учете этой двойственности можно более или менее успешно получить общую картину микромира. Квантовая механика — сравнительно молодая научная дисциплина, ее «возраст» насчитывает приблизительно сотню лет. Появившись в прошлом столетии, она уже достигла значительных результатов, но дальнейшие ее успехи, по всей видимости, впереди. Современная наука ждет от нее ответов на многие сложные вопросы, связанные не только с микромиром, но также касающиеся макро- и мегамиров, ведь три эти области существуют не изолированно друг от друга, а представляют собой единую физическую реальность.
Вопросы для самопроверки
Какие открытия, сделанные в физике в конце XIX и начале XX вв., разрушили представления об атомах как о неделимых частицах вещества?
Что представляет собой модель атома, предложенная Томсоном? Как устроен атом согласно модели Резерфорда? Почему она называется планетарной?
Как выглядела модель атома, предложенная Нильсом Бором? В чем заключаются трудности изучения микромира?
Какое открытие было сделано Планком? Что такое квант? В чем проявляется его корпускулярно-волновая природа?
Какую теорию света разработал Эйнштейн на основе представлений о квантах?
Что представляет собой корпускулярно-волновой дуализм микромира? Что такое квантовая механика?
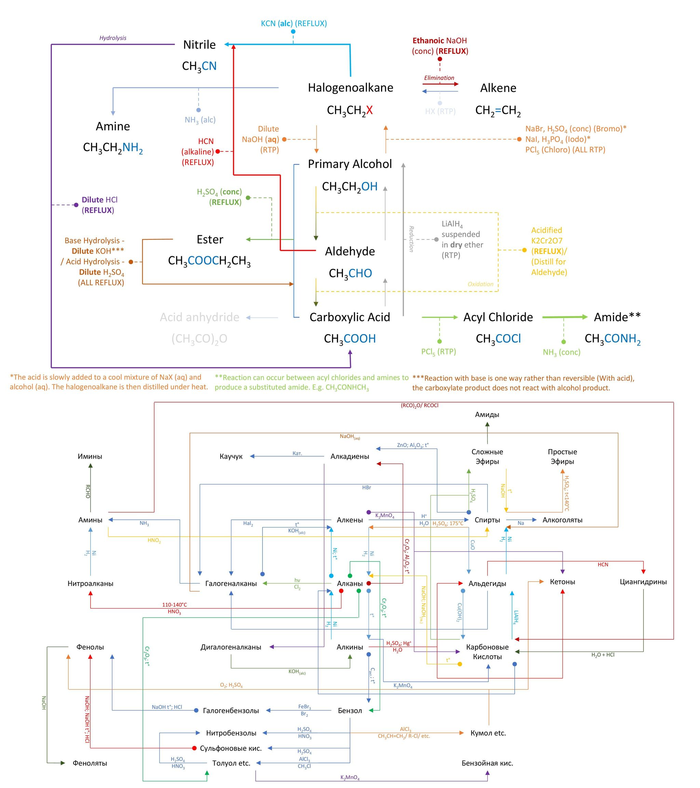
Строение атома
Автор статьи — профессиональный репетитор, автор учебных пособий для подготовки к ЕГЭ Игорь Вячеславович Яковлев
Темы кодификатора ЕГЭ: планетарная модель атома.
Атомы каждого химического элемента имеют строго индивидуальный линейчатый спектр, присущий только данному элементу и не меняющийся от опыта к опыту. Как это можно объяснить? Как вывести формулу, дающую весь набор частот атомного спектра? Чтобы сделать это, нужно узнать, как устроен атом.
Модель Томсона
Первую модель строения атома придумал английский физик Джозеф Джон Томсон (удостоенный Нобелевской премии за открытие электрона). В конечном счёте она оказалась неверной, но сыграла важную роль, будучи стимулом последующих экспериментальных исследований Резерфорда. Физики называли модель Томсона «пудинг с изюмом».
Согласно Томсону атом представляет собой шар размером порядка см. По этому шару некоторым образом распределён положительный заряд, а внутри шара, подобно изюминкам, находятся электроны (рис. 1 ).
Рис. 1. Модель атома Томсона
Суммарный заряд электронов в точности равен положительному заряду шара, поэтому атом в целом электрически нейтрален.
Излучение атомов объясняется колебаниями электронов около положений равновесия (как вы помните, любой ускоренно движущийся заряд излучает электромагнитные волны). Однако вся совокупность экспериментальных данных по атомным спектрам не укладывалась в модель Томсона. Например, для некоторых химических элементов были подобраны формулы, хорошо описывающие их спектры, но эти формулы из модели Томсона никак не следовали.
Опыты Резерфорда
Но в те времена об атомных ядрах ещё ничего не знали — о них Резерфорду лишь предстояло догадаться, глядя на результаты своих знаменитых опытов!
Планетарная модель атома
Эта величина на пять порядков (в сто тысяч раз!) меньше размера атома. Так на смену модели Томсона пришла планетарная модель атома (рис. 3 ).
Рис. 3. Планетарная модель атома
В центре атома находится крошечное положительно заряженное ядро, вокруг которого, словно планеты вокруг Солнца, движутся электроны. Между ядром и электронами действуют силы кулоновского притяжения, но упасть на ядро электроны не могут за счёт своего движения — точно так же, как и планеты не падают на Солнце, хоть и притягиваются к нему.
Заряд ядра по модулю равен суммарному заряду электронов, так что атом в целом электрически нейтрален. Однако электроны могут быть выбиты из своих орбит и покинуть атом — тогда атом превращается в положительно заряженный ион.
Масса электронов составляет очень малую часть общей массы атома. Например, в атоме водорода всего один электрон, и его масса в раз меньше массы ядра. Следовательно, почти вся масса атома сосредоточена в ядре — и это при том, что ядро в сто тысяч раз меньше самого атома.
Чтобы лучше почувствовать соотношение масштабов атома и ядра, представьте себе, что атом стал размером с Останкинскую телебашню ( м). Тогда ядро окажется горошиной размером мм, лежащей у вас на ладони. И тем не менее, почти вся масса атома заключена в этой горошине!
История атома: теории и модели
Сегодня я привожу мою адаптацию, перевод и дополнение статьи «The History of the Atom – Theories and Models» ( http://www.compoundchem.com/2016/10/13/atomicmodels/ ) от Compaund Interest, а также небольшую представляю инфографику по статье!
Вся материя состоит из атомов. Это то, что мы теперь представляем, как само собой разумеющееся, и одна из первых вещей, которую вы узнаете сразу в начале своего обучения химии. Несмотря на это, наши представления о том, что же такое атом появилось совсем недавно: всего за сто лет назад, причем ученые до сих пор спорят, как именно атом выглядит.
Древнегреческие философы предположили, что атомы отличаются своей формой в зависимости от типа. Например, атомы железа представлялись виде крючков, которые цеплялись друг за друга, что объясняло почему железо было твердым при комнатной температуре, а атомы воды были гладкими и скользкими, поэтому вода была жидкой при комнатной температуре. И хоть теперь мы знаем, что это не так, их идеи были заложены в основу будущих атомных моделей.
Новое представление об атоме появилось лишь в 1803 году, когда английский химик Джон Дальтон начал развивать научное определение атома. Он основывался на идеи древних греков в описании атомов как маленьких, твердых, неделимых сфер, как и у греческих философов, у Дальтона атомы одного элемента идентичны друг другу. Последний пункт по-прежнему является в значительной степени верным, исключением являются изотопы различных элементов, которые отличаются по числу нейтронов. Однако, так как нейтрон не был обнаружен до 1932 года, мы, вероятно, можем простить Дальтону эту ошибку. Дальтон также придумал теорию о том, как атомы объединяются, образуя соединения, а также представил первый набор химических символов для известных элементов.
Первый прорыв произошел в конце 1800-х годов, когда английский физик Джозеф Джон Томсон обнаружил, что атом не был столь же неделимым, как заявлялось ранее. Он проводил эксперименты с использованием катодных лучей (электронных пучков), произведенных в разрядной трубке, и обнаружил, что лучи притягиваются положительно заряженными металлическими пластинами, но отталкивается отрицательно заряженными. Из этого он сделал вывод, что лучи должны быть заряжены отрицательно.
Изучая частицы в лучах, он смог сделать вывод о том, что они были в две тысячи раз легче, чем водород, а также путем изменения металла катода, он продемонстрировал, что эти частицы присутствовали во многих типах атомов. Таким образом он открыл электрон (хотя он называл его как «корпускул»), и показал, что атомы не являются неделимыми. За это открытие он получил Нобелевскую премию в 1906 году.
В 1904 году он выдвинул свою модель атома на основе своих выводов, названную «пудинговой моделью атома». Данная модель представляла атом как положительно заряженную сферу, с электронами, усеянными в сфере, как сливы в пудинге. Модель Томсона была вскоре опровергнута его учеником.
Эрнест Резерфорд являлся физиком из Новой Зеландии, обучался в Кембриджском университете у Томсона. Работая в Университете Манчестера, он представил новое представление о модели атома. Его работа была опубликована уже после того, как он получил Нобелевскую премию в 1908 году за исследования в химии радиоактивных веществ.
Открытие Резерфордом ядра означало необходимость переосмысления атомной модели. Он предложил модель, в которой электроны вращаются вокруг положительно заряженного ядра. Однако, он не объяснил, что держит электроны, вращающиеся вокруг ядра вместо того, чтобы просто упасть на ядро.
Новая модель была представлена Нильсом Бором. Бор был датским физик, который приступил к решению проблем, связанных с моделью Резерфорда. Так как, классическая физика не могла правильно объяснить, что происходит на атомном уровне, он обратился к квантовой теории для объяснения расположение электронов. Его модель постулировала существование энергетических уровней или электронных оболочек. Электроны могут находится только на этих энергетических уровнях; Другими словами, их энергия квантуется, и не может принять только какое-либо значение между квантованными уровнями. Электроны могут перемещаться между этими энергетическими уровнями (именуемыми Бором как «стационарные состояния»), но при условии поглощения или испускания энергии.
Модель Бора не решает всех проблем атомной модели. Она хорошо подходит для атомов водорода, но не может объяснить наблюдения за более тяжелыми элементами. Это также нарушает принцип неопределенности Гейзенберга, один из краеугольных камней квантовой механики, в которой говорится, что мы не можем знать точное местоположение и импульс электрона одновременно. Тем не менее, модель атома Бора наиболее широко распространена и известна, что связано с удобством объяснения химической связи и реакционной способности некоторых групп элементов на начальном этапе обучения.
Во всяком случае, модель все еще требует переработки. На данный момент, многие ученые проводили исследования и пытаясь разработать квантовую модель атома. Главным среди них являлся австрийский физик Эрвин Шредингер, которого вы, вероятно, знаете благодаря «Коту Шредингера». В 1926 Шредингер предположил, что, электроны и другие элементарные частицы ведут себя подобно волнам на поверхности океана. С течением времени пик волны (соответствующий месту, в котором скорее всего будет находиться электрон) смещается в пространстве в соответствии с описывающим эту волну уравнением. То есть то, что мы традиционно считали частицей, в квантовом мире ведёт себя во многом подобно волне.
Шредингер решил ряд математических уравнений для описания модели распределения электрона в атоме. Его модель демонстрирует ядро, окруженное облаками электронной плотности. Эти облака являются облаками вероятности; хотя мы не знаем точно где электроны в тот или иной момент времени, но мы знаем в каких заданных областях пространства они вероятно могут находится. Эти участки пространства называются электронными орбитами. Становится понятно, почему в средней школе уроки химии зачастую не приводят эту модель, хотя это модель считается наиболее точной!
Лига образования
1.9K постов 16.6K подписчиков
Правила сообщества
Публиковать могут пользователи с любым рейтингом. Однако мы хотим, чтобы соблюдались следующие условия:
-уважение к читателю и открытость
-публикация недостоверной информации
-конструктивные дискуссии на тему постов
-личные оскорбления и провокации
-неподкрепленные фактами утверждения
Замечание по оформлению: заголовки в виде цитат не смотрятся.
Спасибо большое! Очень познавательно :3
Химические мемы №14
Два ядра: дейтерия и трития сливаются, с образованием ядра гелия (альфа-частица) и высокоэнергетического нейтрона.
Такая реакция даёт значительный выход энергии. Недостатки — высокая цена трития, выход нежелательной нейтронной радиации.
В общем соединения железа и меди в высших степенях окисления по особенному реагируют с иодпроизводными.
Не только на алюминии бывает оксидная пленка, а еще на железе, меди и многих других металлах.
Под действием света хлор распадается на радикалы, такую реакцию используют при хлорировании алканов.
Окислители принимают электроны и берегут их как зеницу ока, восстановители наоборот счастливы отдать свои электроны, но цель одна завершить внешний уровень.
Аллюзия на молекулу водорода!:)
Химиллиун
Сегодня мы с моими учениками изучали науку Хэллоуина. Для этого нам пришлось призвать газового призрака:
А также дух тыквенный головы:
Ну и куда же без жутких и загадочных огней?
А вы празднуете Halloween 🎃 👻 👽?
Плюсы и минусы работы учителем в США
Всем привет! Хочу поделиться с вами своим небольшим, но все же опытом.
Пара моментов, так как в США нет централизованного министерства образования, а каждый штат сам выбирает школьные стандарты, длину учебного года, время каникул, я буду говорить только о том, что происходит Мэриленде. Также я не буду затрагивать другие предметы, кроме науки: биология, химия, физика, экология, наука о Земле (геология + метеорология).
Я оптимист по натуре поэтому начну с плюсов. Учебный год у нас 190 рабочих дней, с перерывом на Thanksgiving break (в этом году 24 ноября по 28 ноября), зимние каникулы (20 декабря по 2 января) и весенний отрыв (с 14апреля по 18 апреля). Учебный год должен закончиться 16 июня, если не будет «снежных» дней. Субтропики. здесь снег это трагедия.
Также мой супервайзер каждый год заключает контакты на обновление измерительных инструментов- в этом году нас порадовала компания Vernier:
Итак, из плюсов пока набралось- снабжение, работа супервайзера (выше директора школы, в моем дистрикте этот человек принимает решение об увольнении и наеме учителей Науки), и свобода. Свобода даже в оформлении классной комнаты:
И у нас проходят очень классные курсы повышения квалификации- в этом году мы исследовали биосферу Assawoman Bay
С самым большим минусом я столкнулась в том году. 6 недель декрета! Это ещё супер-супер. Очень тяжело выходить на работу с таким маленьким ребёнком.
Из-за свободы преподавания, дети в одной школе могут получать несколько разный уровень предмета. А если ребёнок меняет учителя, он может просто пропустить (читай не изучить) какой-то большой блок.
Что же на сегодня я остановлюсь здесь. Если тема окажется интересной, то продолжу в следующий раз. На последок, обожаю когда мои «ученые» увлечены процессом:
Извиняюсь за грамматику, стараюсь писать правильно, но получается как-то так 😬
Химические мемы часть №8
Ну вот как-то получается так!:)
Бензол реагирует с хлором по разному. Если на свету, то рушится кольцо и идет реакция присоединения, если же в присутствии катализатора (напр.: AlCl3) идет реакция замещения.
Озон более сильный окислитель, чем молекулярный кислород (оба они состоят из атомарного кислорода).
Шутка в том, что железо более широко применяется из-за большого количества сплавов с разными свойствами и простоты обработки. А остальные металлы с более качественными характеристиками завидуют!:)
Металлические свойства франция сильнее, чем у лития, т.к. у него больше радиус.
А вот Вы знали, что раньше натрий называли содиум? Вот и калий изначально имель другое название. Какое спросите Вы? Поташ!
Химические мемы!
Больше недели прошло, а значит мемасы химические подкопились, выкатываю еще порцайку. )
Сложности при обучении
Что-то я не уверен, что читатели реально просят пост, я пишу в первую очередь тут ради себя, просто чтобы рассказать что-то, поделиться умными и не очень умными мыслями с кем-то.
Хочу рассказать о том, что мне давно не дает покоя. У примерно половины неуспевающих в школе учеников, которые мне попадаются, возникают одни и те же проблемы. У них безумно плохо развито абстрактное мышление. Первое о чём мне хочется узнать у таких учеников, это их успеваемость по математике. Очень часто на первом занятии я даю им простую задачу на логику, чтобы оценить их способности в этом направлении, ибо школьные оценки мало показывают реальные навыки.
Покажу на простом примере что именно меня беспокоит. Возьмем две простейшие задачи.
Эти задачи изоморфны, т.е. отличаются в них только названия объектов, названия величин, и значения. Но структура задачи и формулы, связывающие величины идентичны. В том смысле, что это не просто похожие задачи, а буквально структурно одинаковые, с различиями лишь в данных цифрах. Если данные задачи обозначить буквенными обозначениями, получатся одинаковые задачи.
Если бы вместо массы мяча по футболу, я написал «мяч по футболу на 406,5 грамм тяжелее мяча для тенниса», то задачи перестали быть изоморфными, хотя остались бы похожими.
Чтобы замечать подобное не нужны годы тренировок и какие-то сверхспособности, структуры задач простые и подобное могут заметить даже младшеклассники. А даже если и не замечают, то нам кажется очевидным, что человек, легко решающий первую задачу, легко решит и вторую задачу, ведь они отличаются только цифрами.
Подобное должно работать точно так же и в задачах по химии или физике, а вот тут возникают сложности. Существует очень много учеников, которые имея за плечами понимание и знание всех основных формул и зависимостей величин из химии, не могут решить задачу по химии, при этом влегкую решают изоморфную задачу учебника математики.
Например, типичная задача из ОГЭ по химии
Если ученик напишет реакцию и посчитает молярные массы веществ (это обычно делается в первую очередь), то задача станет изоморфной этой задаче
Лично я замечаю, что чем легче школьнику дается математика в школе, тем быстрее он может абстрактно взглянуть на задачу.
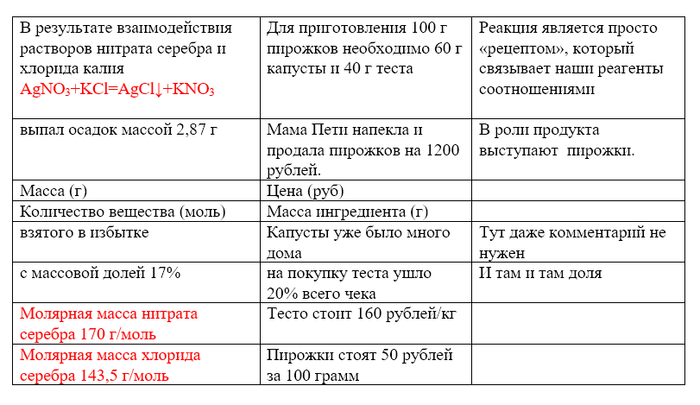
Я распишу аналогичные моменты, из этих задач чтобы было лучше видно, что они изоморфны. Красным выделил то, что в условии не написано прямо. Молярные массы считаются из таблицы Менделеева, а написание реакции, это единственная химическая вещь в задаче, при решении задач реакцию пишут в первую очередь.
Если вы можете решить задачу про пирожки, то и химическая задачка вам должна быть под силу, ведь решения там должны получиться совпадающими. Если в своем решении вы делите заработок от продажи пирожков на цену пирожков, то в химической задаче на этом же месте вам пришлось делить массу осадка на молярную массу хлорида серебра. Если в вашем решении есть строчка, где вы умножаете массу теста на цену теста, то в решении химической задачи, соответственно, вы умножаете количество нитрата серебра на его молярную массу.
Ни в коем случае не нужно воспринимать подобное как способ решения, никто в здравом уме не будет деконструировать задачу до самого конца, я порой использую изоморфные задачи, чтобы понять в чём именно проблема у ученика, проблема с логической сложностью, он не до конца смог воспринять химические понятия, или просто между химией и логикой у него стена.
Кстати, что-то подобное наблюдается и в тех случаях, когда необходимо воспользоваться навыками из другого предмета. У многих школьников будто стоит какой-то блок на навыки из других предметов, как только они уходят с физики, и идут заниматься какой-нибудь биологией, они будто отключают воспоминания отвечающие за физику. Межпредметных связей в школьной программе катастрофически не хватает. Школьникам одинаково тяжело найти параллели как между литературой и историей, так и между химией и физикой. Мне кажется, что проектная деятельность может помочь такие связи наладить, т.к. для многих проектов необходимо привлекать навыки из многих предметных областей. И еще, наверное, были бы полезны дни, где разделения на предметы нет, где доклад одного предмета может плавно перетекать в другой, или где в обсуждении проблемы используют взгляды от разных предметов. Но на такие смелые реформы могут пойти только где-нибудь в Финляндии, но точно не у нас. У нас даже еще не смогли отойти довольно сомнительного формата уроков литературы, придуманного в СССР, где учитель объясняет ученикам смысл произведений.
Стал ли ЕГЭ по химии сложнее?
В этом году, как и в прошлом, сразу после экзамена по химии выпускники стали жаловаться на усложнение экзамена по химии, в сравнении с прошлым годом и пробниками. Особенно их расстроило именно усложнение по отношению к пробникам.
В этом посте я попробую разобраться, были ли задания в 2021 году действительно сложнее заявленных и попробую рассказать свой взгляд на данную «проблему». Сам я готовлю школьников и студентов к экзаменам и олимпиадам уже больше пяти лет, и многие преподаватели согласны со мной в том откуда растут ноги у подобной истерии.
Для начала, давайте спросим себя, а что такое вообще сложность/трудность? Давайте представим себе простейшую контрольную по математике за шестой-седьмой класс с тремя заданиями.
Если я добавлю четвертое задание, на ту же тему что и первое, станет ли тест сложнее? Ну как бы да, ведь времени придется потратить больше. Но это не концептуальное усложнение.
Хорошо, а если я добавлю ко второму заданию лишнюю скобку, станет ли оно сложнее?
Никаких новых приемов или концепций тут не появилось. Просто теперь второе задание придется делать чуть дольше. Можно сказать, что я ровно так же просто увеличил объем заданий, а не их сложность.
Ну а если я вместо равенства возьму неравенство, станет ли контрольная сложнее?
Да, и вот тут у нас уже будет концептуальное усложнение, ведь неравенство требует другого понимания и с ними нужно работать иначе нежели с уравнениями. Это уже будет концептуальное усложнение. Некоторые для этого как раз используют слово «трудное», а для первого случая используют слово «сложное».
Это очень грубое деление, но оставим десятки сложных классификаций заданий для педагогов профессионалов, нам хватит и этих двух крайностей.
А что будет, если я вместо целых чисел возьму в квадратном уравнении дробные коэффициенты?
Вы наверное скажете, что это всё же не концептуальное усложнение, и мол теперь просто дольше считать дискриминант и дольше считать корни, при этом способ решения не поменяется, станут лишь больше расчеты. И вы были бы правы, если бы школьникам был доступен этот способ решения. Если мы представим, что учебных часов не хватило, и им рассказали лишь про теорему Виета. Вот кстати она
То становится очевидно, что в нашем первом варианте найти корни крайне легко (это 2 и 3), а вот в последнем варианте, подобрать корни таким способом уже становится нетривиальной задачей. При оценке сложности мы не должны забыть про навыки, которые дали школьникам на вооружение. Может быть учитель совсем дикий и вообще заставил заучить школьников таблицу с различными целыми коэффициентами и корнями (поверьте, подобная дичь на уроках химии в школах встречается).
Так что там с ЕГЭ по химии? В этом году ЕГЭ по химии в основном «удивило» школьников 34-ым заданием, об этом говорили и некоторые мои ученики, и мои коллеги жаловались в чате, и в комментах на ютубе под разборами можно найти подобные жалобы.
Для иллюстрации покажу лишь разницу между заданием из пробника и заданием с реального экзамена.
Вы заметили разницу? Её практически нет. Если в пробниках деление раствора было на две части, в настоящем ЕГЭ его стали делить на 3 части. Задание усложнилось лишь объемом, но никак не усложнилось концептуально. Почему же тогда так много проблем оно вызвало у школьников? Ответ, увы, дают они сами. Самый частый комментарий под разбором заданий был «блин, не видел такое при подготовке».
Как же так, задание на экзамене один в один, требуют тех же навыков и знаний, увеличили лишь его объем, но ученики в глаза не могут узнать свои же задания, которые они решали пачками при подготовке?
Вероятнее всего, мы тут видим ситуацию аналогичную той, которую мы придумали с квадратным уравнением. Школьникам дали навык, который помогает решать только задачи с двумя колбами, и не просили их решать эти задачи более общим способом, который бы подошел для задач любого объема.
С реакциями в 30-ом задании всё еще хуже, школьники как один писали «я не решил, так как эту реакцию не видел на уроках». Это лишь лишний раз подчеркивает, что ученики опираются на запоминание ключевых реакций, а не на понимание основных закономерностей. И в этом беда не учеников и даже не ЕГЭ, а банальной школьной программы по химии.
Во-первых, количество часов слишком мало. Химии в обычной школе всего 2 часа, в профильных школах их 4 часа (но это не делает погоду, так как сама программа ужасна). Во-вторых, в программе просто убого много всего, что тебе придется запоминать. Вместо упора на более глубокое понимание, программа делает шаги в ширину, а не в глубину.
Где-то год назад пикабушник сделал диаграммки, показывающие разницу в количестве органических реакций в нашем ЕГЭ, и Английском A-Level (профиль по химии в Великобритании).
И в комментариях правильно подметили, если вы возьмете учебник для A-level, вы увидите разбор механизмов реакций, это «глубокая» химия, можно сказать смотрят как реакции работают «под капотом». В нашей программе, предлагается изучить в несколько раз больше органических реакций, имея под руками от 2 до 4-x часов в неделю. Ученикам не остается выбора, их приходится запоминать, учитель же в ловушке, ему некогда рассказывать про механизмы и общие принципы, а имеем мы то что имеем.
Если хотите посмеяться или погрустить, почитайте гневные отзывы выпускников.
Они там даже очередную петицию пишут.
Так, а теперь самое главное, что нам скажет сухая статистика и средний балл (который мин.обр. может покручивать). Средний балл на ЕГЭ по химии почти не менялся, он как и был в 2019 примерно 55, так и в 2020 примерно 55, и в 2021 на том же месте стоит. Но поменялась дисперсия, учеников сдавших хуже и лучше в 2020 стало больше чем в 2019. В этом году результаты повторяют прошлый год. Экзамен стал лучше дифференцировать, что было ожидаемо.
Что такое быть PhD студентом в атомной энергетике
Почти два года назад я начал обучение в аспирантуре университета МакМастера в Канаде по направлению атомной энергетики. До этого момента ни единого рабочего дня в своей жизни я не провёл за работой отличной от атомной энергетики. То ли неуничтожимая внутренняя мотивация, то ли случайность, но так сложилось. Успел и подкритическую сборку перегружать вручную, и на Кольской атомной станции побакланить на практике, покататься к Калининской, Нововоронежской, Ростовской АЭС на разных этапах жизненного цикла в составе подряда, проанализировать исследовательский реактор в НИКИЭТе, ну и спроектировать некоторые технологические схемы для АЭС в Бангладеш. Опыт интересный, каждый раз новые и знания даются всё приятнее и легче.
За несколько месяцев ты узнаешь про десятки видов научного софта, разбираешься в системных кодах, моделировании, начинаешь любить линукс и консоль, учишься искать самую важную информацию на любом языке, а мир разных фреймворков, языков программирования и анализа больших объёмов данных затягивает тебя с головой. Если раньше ты мог только промычать несколько слов, то теперь чувствуешь постоянное напряжение в извилинах и смело дискутируешь на тему экологии и изменения климата, как ни странно. Приходит странное ощущение того, что весь атомный мир очень тесен, плотно знает друг друга, и кругом всплывают одни и те же фамилии. Ты по фамилии можешь вспомнить целый пласт, заложенный человеком и выдержки из его статей.
MOOSE как один из новомодных примеров глубокой интеграции разного софта. Поражает воображение.
Сейчас я занимаюсь тем, что анализирую безопасность на атомных блоках нового поколения (когда выпущу первые статьи, то поделюсь ими на понятном языке). Вы когда-нибудь прикасались к чему-то настолько новому, что ваши маленькие шажки могут существенно повлиять на дальнейшее развитие этого нового? Ощущение нахождения на переднем краю технической науки опьяняет, каждый человек, который встречается вам на пути является важным винтиком огромного локомотива, несущегося в космос, и, чёрт подери, с ними настолько интересно, что хочется, чтобы встречи, конференции и работа в этом направлении для вас не заканчивались никогда.
Ох уж этот экоактивизм. Разрушим окружающую среду в угоду себе и климату.
По факту ты обычный человек, который любит свою работу, пытается заниматься просвещением по мере сил, а также разбирается в физике, математике и анализе безопасности, просто область твоя настолько узка, что хочется за бокальчиком пива поговорить об этом, а не с кем. Одна женщина в поезде в сторону Москвы вообще мне рассказала, что из-за таких как я животные отращивают третьи ноги, пятые руки и бегают по Зоне Отчуждения, а людей зомбируют на то, чтобы они никому не говорили про миллионы погибших после ЧАЭС с помощью 25-го кадра. С тобой в разговорах всегда хотят приплести политику по двум причинам:
1) Ты русский атомщик, значит ты точно знаешь что-то про какие-то крутые ядерные вундервафли и оружие
2) Если всё так с атомкой хорошо в России, то почему ты учишься за рубежом?
Политика сидит в печёнках настолько серьёзно, что ты старательно обходишь даже нейтральные, но связанные с энергетикой темы стороной, как и разговор о своей специальности, чтобы не дай бог не спровоцировать человека на полуторачасовой разговор ни о чём.
Многим даже невдомёк что 95% всей информации (моя попытка просвещения для сохранения в закладки) по атомным станциям, технологиям, инженерии и расчётам находятся в открытом доступе, на открытом обсуждении на разных площадках, и изложены языком любой степени сложности, просто никто не удосужится прочитать ИНСАГ по Чернобылю, отчёт по Фукусиме, книги по проектированию и прошерстить википедию на предмет ответов на свои вопросы. С одной стороны ты устаёшь давать одинаковые ответы, с другой стороны понимаешь, что этот разговор может изменить отношение человека к делу твоей жизни на 180 градусов.
Опасный реактор на территории универа! Вы не представляете что случилось с этими людьми! Они только.
Спасибо что дочитали до конца. Желаю всем успехов в саморазвитии, карьере, любви, да во всех начинаниях в общем. Вы классные, кем бы вы ни были.
P.S. Ниже все ссылки из поста, просто если лень читать.
История развития атомистической теории. Древняя Греция
Любовь Новикова, репетитор по химии, рассказывает об истоках возникновения атомистической теории. Почему люди решили, что атом существует, и как они пытались это доказать?
Благодарим за предоставленное помещение БЦО «Современник».
Привет, меня зовут Любовь Новикова, это SciTeam, и сегодня я хочу поговорить с вами об истоках возникновения атомистической теории или другими словами: почему люди решили, что атом существует и как они пытались это доказать?
Сейчас мы уже наверняка знаем, что атом существует, мы можем его видеть в какие-нибудь крутые микроскопы, проведено куча опытов и экспериментов, которые доказывают, то что атом существует и в принципе система работает, если предположить, что он есть.
Но как изначально возникла идея, а атом это в первую очередь идея, что атом существует и для того, чтобы разобраться в этом вопросе нам нужно будет переместиться в 4-3 тысячелетие до н.э. в Египет.
В это время Египет является крупнейшим рабовладельческим государством в Северной Африке, в котором за счет как раз наличия дешевой рабочей силы – рабов, происходит активное развитие практической химии. Да так там хорошо все развивается, что Египет становится лидером в химической технологии того времени. Т.е. в период с 3 тысячелетия до н.э. до 3 века до н.э. люди научились: делать керамические горшочки и расписывать их, красить ткани и ткать, научились дублению кожи, они делали различные украшения из стекла и других камней, при этом они умели красить стекло и делать украшения разнообразными, они развивали фармацевтику с травками, по типу экстрагирования, выпаривания, вываривания, настаивания, выжимания, сбраживания, они возводили огромные пирамиды, развивали металлургию и многое другое.
Т.е. шел процесс огромного накопление знаний в практической химии, и что самое главное это все происходит под эгидой храмов, и жрецы тщательно записывают и сохраняют химические технологии и рецептуры. Параллельно с Египтом начинает развиваться не менее важное для развития атомистической теории, а даже ключевое для развития атомистической теории государство – Греция. Между Египтом и Грецией происходит культурный обмен, и предприимчивые греки активно перенимают все знания, которые были накоплены Египтом.
И видя наработки египетских ремесленников и как происходят все эти процессы греки начинают задаваться вопросов: а почему оно именно так происходит? И эта мысль, собственно, поменяла вектор развития химии. Если раньше в Египте люди больше делали ставку на практическую химии и задавались вопросом: как это сделать, то греки задали качественно другой вопрос, они перешли к теоретической химии и стали задаваться вопросом: почему оно так происходит.
Первый, кто серьезно поставил вопрос о природе вещества и решил в нем разобраться был древнегреческий философ Фалес, и произошло это в 5-6 веке до н.э. Он даже основал свою философскую милетскую школу, в которой, собственно и разбирался как устроена наша вселенная.
Мы можем предположить, как размышлял в то время Фалес:
Если одно вещество может перейти в другое, как голубоватый камен (азурит) переходит в красную медь, то какова же истинная природа вещества? Что представляет собой это вещество – камень или медь или ни то и ни другое? Любое ли вещество переходит в другое вещество (хотя бы постепенно), и если любое, то не являются ли все вещества разными вариантами одного и того же основного вещества? На последний вопрос Фалес отвечал утвердительно и оставалось только решить, что же является этим веществом. Для Фалеса этим веществам являлась вода.
Вода окружает сушу, насыщает воздух парами, пробивается через землю ручьями и реками, и самое главное – без воды невозможна сама жизнь. Фалес в принципе представлял себе Землю как плоский диск, накрытый полусферической крышкой и плывущий в бесконечном океане.
Учение Фалеса было подхвачено другими философами, оставался лишь вопрос: действительно ли первовеществом является вода.
Так, древнегреческий философ Гераклит, предполагал, что первоосновой является огонь. Анаксимен, считал, что это воздух.
Эмпедокл считал, что это земля. Точнее он добавил в эту систему землю и сказал, что вообще все четыре элемента являются первовеществом, но тогда никто не воспринял его теорию всерьез.
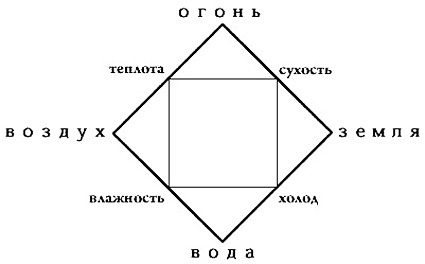
В итоге все споры о природе вещества выделились в две основные теории: это теория Аристотеля о 4-х элементах и атомистическая теория Демокрита.
О чем же были эти теории?
По Аристотелю мы имеем: единую, неделимую, бесконечную первоматерию, которая обладает определенными качествами сухость, тепло, влажность и холод. И при сочетании этих четырех качеств она проявляет себя в различных элементах. Например, при сочетании тепла и сухости получается огонь. И любое вещество, вообще вся вселенная состоит при комбинации вот этих четырех элементов.
Вывод о наличие того или иного элемента в теле делался на основе чувственного опыта, т.е., например, что-то горючее содержит в себе огонь, а что-то текучее воду и т.д.
Также важной мыслью в теории Аристотеля было то, что одно вещество может переходит в другое вещество, в последствии в алхимический период это стало называться трансмутацией.
Такова была теория Аристотеля.
Что же нам говорил атомизм.
Это была совершенно другая концепция и совершенно другой подход к мысли. Большинство воззрений атомистов дошли до нас благодаря поэме Лукреция Кара «О природе вещества». Родоначальником атомистической теории считается Левкипп, впоследствии его теория была развита его учеником Демокритом.
Демокрит утверждал, что вся вселенная состоит из маленьких неделимых частей атомов и пустоты. Атомы двигаются в этой пустоте, сталкиваются и образуют вещество и соединяются они за счет наличия каких-нибудь зубцов или крючков.
Концепцию атомизма было очень сложно доказать. Если теория Аристотеля о 4х элементах была логически совершенная, и также ее можно было доказать чувственным опытом: т.е. вот горячее там огонь, текучее там вода, все просто. То представить атомы было в то время очень сложно.
И вообще концепция атомизма противоречила тогда главенствующим в обществе идеям о том, какая должна быть первоматерия.
Все эти факты не сыграли на руку атомистической теории, и она была забыта вплоть до начала 17 века в то время как теория Аристотеля о 4х элементах получила широкое распространение в эллинистический период и средние века.
Атомы металлов, снятые на микроскоп с апертурной решеткой
Почему атомы взаимодействуют между собой, или как работает химия.
Всем привет. В своё время меня просто поразило, когда я узнал, почему же атомы взаимодействуют между собой. Вот сегодня, я хочу с вами этим поделится.
Дело в том, что атомы несовершенны. И они, стремясь к гармонии, ищут того, с кем они это могут сделать. Звучит поразительно, но на деле всё так и есть, а теперь подробней.
Для начала давайте посмотрим, как устроен атом. Он довольно сильно похож на солнечную систему. Внутри у него массивное ядро, а вокруг летают относительно маленькие электроны. Поподробней рассмотрим самый простой атом во вселенной – атом водорода. Ядро у него в подавляющем большинстве случаев представляет обычный протон. Массивную положительно заряженную частицу. А электрончик заряжен отрицательно, вспомнив что разноимённо заряженные частицы притягиваются, понимаем почему электрон вокруг протона крутится, он попросту притягивается кулоновскими силами.
Теперь частности. Порой, это происходит довольно редко, в ядре водорода присутствует не только протон, но и ещё одна массивная частица – нейтрон. Она не имеет заряда, а имеет только массу, примерно такую же, как и протон. И мы получаем атом водорода, который весит вдвое больше, чем его собрат из первого примера, но обладает теми же химическими свойствами.
Такие атомы одно и того же элемента которые отличаются только массами называются крутым словом – изотоп. Обычно для них не придумывают отдельных названий, просто говорят уран 235 или уран 238. Но для водорода сделали исключения и все три его возможных изотопа имеют свои имена, протий – одинокий протон, дейтерий – протон + нейтрон, и тритий – протон + два нейтрона.
О том сколько и каких изотопов на нашей земле, мы можем примерно узнать из таблицы Менделеева, достаточно посмотреть на относительную атомную массу, которая написана рядышком с каждым элементом
Для водорода это 1,00794. Атомная масса чистого протона + электрон немного меньше. Разница получается от того, что в природе есть изотопы. Взяли миллион атомов взвесили их, но не в килограммах, а в относительных атомных массах, которая равна кстати 1/12 массы изотопа углерода С12, а потом результат разделили на миллион и получили 1,00794. Другими словами, это число сумма масс изотопов, умноженных на их процентное содержание на земле.
Теперь подробней об атомах. Электроны крутятся вокруг ядра, но не где захотят, а только на особых орбитах, которые называются энергетические орбитали. И вот здесь начинается самое интересное. Орбитали представляют собой концентрические сферы, т.е одна внутри другой, как матрёшки, а внутри есть ещё такая штука как подуровень. И у каждого подуровня есть максимальное количество атомов, которые он может уместить внутри, также есть определённые правила заполнения. Если атом имеет полностью завершённую внешнюю орбиталь, то он – совершенный. Ему вообще ничего не нужно, он и сам по себе крутой. Он вообще не будет участвовать в химических реакциях (ну или делает это крайне неохотно). В химии такие атомы называют – благородными, или инертными. Это, например гелий, неон аргон.
Остальным атомам, которые имеют незавершённые подуровни энергетических орбиталей, тоже хочется совершенства, и они начинают взаимодействовать друг с другом. Самый простой пример может нам показать атом тот же атом водорода, у которого вокруг ядра болтается одинокий электрон. Его внешняя энергетическая орбиталь может вместить два, а потому он несовершенен. И он ходит вокруг, ищет такого же бедолагу, с которым можно задружится. При встрече с другим атомом водорода, они соединяются. Их электроны теперь не принадлежат одному, а одновременно обоим атомам, и вроде теперь на энергетической орбитали каждого из них по два электрона. Они теперь счастливы. Они теперь не атомы, вместе они стали молекулой. Это молекула довольно гармонична и каждый атом участник обладает одинаковыми правами, потому что тянет к себе электрон с одинаковой силой. Такая связь атомов называется ковалентная неполярная.
Я немного слукавил, говоря о том, что кислороду нужно раздать 6 электронов, я не упомянул о подуровнях. У него есть возможность отдать только два электрона чтобы получить завершённость подуровней. Но таких профитов как при полностью завершённой внешней орбитали он не получит, поэтому делает так крайне неохотно.
Ещё более жестокий пример, когда атому не хватает всего одного электрона на внешней орбитали и он хочет принять этот электрон очень сильно, а другой так же сильно хочет его отдать. В этом случае мы получаем ситуацию, когда один атом совсем отбирает электрон у другого, и два этих атома держатся друг около друга за счёт электромагнитных сил. В этом случае говорят о ионной связи. Самый яркий пример такой связи — это молекула обычной соли NaCl.
В целом желание атомов завершить свою орбиталь и образует всё многообразие химических реакций, дальше частности.
Не путайте химические реакции с реакциями синтеза или распада, при которых получаются не новые химические вещества, а новые элементы таблицы Менделеева. Об этом я обязательно расскажу ка нибудь в другой раз.