Как называется mgo в химии
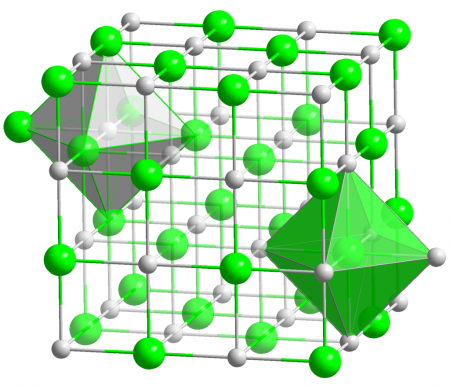
Оксид магния
| Оксид магния | |
|---|---|
 |
|
| Систематическое наименование |
Оксид магния |
| Традиционные названия | Жжёная магнезия, периклаз, асбест |
| Хим. формула | MgO |
| Рац. формула | MgO |
| Состояние | твёрдое |
| Молярная масса | 40,3044 г/моль |
| Плотность | 3,58 г/см³ |
| Т. плав. | 2825 °C |
| Т. кип. | 3600 °C |
| Энтальпия образования | -601,8 кДж/моль |
| Давление пара | 0 ± 1 мм рт.ст. |
| Растворимость в воде | 0,86 г/100 мл |
| ГОСТ | ГОСТ 844-79 ГОСТ 4526-75 |
| Рег. номер CAS | 1309-48-4 |
| PubChem | 14792 |
| Рег. номер EINECS | 215-171-9 |
| SMILES | |
| Кодекс Алиментариус | E530 |
| RTECS | OM3850000 |
| ChEBI | 31794 |
| ChemSpider | 14108 |
| Приводятся данные для стандартных условий (25 °C, 100 кПа), если не указано иного. | |
Оксид магния (жжёная магнезия) — химическое соединение с формулой MgO, белые кристаллы, малорастворимые в воде, пожаро- и взрывобезопасен.
Основная форма — минерал периклаз.
Содержание
Физические свойства
Легкий, рыхлый порошок белого цвета, легко впитывает воду. На этом свойстве основано его применение в спортивной гимнастике: нанесенный на ладони спортсмена, порошок предохраняет его от опасности сорваться с гимнастического снаряда. Температура плавления — 2825 °C. Температура кипения — 3600 °C. Плотность=3,58 г/см3.
Химические свойства
Реагирует с разбавленными кислотами с образованием солей, плохо — с холодной водой, образуя Mg(OH)2:
С горячей водой реагирует лучше, реакция идет быстрее.
Получение
Оксид магния получают обжигом минералов магнезита и доломита.
CaCO3 ∗ MgCO3 → MgO + CaO + 2CO2 MgCO3 → MgO + CO2 
Применение
В промышленности применяется для производства огнеупоров, цементов, очистки нефтепродуктов, как наполнитель при производстве резины, наполнитель в ТЭНах. Сверхлегкий оксид магния применяется как очень мелкий абразив для очистки поверхностей, в частности, в электронной промышленности.
В медицине применяют при повышенной кислотности желудочного сока, так как она обусловливается избыточным содержанием соляной кислоты. Жжёную магнезию принимают также при случайном попадании в желудок кислот.
В пищевой промышленности зарегистрирован в качестве пищевой добавки E530.
Является абсолютным отражателем — веществом с коэффициентом отражения, равным единице в широкой спектральной полосе. Может применяться как доступный эталон белого цвета.
Оксид магния: способы получения и химические свойства
Оксид магния MgO — бинарное неорганическое вещество . Белый, тугоплавкий, термически устойчивый, не реагирует с водой. Проявляет основные свойства.
Относительная молекулярная масса Mr = 40,3; относительная плотность для тв. и ж. состояния d = 3,62; tпл ≈ 2825º C; tкип = 3600º C.
Способ получения
1. Оксид магния получается при разложении карбоната магния при температуре 350 — 650º C. В результате разложения образуется оксид магния и углекислый газ:
2. В результате разложения нитрата магния при температуре выше 300º С образуется оксид магния, оксид азота (IV) и кислород:
3. Гидроксид магния разлагается при 350-480º С с образованием оксида магния и воды:
4. Оксид магния можно получить путем разложения сульфата магния при температуре выше 1200º C, образуется оксид магния, кислород и оксид серы (IV):
5. Оксид магния можно получить сжиганием магния в в кислороде при 600 — 650º С:
2Mg + O2 = 2MgO
Химические свойства
1. Оксид магния реагирует с простыми веществами :
1.1. В результате реакции между оксидом магния и кальцием при температуре выше 400º С образуется магний и оксид кальция:
MgO + Ca = CaO + Mg
1.2. Оксид магния реагирует с углеродом при температуре выше 2000º С и образует магний и угарный газ:
MgO + C = Mg + CO
2. Оксид магния взаимодействует со сложными веществами:
2.1.1. О ксид магния с разбавленной соляной кислотой образует хлорид магния и воду:
MgO + 2HCl = MgCl2 + H2O
2.3. Оксид магния взаимодействует с водой при 100 — 125º С, образуя гидроксид магния:
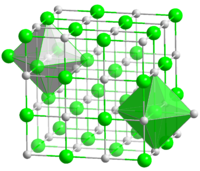
Оксид магния
| Оксид магния | |
 |
|
 |
|
| Общие | |
|---|---|
| Систематическое наименование | Оксид магния |
| Традиционные названия | Жжёная магнезия, периклаз |
| Химическая формула | MgO |
| Физические свойства | |
| Состояние (ст. усл.) | твёрдое |
| Отн. молек. масса | 40,3044 а. е. м. |
| Молярная масса | 40,3044 г/моль |
| Плотность | 3,58 г/см³ |
| Термические свойства | |
| Температура плавления | 2825 °C |
| Температура кипения | 3600 °C |
| Химические свойства | |
| Растворимость в воде | 0,86 г/100 мл |
Окси́д ма́гния (жжёная магнезия, периклаз) — химическое соединение с формулой MgO, белые кристаллы, нерастворимые в воде, пожаро- и взрывобезопасен.
Основная форма — минерал периклаз.
Содержание
Физические свойства
Легкий, рыхлый порошок белого цвета, легко впитывает воду. На этом свойстве основано его применение в спортивной гимнастике, нанесенный на ладони спортсмена, порошок предохраняет его от опасности сорваться с гимнастического снаряда. Температура плавления — 2825 °C.температура кипения — 3600 °C.Плотность=3,58 г/см3.
Химические свойства
Легко реагирует с разбавленными кислотами и водой с образованием солей и Mg(OH)2:

Получение
Оксид магния получают обжигом минералов магнезита и доломита.
Применение
В промышленности применяется для производства огнеупоров, цементов, очистки нефтепродуктов, как наполнитель при производстве резины. Сверхлегкая окись магния применяется как очень мелкий абразив для очистки поверхностей, в частности, в электронной промышленности.
В медицине применяют при повышенной кислотности желудочного сока, так как она обусловливается избыточным содержанием соляной кислоты. Жжёную магнезию принимают также при случайном попадании в желудок кислот.
Является абсолютным отражателем — веществом с коэффициентом отражения, равным единице в широкой спектральной полосе. Может применяться как доступный эталон белого цвета.
См. также
Литература
Полезное
Смотреть что такое «Оксид магния» в других словарях:
Оксид магния(II) — Оксид магния Оксид магния (жжёная магнезия, периклаз), MgO бесцветные кристаллы, нерастворимые в воде, пожаро и взрывобезопасен. Основная форма минерал периклаз. Содержание 1 Свойства 2 … Википедия
Оксид магния (II) — Оксид магния Оксид магния (жжёная магнезия, периклаз), MgO бесцветные кристаллы, нерастворимые в воде, пожаро и взрывобезопасен. Основная форма минерал периклаз. Содержание 1 Свойства 2 … Википедия
ОКСИД МАГНИЯ — (магнезия, MgO), белый нейтральный стойкий порошок, получающийся при горении магния в кислороде. Он используется в промышленности для производства огнеупорного кирпича и в медицине в желудочных порошках. Карбонат магния (МgСО3), который находится … Научно-технический энциклопедический словарь
оксид магния — жжёная магнезия магнезия (MgO) [http://slovarionline.ru/anglo russkiy slovar neftegazovoy promyishlennosti/] Тематики нефтегазовая промышленность Синонимы жжёная магнезиямагнезия EN magnesiamagnesium oxide … Справочник технического переводчика
ОКСИД МАГНИЯ — окись магния, магнезия (MgO) белый порошок; плотность 3570 кг/м3; tпл=2800°С; обладает основными свойствами. Применяют как огнеупорный материал и в качестве огеливателя при изготовлении керамических форм по постоянным моделям с этилсиликатным … Металлургический словарь
Магния окись — Оксид магния Оксид магния (жжёная магнезия, периклаз), MgO бесцветные кристаллы, нерастворимые в воде, пожаро и взрывобезопасен. Основная форма минерал периклаз. Содержание 1 Свойства 2 … Википедия
Магния карбонат основной — Магния карбонат (Magnesii carbonas) Химическое соединение ИЮПАК Карбонат магния Брутто формула MgCO … Википедия
Оксид-сульфат титана — Общие Систематическое наименование Оксид сульфат титана Традиционные названия Основной сернокислый титан; оксосульфат титана; сульфат титанила Химическая формула TiOSO4 Физические свойства … Википедия
Оксид золота(III) — Общие … Википедия
Оксид алюминия — Общие … Википедия
Оксид магния, свойства, получение, химические реакции
Оксид магния, свойства, получение, химические реакции.
Оксид магния – неорганическое вещество, имеет химическую формулу MgO.
Краткая характеристика оксида магния:
Оксид магния – неорганическое вещество белого цвета.
Так как валентность магния равна двум, то оксид магния содержит один атом кислорода и один атом магния.
Химическая формула оксида магния MgO.
Оксид магния представляет собой лёгкий, рыхлый порошок, легко впитывает воду.
Оксид магния плохо растворяется в воде, вступает с ней в реакцию. Не растворяется в этаноле.
Встречается в природе в виде минерала периклаз.
Оксид магния может вызывать раздражение слизистых глаз и носа. При работе с препаратом следует применять индивидуальные средства защиты (респираторы типа «Лепесток», резиновые перчатки, защитные очки), а также соблюдать правила личной гигиены.
Помещения, в которых проводятся работы с оксидом магния, должны быть оборудованы общей приточно-вытяжной вентиляцией. См. ГОСТ 4526-75 Реактивы. Магний оксид. Технические условия (с Изменением N 1).
Пожаро- и взрывобезопасен.
Физические свойства оксида магния:
| Наименование параметра: | Значение: |
| Химическая формула | MgO |
| Синонимы и названия иностранном языке | magnesium oxide (англ.) |
магнезия жженая (рус.)
магния окись (устар. рус.)
Получение оксида магния:
Он получается в результате химической реакции – термического разложения карбоната кальция и карбоната магния:
CaCO3·MgCO3 → CaО + MgО + СО2 (t = 900-1200 o C);
MgCO3 → MgО + СО2 (t > 650 o C);
CaCO3 → CaО + СО2 (t = 900-1200 o C).
MgCO3 – химическая формула магнезита.
Это промышленный способ получения оксида магния.
Оксид магния востребован в промышленности, пищепроме и медицине
Оксид магния — неорганическое соединение с 
Вещество встречается в естественном виде в качестве достаточно редкого минерала периклаза. В промышленном производстве MgO получают:
• обработкой природного сырья: доломита и магнезита;
• разложением сульфата магния MgSO4 при высоких температурах;
• разложением белой магнезии 3MgCO3×Mg (OH)2×3H2O или карбоната магния MgCO3.
Свойства
Внешне оксид магния — мягкое, легкое, рыхлое, мелкокристаллическое порошкообразное вещество белого или светло-серого цвета, без запаха, со слегка землистым вкусом. Очень хорошо поглощает воду, но само в воде почти не растворяется. Не растворяется в спиртах; поглощает жиры и жидкие вещества. Не слеживается, не комкуется, хорошо пересыпается, но пыли не образует. При нагревании свыше +2000 °С становится летучим. Плавится при температурах около +3000 °С. Способно гореть, не взрывается, не токсично.
Тонкий рыхлый порошок хорошо поглощает влагу и углекислоту из воздуха. Активно реагирует с кислотами с образованием солей магния. В реакции с водой образует гидроксид магния Mg(OH)2. Разрушается в химических реакциях с трифторидом брома BrF3, пентахлоридом фосфора PCl5. Если магнезию прокалить, то она перестает поглощать воду и взаимодействовать с кислотами.
 |
 |
 |
| Банка для реактивов 2000 мл, с делениями | Магний углекислый | Респиратор пылезащитный ЛЕПЕСТОК Л-200 до 4ПДК |
Меры предосторожности
Реактив малоксичен, но способен вызывать раздражение при прямом контакте с глазами, органами дыхания; проглатывание способно привести к расстройству работы кишечника. Возможны аллергические реакции в случае индивидуальной непереносимости.
Рабочее место для работы с оксидом магния должно располагаться в помещении с принудительной системой вентиляции. Сотрудники должны использовать маски или респираторы, очки для защиты органов дыхания и глаз, а также резиновые перчатки. На рабочем месте запрещается курить.
Фасуют и перевозят реагент в герметично запаянных пластиковых или многослойных бумажных мешках. Следует строго следить за целостностью упаковки, так как продукт активно поглощает влагу из окружающей среды.
Хранят магнезию на сухих, хорошо вентилируемых складах, защищающих от прямых солнечных лучей. Размещать вещество следует вдали от отопительных приборов, кислот, галогенов. В лабораториях ее хранят в герметичной стеклянной или пластиковой посуде с притертой или завинчивающейся пробкой.
Применение
Промышленность выпускает несколько видов жженой магнезии, которые отличаются своими потребительскими свойствами: весу, химической активности, способности к сорбции и т.п.
• Сорта магнезии, характеризующиеся высоким весом, используются для изготовления огнеупорных материалов.
• Среднетяжелые сорта востребованы в строительной индустрии для получения различных огнестойких стройматериалов (ксилит, бетон) и магнезиальных цементов.
• Сорта с небольшим весом применяются в качестве сорбента для очистки производных нефти; как наполнитель в резинотехнической индустрии, наполнитель в ТЭНах.
• Легкая жженая магнезия используется в медицине для снижения кислотности желудочного сока, для стимуляции мускулатуры кишечника как слабительное средство, для профилактики образования камней в почках, при отравлениях кислотами, в качестве противовоспалительного средства при заболеваниях органов ЖКТ.
• В фармацевтике входит в состав минеральных и витаминных комплексов с магнием.
• Легкая магнезия в пищепроме — разрешенная в ЕС и РФ 
• В косметической индустрии — стабилизатор, абсорбент, буферное вещество при изготовлении пудр, румян, тальков и других сыпучих продуктов. Используется в декоративной косметике, в солнцезащитных кремах, масках для лица и волос, средствах от черных точек, шампунях, дезодорантах, детских присыпках и пр.
• Мелкодисперсионная легкая магнезия применяется на предприятиях радиоэлектроники в качестве абразива тонкой очистки.
• В спорте — противоскользящая присыпка для рук спортсменов и альпинистов.
• Используется как эталон белого цвета, обладает абсолютной отражаемостью в широком диапазоне спектра.
• Реактив входит в состав защитного слоя ЖК-экранов; используется в производстве бумаги; востребован на предприятиях переработки отходов для контроля за растворимостью радионуклидов.
• В сельском хозяйстве — антислеживающая добавка в удобрения; самостоятельное магниесодержащее удобрение и кормовая добавка для животных при недостатке магния на пастбищах.














