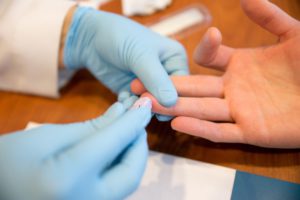
Как набрать кровь в шприц
Алгоритм взятия капиллярной крови из пальца
Возможности метода
Клинический анализ капиллярной крови включает в себя определение концентрации гемоглобина, количества эритроцитов, лейкоцитов и тромбоцитов, величины гематокрита и эритроцитарных индексов (MCV, RDW, MCH, MCHC),формулу крови (процентное соотношение различных видов лейкоцитов (нейтрофилы, лимфоциты, эозинофилы, моноциты, базофилы)). Дополнительно, в случае необходимости, измеряется скорость оседания эритроцитов( СОЭ).
При проведении профосмотров и диспансеризаций по капиллярной крови измеряют содержание глюкозы и проводят экспресс-тесты уровня холестерина.
Подготовка к исследованию
Процедуру проводят в утренние часы, обычно с 8.00 – до 10:00, – натощак: предыдущий прием пищи накануне вечером должен быть минимум за 12 часов до взятия. С утра в день исследования можно только пить воду.
За несколько дней до анализа желательно исключить из рациона жирную пищу и алкоголь. Также рекомендуется временно ограничить физические нагрузки, по возможности высыпаться и избегать стрессов. Перед процедурой крайне не рекомендовано курить.
Правила взятия капиллярной крови
Инструмент
Палец прокалывают одноразовым стерильным скарификатором – это исключает риск инфицирования. Размер иглы или лезвия подбирается индивидуально, в зависимости от возраста и физических (физиологических) особенностей пациента. Современные автоматические скарификаторы снижают и болевые ощущения, и волнение пациента.
Выбор места взятия крови
Выбирают неохлажденный, не цианотичный, не отечный палец, Прокол лучше делать у кончика IV пальца левой руки (у правшей). Можно прокалывать II и III пальцы. Если руки у пациента холодные, то перед проведением прокола их нужно обернуть на 10—15 мин довольно горячим полотенцем. Чтобы усилить кровоток, нежно массируют палец от основания к кончику. Тампоном, смоченным спиртом, тщательно обрабатывают кончик пальца и дают поверхности просохнуть.
У новорожденных и детей до 1 года капиллярную кровь набирают из пятки. Методика взятия крови из пятки во многом схожа с методикой взятия крови из пальца. Глубокий укол пятки выполняют у дистального края пяточной кости, предварительно подогрев стопу в теплой воде
Правила забора биологического материала для иммунологических исследований
ГУЗ «Кемеровская областная клиническая больница»
Правила забора биологического материала
для иммунологических исследований
Н.Б. Миловидова – к.м.н. заведующая эпидемиологическим отделом ГУЗ КОКБ;
Е.Б. Лукоянычева–заведующая иммунологической лабораторией ГУЗ КОКБ.
© ГУЗ «Кемеровская областная клиническая больница», 2008г
Данное методическое пособие предназначено для медицинских сестер Кемеровской областной клинической больницы.
Методическое пособие поможет правильно произвести забор биологического материала и оформить сопроводительные документы.
Правильно произведенный забор биологического материала и правильно оформленные направления исключат ошибку на преаналитическом этапе исследования.
Формы сопроводительных документов составлены так, чтобы сократить время медицинской сестры, затрачиваемое на оформление направлений.
Необходимо, чтобы образцы крови были правильно взяты и вовремя доставлены в лабораторию. Нарушения, допущенные на преаналитическом этапе, могут повлиять на результат исследования и его дальнейшую интерпретацию.
Раздел 1.
Общие правила забора биологического материала и оформления сопроводительных документов
Перед забором крови пациенту следует сообщить:
1. На какой вид исследования будет проводиться забор крови.
2. Требования необходимые для данного исследования.
Порядок забора венозной крови
1. Исследование проводится утром натощак, последний прием пищи за 12 часов до взятия крови.
2. Исключение приема алкоголя не менее чем за 24 часа до взятия крови.
3. Утренний прием лекарственных препаратов, лечебно-диагностических процедур (массаж, ЭКГ, физиотерапевческое лечение и др.) проводится после взятия крови.
5. Пациент перед процедурой должен находиться в покое, сидеть или лежать не менее 5 минут.
6. Продолжительность пережатия сосудов жгутом должна составлять не более 1 минуты.
7. Нельзя просить работать пациента кулаком и массировать предплечье по ходу вен.
Раздел 2
Технология забора крови из периферической вены для лабораторного исследования
подготовить на манипуляционном столе стандартный набор для забора крови из периферической вены, проверив целостность упаковок и сроки годности:
1. лоток для использованных материалов;
2. пробирки для крови;
3. упаковка с 2-мя стерильными салфетками (5х5см) или 4-5 шариками;
5. кожный спиртовой антисептик во флаконе с дозатором;
сделать необходимые надписи на пробирках;
оформить сопроводительные документы в лабораторию;
обеспечить удобное освещение;
помочь пациенту найти удобное положение;
разъяснить пациенту суть предстоящей процедуры, создавая атмосферу доверия, предоставляя возможность задать вопросы;
обработать руки спиртовым антисептиком;
вскрыть упаковки со стерильными материалами;
руку больного уложить в положении максимального разгибания, для чего под руку следует положить валик, имеющий влагостойкое покрытие.
выбрать вену для венепункции;
обработать место венепункции кожным антисептиком и дать высохнуть самостоятельно;
Не пальпируйте вену повторно!
надеть на стерильный шприц иглу;
снять с иглы защитный колпачок;
пальцами левой руки фиксировать кожу над веной;
ввести под кожу иглу срезом вверх под углом 30-40 0 ;
установить иглу параллельно вене и быстрым движением проколоть ее стенку;
иглу продвинуть немного вверх по длине вены;
набрать необходимое количество крови в шприц
— запрещается забор крови свободным кровотоком из иглы в пробирку, а также присоединение к игле нового шприца;
— для безопасного забора крови предпочтительно использовать вакуумный шприц-контейнер.
иглу извлечь из вены;
прижать место венепункции стерильной салфеткой на 2-3 минуты;
осторожно, предупреждая разбрызгивание крови, вылить содержимое шприца через иглу в одну или несколько пробирок.
набрать из емкости «Для дезинфекции инструментов» дезинфицирующий раствор через иглу в шприц;
вставить иглу в специальное отверстие контейнера «Для дезинфекции режущего и колющего инструментария» и, повернув ее, отделить от шприца и оставить в нем в растворе дезинфектанта;
Раздел 3
Правила взятия венозной крови с помощью закрытой системы (вакуумного шприца-контейнера)
полностью исключается контакт медперсонала с кровью на всех этапах взятия крови и ее транспортировки;
особо прочный пластик закрытых систем позволяет осуществить безопасную доставку крови на любые расстояния;
благодаря наличию широкого спектра пробирок с заранее добавленными реагентами для различных видов анализов (ЭДТА для гематологии, цитрат натрия для коагулогии, активатор свертывания для получения сыворотки), значительно облегчается работа медсестер и лаборатории. Международная цветовая маркировка предотвращает их не правильное применение;
уменьшается количество ошибочных анализов, связанных с неправильным взятием проб крови и неверным соотношением реагентов.
закручивающаяся крышка предотвращает «аэрозольный эффект» при открывании;
1. Надеть иглу на контейнер и закрепить легким поворотом по часовой стрелке. Провести пункцию вены.
1. Провести пункцию вены иглой. Благодаря защитной мембране кровь из иглы не вытекает.
2. Медленно оттягивая поршень, наполнить контейнер кровью. После заполнения кровью контейнер вместе с иглой вынуть из вены. Поршень зафиксировать в конечном положении до характерного щелчка. В случае взятия нескольких образцов крови, контейнер отсоединить. Иглу оставить в вене и на нее надеть следующий контейнер.
2. Создать вакуум в контейнере.
Для этого отвести поршень в конечное положение (до характерного щелчка) и отломить его
3. По окончании взятия крови, шток поршня обломить. Вы получаете транспортный контейнер с кровью и антикоагулянтом или готовую пробирку для сепарации сыворотки.
3. Насадить контейнер на иглу. Взятие крови осуществляется под действием вакуума. В этом случае вы также получаете транспортный контейнер с кровью и антикоагулянтом или готовую пробирку для сепарации сыворотки.
Транспортировка образцов крови
Транспортировка образцов крови должна осуществляться при комнатной температуре (18-25 град. C). Избегайте замораживания или перегревания образцов, так как нарушение температурного режима может повлиять на результаты. После забора крови образцы должны быть доставлены в лабораторию как можно скорее. При транспортировке образцы должны находиться в вертикальном положении.
При транспортировке образца внутри лечебно-диагностического учреждения, пробирки с кровью должны находиться в контейнере, который в случае повреждения пробирки будет предотвращать разлитие крови.
Порядок доставки крови в лаборатории
наружные части контейнера двукратно с интервалом в 15 минут протереть дезинфицирующим средством (концентрация по режиму для вирусных гепатитов);
доставить контейнер в лабораторию;
вынимать образцы крови из контейнера только в перчатках!
после возвращения из лаборатории контейнер вновь двукратно с интервалом в 15 минут протереть дезинфицирующим средством (концентрация по режиму, предусмотренному для гемоконтактных вирусных гепатитов).
Требование к маркировке пробирок.
Маркировку пробирок и заполнение сопроводительных документов следует проводить аккуратно и четко.
Фамилию, имя, отчество пациента писать четко и разборчиво.
В направлении заполнять все графы.
Не допускается, чтобы этикетка на пробирке была размыта, порвана или плохо приклеена.
Направления заполнять в соответствии с приложениями № 1-12
Популярные ошибки при постановке внутривенных уколов
Эта статья из рубрики «Внутривенные уколы» от автора Елистратова Е.В. (является практикующим хирургом) поможет вам правильно подготовиться к процедуре и избежать ошибок при постановке инъекций. Давайте разберемся, почему уколы внутривенные ставят в вену, в особенностях манипуляций и чем опасно неправильное введение раствора.
Содержание
Показания к постановке внутривенных уколов и места введения инъекций
Внутривенное введение медикаментов практикуют при необходимости получения быстрого эффекта от препарата. Также инъекции в вену назначают в случаях, когда лекарственный раствор запрещен для подкожного применения из-за сильного раздражающего действия.
Если требуется постановка внутривенной инъекции, учитывайте, что препараты вводят в вены, которые расположены близко под кожей. Наши специалисты ДокторМос знают особенности введения укола для каждой зоны. К наиболее популярным местам внутривенных инъекций относятся:
Список зон
Примечания
Область является наиболее популярной для проведения манипуляций.
Место считается вторым по популярности и используется, когда вены на локтевом сгибе плохо прощупываются.
Тыльная сторона кисти
Зона используется только в случаях, если введение инъекции невозможно первыми двумя методами.
Область чаще применяется для введения лекарственных средств в вену грудничкам.
Перед процедурой исключите наличие флебита, атрофии мышц и повреждения тканей в области вены. Учтите, что запрещено проводить инъекции самостоятельно, их делает только медсестра. На внутривенный укол цена доступная, поэтому экономить на услугах специалиста не стоит.
Взывать медсестру
Подготовка к процедуре
Давайте разберемся, что необходимо для проведения процедуры. Качество постановки инъекции зависит не только от знания тонкостей введения лекарства в вену, но и соблюдения всех условий подготовки пациента и рабочего места.
Подготовка пациента
Наши специалисты ДокторМос первоначально исключают вероятность развития аллергии на препарат. При повышенной чувствительности к составу инъекция может оказаться смертельно опасной. Дополнительно уточняется информация о времени приема пищи пациентом (так как некоторые препараты можно использовать на «пустой» или полный желудок).
Организация рабочего места
Правильно подготовленная рабочая зона снижает риск развития осложнения от уколов примерно на 50%. Поэтому перед началом манипуляций убедитесь, что место проведения процедуры соответствует требованиям:
Постановка внутривенного укола начинается с проверки готовности рабочего пространства и срока годности медикамента.
Этапы манипуляций
Для слаженности действий производите процесс введения инъекции по пунктам:
Точное соблюдение последовательности действий снижает риск развития осложнения на 90%. При этом учитывайте, что осуществлять процедуру может только медсестра. ДокторМос советует не экспериментировать и не делать инъекции самостоятельно.
Как набрать кровь в шприц
Кафедра лабораторной диагностики Института последипломного образования Башкирского государственного медицинского университета Минздрава России
ООО «Адвенсум», Москва
Научно-исследовательский институт скорой помощи им. Н.В. Склифосовского, Москва
компания BD Life Sciences, Москва
Мытищинская Городская Клиническая больница, г. Мытищи
клинико-диагностическая лаборатория ФГБУ «ФЦ ССХ» Минздрава России, Красноярск
Особенности взятия и пробоподготовки биоматериала для лабораторных исследований при неотложных состояниях
Журнал: Лабораторная служба. 2015;4(3): 19-24
Гильманов А. Ж., Кишкун А. А., Годков М. А., Сашков В. А., Зубкова Н. В., Грищенко Д. А. Особенности взятия и пробоподготовки биоматериала для лабораторных исследований при неотложных состояниях. Лабораторная служба. 2015;4(3):19-24.
Gil’manov A Zh, Kishkun A A, Godkov M A, Sashkov V A, Zubkova N V, Grischenko J A. Main rules for blood and urine sampling in emergency departments. Laboratory Service. 2015;4(3):19-24.
https://doi.org/10.17116/labs20154319-24
Кафедра лабораторной диагностики Института последипломного образования Башкирского государственного медицинского университета Минздрава России
Рассмотрены основные подходы к организации преаналитического этапа в отделениях неотложной помощи. Детально описана процедура взятия биологических образцов для проведения лабораторных исследований (венозной и артериальной крови, мочи) на основе современных мировых стандартов и с учетом специфики отделений неотложной помощи.
Кафедра лабораторной диагностики Института последипломного образования Башкирского государственного медицинского университета Минздрава России
ООО «Адвенсум», Москва
Научно-исследовательский институт скорой помощи им. Н.В. Склифосовского, Москва
компания BD Life Sciences, Москва
Мытищинская Городская Клиническая больница, г. Мытищи
клинико-диагностическая лаборатория ФГБУ «ФЦ ССХ» Минздрава России, Красноярск
Пробоподготовка и транспортировка биоматериала для лабораторных исследований при неотложных состояниях имеют целый ряд нюансов в силу требуемой срочности диагностики. К ним относятся особенности терапии пациентов реанимационных отделений, катетеризация вен и мочевого пузыря, а также частота взятия биологического материала на исследование в течение суток. Эти факторы наряду с рядом других (выбор типа биологического материала для исследования, метод его взятия, правильная и своевременная доставка в лабораторию) могут оказывать существенное влияние на качество результатов анализов.
Однако преаналитическому этапу не всегда уделяется должное внимание со стороны врачей-клиницистов и среднего медицинского персонала отделений неотложной помощи. Вместе с тем без глубокого понимания важной роли этих факторов в обеспечении качества результатов анализов невозможно улучшить качество диагностики и лечения больных, находящихся в критических состояниях. Исследования многих лечебно-профилактических учреждений показывают, что вследствие лабораторных ошибок до 6% пациентов могут получать неправильное лечение, которое может привести к ухудшению состояния здоровья, а примерно 19% больным назначаются ненужные дополнительные исследования [7], подразумевающие удлинение сроков лечения и пребывания их в стационаре. Именно поэтому в отделениях неотложной помощи необходимо уделять особое внимание условиям и способам взятия, времени хранения и доставки образцов биоматериала для исследований.
Так, одной из наиболее распространенных манипуляций в практике отделения неотложной помощи является катетеризация периферических и центральных вен. Каждый год в мире врачами устанавливается свыше 500 миллионов периферических и более 15 миллионов центральных венозных катетеров [2]. Катетеры широко используются в ситуациях, когда требуется частое или постоянное внутривенное введение лекарственных веществ [1]. Наряду с введением лекарственных препаратов через катетеры часто забирают образцы венозной крови для их последующего лабораторного исследования. Это особенно актуально при многократном взятии крови у пациентов реанимационных отделений, пациентов с низким давлением и спавшимися венами, а также у больных на гемодиализе и детей, поскольку при этом не нужно каждый раз пунктировать вену [11].
Частота взятия крови из катетера в реальных клинических ситуациях может сильно различаться. Согласно руководству А.А. Кишкуна [6], во избежание инфекционных осложнений кровь из катетера для клинико-лабораторных исследований рекомендуется брать не чаще 1 раза в день. Однако у пациентов отделений реанимации кровь зачастую приходится брать несколько раз в сутки, в ряде случаев — ежечасно. При этом для обеспечения доступа в сосудистое русло могут использоваться периферические и центральные венозные или артериальные катетеры, а также катетеры в центральных венах, введенные через периферические вены. Определение вида катетера для конкретного пациента зависит от вида оказания медицинских манипуляций и объема медицинской помощи. Для лабораторных исследований кровь можно брать как из центральных, так и из периферических сосудистых катетеров.
Существуют два основных способа взятия крови из катетера.
Способ трех шприцев. Первым шприцем из катетера отсасывается и отбрасывается небольшое количество крови (3—5 мл), смешанной с последним вводившимся через катетер раствором или гепарином; вторым шприцем отбирается кровь на лабораторное исследование; третьим — катетер заполняется раствором гепарина («гепариновый замок»). Одной из основных проблем при использовании этого способа является частый гемолиз в пробах, вызванный механическим «шоком» клеток крови при двукратном прохождении под давлением через узкую иглу. Гемолиз в образце представляет реальную опасность для пациента, поскольку может быть причиной ложных результатов тестов (искажение параметров коагуляции, завышение активности ЛДГ, АЛТ, АСТ, КК, уровня калия, сывороточного железа, а также некоторых гормонов, например, β-ХГЧ) и, соответственно, ошибок в диагностике и лечении. Это особенно критично в операционных и в отделениях реанимации и интенсивной терапии (ОРИТ), так как ведет к необходимости повторного взятия крови и потере времени.
Использование люэр- или люэр-лок-адаптера. В последние годы широкое распространение получают устройства безыгольного доступа, представляющие собой насадку с люэровской канюлей (адаптером), присоединяющейся к периферическому внутривенному катетеру. Люэр-адаптер с внутренней иглой вначале ввинчивается в держатель пробирки, а затем своей «люэровской» частью герметично вставляется в установленный ранее внутривенный катетер. Люэр-лок-адаптер, интегрированный в держатель, сразу присоединяется к внутривенному катетеру при помощи резьбового крепления. Преимуществом использования этих устройств является возможность взятия крови из катетера без использования иглы и шприца — напрямую в вакуумную пробирку. Это позволяет снизить риск гемолиза и нарушения соотношения крови и реагента, находящегося в пробирке, а также обеспечивает дополнительную защиту медицинского персонала от уколов иглой.
Дискуссионной остается возможность взятия крови из внутривенного катетера для исследования параметров гемостаза. Даже небольшое количество гепарина, которым заполняют катетер для предотвращения его тромбирования («гепариновый замок»), при попадании в образец крови может дать картину ложной гипокоагуляции по тестам АЧТВ, ПВ и ТВ. В соответствии с ГОСТ Р 53079.4−2008 из катетеров, обработанных гепарином, нельзя брать кровь для исследования свертывающей системы [12]. В других литературных источниках допускается взятие крови из катетера для исследования гемостаза, но при условии отбрасывания первых 5—10 мл крови, содержащих антикоагулянт или его следы. В любом случае, если для исследования свертывающей системы кровь берут из катетера, на бланке следует сделать пометку для предупреждения врачей о возможности изменения результатов анализа.
Моча является вторым (после крови) наиболее часто исследуемым биоматериалом для лабораторных исследований. Обычно исследуется моча, выделяемая естественным путем, — пациент собирает ее либо сам, либо с помощью медицинских работников или окружающих [10]. Однако не у всех пациентов неотложной помощи это возможно: при нарушении ее выведения, после оперативных вмешательств на органах урогенитального тракта, а также при тяжелом или критическом общем состоянии больного и пребывании его в ОРИТ во многих случаях производится катетеризация мочевого пузыря. В этих целях для единовременной либо постоянной эвакуации мочи в его полость по мочеиспускательному каналу вводится катетер [5]. При длительной катетеризации мочевого пузыря — от нескольких часов до одного месяца — используются катетеры Фолея [9]. В такой ситуации лабораторному исследованию подвергается моча, получаемая через катетер. Это требует соблюдения необходимых правил ее сбора и учета того, что свойства мочи могут отличаться от свойств мочи, полученной обычным путем. Поэтому в направлении на анализ следует обязательно указывать, что моча взята из катетера.
При естественном сборе мочи зачастую используется утренняя, наиболее концентрированная ее порция; именно для нее разработаны референсные значения большинства аналитов. Кроме того, в процессе естественного мочеиспускания первая порция мочи «промывает» мочеиспускательный канал, поэтому для анализа берется не она, а последующие, более «чистые» порции [13]. При получении мочи из катетера эти приемы становятся неактуальными: свойства мочи зависят не столько от времени суток, сколько от введения инфузионных растворов, лекарственных препаратов, состояния почек и других факторов, и по результатам анализа концентрация компонентов мочи, как правило, оказывается более низкой, чем обычно. Поскольку моча через катетер выходит напрямую из мочевого пузыря, минуя уретру, то она на порции не делится, и для клинических, биохимических и микробиологических исследований ее можно брать в любой момент времени.
Для взятия мочи из уже установленного катетера на современном этапе целесообразно использовать специальные мочевые вакуумные системы (аналоги вакуумных систем для взятия венозной крови), состоящие из двусторонней иглы (либо люэр/люэр-лок-адаптера), держателя, вакуумных пробирок с консервантом или без него. Их применяют двумя способами.
«Закрытый» способ. Наружную часть установленного катетера Фолея прокалывают иглой на держателе, затем в него вставляют вакуумную пробирку, и она заполняется мочой. Способ очень прост, но при его использовании существует риск прокола катетера насквозь и случайного укола иглой медицинского персонала, а после взятия мочи в катетере остается микроотверстие, которое может служить «воротами» для восходящего инфицирования мочевых путей.
Способ с использованием адаптера. Люэр-адаптер ввинчивается в держатель пробирки и затем герметично вставляется в катетер Фолея; люэр-лок-адаптер, встроенный в держатель, своим резьбовым креплением ввинчивается в катетер. Заполнение вакуумной пробирки мочой производится как обычно. Применение подобных устройств позволяет снизить риск контаминации образца и случайного укола иглой, а также сохранить целостность катетера, что увеличивает степень безопасности пациента за счет резьбового соединения.
Кислотно-щелочное состояние (КЩС) — еще один важнейший показатель гомеостаза организма, а его исследование — один из важнейших тестов, выполняемых для пациентов в ОРИТ. При сдвигах рН в клетках изменяется активность практически всех ферментов, что ведет к быстрым сдвигам метаболизма, снижению выработки энергии и развитию клеточного энергодефицита, и в конечном итоге к нарушению жизнедеятельности клеток, тканей, органов, систем органов и организма в целом. Оценивая динамику показателей КЩС, можно судить о тяжести патологии, динамике состояния пациента и адекватности терапевтических мероприятий. По утверждению Национального комитета клинических лабораторных стандартов — NCCLS (ныне CLSI — Институт клинических лабораторных стандартов США), результаты анализа КЩС являются более значимыми для оценки состояния и выбора тактики лечения пациента, находящегося в критическом состоянии, чем любой другой вид исследований [19].
Анализ КЩС относится к категории экспресс-исследований, поскольку его параметры быстро изменяются при любых сдвигах состояния пациента (показателей дыхания, температуры тела, физической активности, функции почек и т. д.) [3]. Диагностическое и прогностическое значение полученных ранее данных постоянно снижается, т. е. результаты анализа КЩС быстро устаревают. Поэтому важно, чтобы клиницист знал о текущем состоянии КЩС у пациента, а не оперировал данными, полученными несколько часов назад. Общее время выдачи результатов анализа КЩС по ряду наиболее критичных данных не должно превышать 15—30 мин.
Хотя параметры КЩС можно определять в крови любого типа — артериальной, капиллярной и венозной, для анализа принято брать артериальную кровь из-за большей стабильности ее газового состава и метаболических параметров. Так называемая капиллярная кровь, забираемая у взрослых из пальца или у маленьких детей из боковой поверхности пятки, на самом деле артериолярная — по составу близка к артериальной, но только при условии хорошего кровотока в конечности. В венозной крови содержатся продукты тканевого метаболизма; ее газовый состав менее постоянен, в значительной степени зависит от периферического кровотока и не обеспечивает «репрезентативности» в отношении целого организма [4, 14, 16, 19].
Ключевое значение для обеспечения надежности данных имеет преаналитический этап лабораторных исследований, который при анализе электролитов и КЩС имеет ряд важных особенностей: необходимо, чтобы состояние пациента было стабильным как минимум 20 мин (особенно после окончания или прерывания лечебных и диагностических процедур), а параметры дыхания оставались неизменными в течение хотя бы 5 мин до взятия крови, иначе показатели КЩС могут быть нестабильными и искаженными. Причинение боли во время взятия крови может вызвать гипервентиляцию и, соответственно, сдвиги результатов анализа, поэтому перед взятием артериальной крови желательно обезболить место пункции, например, лидокаином или специальным пластырем. Кроме того, перед взятием крови из лучевой артерии нужно убедиться в наличии кровотока по параллельно идущей локтевой артерии (у некоторой части пациентов он недостаточен). Это даст уверенность в сохранении кровоснабжения кисти руки даже после временной закупорки (тромбоза) лучевой артерии в месте пункции. Методика выполнения пробы Аллена включает одновременное прижатие обеих артерий на 10—20 с и наблюдение за порозовением кисти после освобождения локтевой артерии [8, 16, 19, 20]. При выполнении артериальной пункции очень важно также следить за тем, чтобы игла попала именно в артерию, но не в находящуюся по соседству вену. Примесь венозной крови в шприце может исказить уровень СО 2 (завышение) и особенно О 2 (занижение) [4, 16, 18—20]. В случае ошибочной пункции вены, непопадания в артерию, сквозного прокола сосуда и остановки тока крови не следует «искать» артерию движениями иглы, так как это причиняет сильную боль пациенту; лучше наложить давящую повязку и повторить взятие крови в другом месте.
В соответствии с рекомендациями CLSI для взятия крови на анализ КЩС в качестве антикоагулянта применяется сбалансированный по кальцию гепаринат лития в концентрации 50 IU/ml [19]. Использование ЭДТА или цитрата натрия для этих целей не рекомендуется, так как может значительно изменить pH пробы. Для взятия крови могут использоваться как обычные шприцы, которые предварительно ополаскивают раствором гепарина, либо специальные шприцы с напыленным на внутренние стенки сухим гепаринатом лития или натрия. В первом случае могут наблюдаться такие побочные эффекты, как непрогнозируемое разбавление пробы (влияет на уровень гемоглобина и электролиты), непредсказуемая концентрация гепарина в образце, возрастание концентрации ионов натрия, изменение уровня ионов кальция. Поэтому использование шприцов, гепаринизированных в заводских условиях, позволяет избежать разбавление образца, повысить качество и стабильность пробы. Кроме того, это позволяет минимизировать количество ручных манипуляций и сократить время подготовки к взятию пробы. Использование шприцов с гепаринатом лития препятствует ложному возрастанию уровня натрия в образце, а с гепарином, сбалансированным по кальцию, позволяет избежать ошибок при определении ионизированного кальция.
При взятии артериальной крови на анализ КЩС путем пунктирования артерии для избежания случайного укола медицинского работника иглой при ее отсоединении от шприца (перед постановкой пробы в анализатор) рекомендуется использовать безопасные иглы с защитными насадками, «нащелкивающимися» на иглу сразу после ее извлечения из кровеносного сосуда. Далее игла снимается со шприца, а его канюля (люэр- или люэр-лок) после удаления пузырьков воздуха герметично закрывается крышкой или резиновым колпачком. Если игла остается на шприце, для герметизации на нее может надеваться специальный эластичный кубик. Перед вводом пробы в аппарат колпачки и иглы со шприца снимаются. Шприцы для взятия артериальной крови имеют объем 1 или 3 мл и должны быть заполнены до отметки 0,6 и 1,6 мл соответственно для достижения оптимальной концентрации антикоагулянта в образце. Заполнение шприца может производиться как способом самозаполнения (поршень шприца заранее устанавливается на нужный объем, и после введения иглы в артерию заполнение шприца происходит самостоятельно — под давлением крови, а остаточный воздух при этом удаляется через специальную мембрану в поршне), так и аспирационным способом (после пунктирования либо катетеризации сосуда поршень шприца медленно оттягивается до нужной метки, и шприц при этом заполняется кровью). Важно помнить, что при взятии крови из сосудистого катетера необходимо предварительно удалить остатки вводившихся через него растворов. Для этого из катетера выпускают и отбрасывают кровь в количестве не менее 3—6 его объемов, что обычно составляет 3—5 мл.
Сразу после взятия крови, во избежание образования сгустков, образец необходимо перемешать путем 5-кратного переворачивания и перекатывания шприца между ладонями в течение 5 с. Эту же процедуру желательно провести и непосредственно перед анализом — для перемешивания содержимого шприца и предупреждения ошибок, вызванных оседанием клеток. Качественное перемешивание крови с гепарином в капилляре возможно только с помощью магнитного стерженька-мешалки, помещаемого пинцетом в капилляр перед закрытием его второго конца колпачком, и постоянного магнита, которым затем несколько раз проводят вдоль капилляра (в разные стороны).
Взятая кровь также не должна соприкасаться с воздухом во избежание изменений газового состава и искажения результатов исследования. Оставленный в шприце пузырек воздуха, в зависимости от размеров и времени инкубации до анализа, способен исказить результаты определения О 2 и СО 2 на 10—25%. Поэтому немедленно после взятия крови в шприц необходимо выдавить из него все пузырьки (при необходимости — с несколькими каплями крови) и герметично закрыть канюлю резиновым колпачком или специальной крышкой. При взятии капиллярной крови избежать контакта с воздухом практически невозможно, но требуется свести его к минимуму.
Гемолиз в образце также может сильно исказить результаты анализа ионного состава и некоторые параметры КЩС (калий, кальций, парциальное давление кислорода и углекислого газа). К сожалению, обнаружить небольшой гемолиз в цельной крови почти невозможно. Основной причиной его появления являются дефекты процедуры взятия крови — прокалывание сосуда насквозь и взятие крови из гематомы, повреждение окружающих тканей, неполное испарение дезинфектанта (спирта) с поверхности кожи и т. д. В образцах капиллярной крови гемолиз бывает значительно чаще, поскольку вытекающая после прокола пальца кровь неизбежно соприкасается с поврежденными тканями и с кожей, а ее выдавливание усиливает травму клеток. Кроме того, к гемолизу ведет длительное охлаждение образца крови. Снизить влияние указанных факторов и предотвратить гемолиз помогает использование специальных шприцов для артериальной крови, тщательное выполнение правил ее взятия и минимизация времени хранения образца перед анализом (по возможности — без охлаждения).
Заключение
Отсутствие в России официальных стандартов взятия венозной крови для клинико-лабораторных тестов, а также артериальной крови для исследования КЩС вызывает ряд сложностей и порождает источник для огромного количества преаналитических ошибок. Микробная контаминация образцов мочи и проблемы при ее взятии из катетеров также является одной из главных проблем лабораторной диагностики: инфицирование мочевых путей и некорректное выявление микробного агента ведет к неадекватному назначению антимикробной терапии, нанесению вреда иммунной системе пациента и увеличению сроков лечения, а также к дополнительным финансовым издержкам, поскольку бактериологические исследования по сравнению с другими лабораторными тестами достаточно дороги.
Именно поэтому стандартизация этих процессов, особенно с учетом специфики отделений неотложной помощи, крайне необходима для уменьшения количества венепункций у пациента, обеспечения достоверности результатов лабораторных исследований, снижения риска травматизации сосуда и развития инфекционных осложнений, а также предупреждения преаналитических ошибок и снижения их влияния на качество лабораторного исследования.
Описанные выше процедуры и манипуляции по взятию венозной крови из катетеров, мочи из катетеров Фолея и артериальной крови для анализа КЩС предлагаются для рассмотрения профессиональному сообществу для создания рекомендаций по взятию биологических образцов для лабораторных исследований в отделениях неотложной помощи.
Конфликт интересов отсутствует, источника финансирования нет.