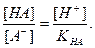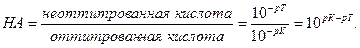Как можно уменьшить погрешность титрования
Лекция 15. Кислотная и основная индикаторные погрешности титрования
Ключевые слова:показатель титрования индикатора, рН в точке эквивалентности,
кислотная индикаторная погрешность титрования, основная индикаторная
Кислотная погрешность (δHA)вызвана присутствием в растворе недотитрованной слабой кислоты и имеет отрицательное значение. Для вычисления кислотной погрешности составим выражение для константы диссоциации слабой кислоты и преобразуем это выражение:
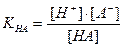
δ
Если титрование необходимо провести так, чтобы индикаторная ошибка титрования не превышала 0,1%, то есть чтобы оставшаяся неоттитрованная кислота составляла не более 0,001 от количества оттитрованной кислоты, нужно, чтобы 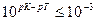
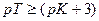
Значит, в тех случаях, когда применение данного индикатора вызывает возникновение кислотной ошибки титрования, он пригоден только при условии, если величина показателя титрования индикатора рТ не менее, чем на 3 единицы, превышает величину показателя диссоциации кислоты рК.
Например, достаточно точно оттитровать уксусную кислоту (рКкисл=4,73) можно только при применении таких индикаторов, показатель титрования которых рТ≥7,73. Значит, ни метиловый оранжевый (рТ≈4), ни метиловый красный (рТ≈5,5), ни лакмус (рТ≈7) не подходят. Наоборот, фенолфталеин (рТ≈9) можно использовать для титрования уксусной кислоты щелочью.
Величина кислотной погрешности в процентах (%) представляет собой молярную долю неоттитрованной кислоты и может быть рассчитана через соотношение
δНА(%) = 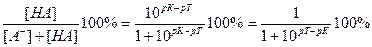
Основная погрешность титрования(δМеОН) вызвана присутствием в растворе недотитрованного слабого основания, как правило, имеет отрицательное значение. Учитывая диссоциацию слабого основания, составим выражение для константы диссоциации и преобразуем его.
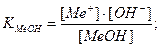
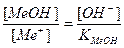
δМеОН = 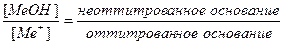
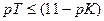
Величина основной погрешности в процентах (δМеОН(%)) представляет собой молярную долю неоттитрованного основания и может быть рассчитана через соотношение
δМеОН(%) = 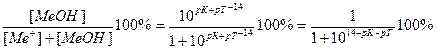
Пример 1. Вычислить ошибку титрования 0,1 н. раствора уксусной кислоты 0,1 н. раствором гидроксида натрия с индикаторами: а) метиловым оранжевым; б) фенолфталеином.
Решение. Для определения типа ошибки вычисляем рН раствора в точке эквивалентности: 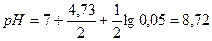
А. Титрование с метиловым оранжевым заканчивается при рН≈4. По окончании титрования в растворе будет присутствовать избыточная уксусная кислота СН3СООН. А так как это кислота слабая, она вызовет δНА-ошибку:
δ 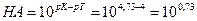
Это значит, что неоттитрованная часть уксусной кислоты относится к оттитрованной ее части, как 5,4 к 1. Другими словами, из 6,4 части первоначально взятой СН3СООН остаются неоттитрованными 5,4 части. Отсюда легко вычислить δНА-ошибку в процентах, составив пропорцию:
δ 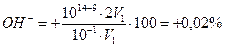
Фенолфталеин можно использовать для титрования уксусной кислоты щелочью.
Пример 2. Чему равна индикаторная ошибка титрования 0,1 н раствора NН4ОН 0,1 н раствором НСl с индикаторами: а) фенолфталеином, б) метиловым оранжевым?
Решение. Для определения типа ошибки вычисляем рН раствора в точке эквивалентности: 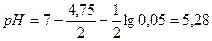
А. Титрование с фенолфталеином заканчивается при рН≈9; в растворе по окончании титрования будет некоторый избыток NН4ОН. Поэтому в данном случае возникает δМеОН-ошибка: δ 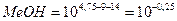
Следовательно, из 1,56 весовых частей первоначально взятого NН4ОН не оттитрованными остаются 0,56 весовой части. Составим и решим пропорцию:
0,56 — х% Следовательно: δМеОН(%) = 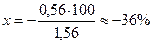
Индикатор фенолфталеин непригоден для титрования гидроксида аммония сильной кислотой. Тот же вывод получаем при применении соотношения для индикаторов: рТ≤(11−pK) = 11 – 4,76 = 6,24.
Тогда как для фенолфталеина рТ≈9 > 6,24.
Контрольные вопросы
1.В каком титровании возникает кислотная индикаторная погрешность?
2.В каком титровании возникает основная индикаторная погрешность?
3.Как рассчитывается кислотная индикаторная погрешность?
4.Как рассчитывается основная индикаторная погрешность?
Список рекомендуемой литературы
Лекция № 16 Ошибки кислотно-основного титрования, причины их возникновения, способы устранения
Ошибки кислотно-основного титрования, причины их возникновения, способы устранения.
2.Виды индикаторных ошибок.
Ключевые слова: водородная ошибка, гидроксильная ошибка, кислотная ошибка, основная ошибка.
Ошибки титрования обусловлены двумя причинами. 1) Ошибками измерения объема растворов. Эта ошибка складывается из объема одной капли. Относительная ошибка титрования зависит от объема затраченного титранта или титруемого раствора и равна:

где v- объем титруемого раствора
Для 10 см3 титруемого раствора
Для 20 см3
Следовательно, для уменьшения ошибки титрования следует брать для титрования не менее 20 см3.
2). Индикаторные ошибки обусловлены несовпадением показателя титрования примененного индикатора с величиной рН в точке эквивалентности. Вследствие этого раствор обычно несколько перетитровывают, либо наоборот, недотитровывают. В результате, по окончании титрования раствор содержит небольшой избыток свободной кислоты или щелочи. Ошибки, возникающие из-за несоответствия точки конца титрования, при котором изменяется окраска индикатора эквивалентной точки, называют индикаторными ошибками.
2.Виды индикаторных ошибок
В зависимости от природы титранта или титруемого вещества, различают 4 вида индикаторных ошибок.
1.Еслн избыточная кислота является сильной и, следовательно, присутствует в растворе свободные ионы водорода, ошибку называют водородной или протонной.
2.Наоборот, если избыточным является сильное основание, то оно обуславливает возникновение гидроксильной ошибки От (ОН-).
З.Если же избыточным является слабая кислота и присутствует в виде не диссоциированных молекул (НА) – называют кислотной ошибкой От (к).
4.Наоборот, если избыточным является слабое основание, такую ошибку называют основной ошибкой (ОТОН).
3.Водородная (протонная) ошибка
Показатель титрования, то есть концентрация ионов водорода к моменту конца титрования, определяется величиной рТ индикатора. Если один миллилитр раствора с нормальностью N содержит N/1000 грамм эквивалентов сильной кислоты, тогда V-миллилитров содержит NV/1000 грамм эквивалентов сильной кислоты или такое же количество ионов водорода.
Вам также известно, что к моменту конца титрования объем титруемого раствора, при равных нормальностях титранта и титруемого раствора, увеличивается в 2 раза, так как объем в колбе титрования слагается из объемов растворов титранта и титруемого вещества V2 – 2V1.
Для вывода уравнения расчета водородной ошибки, выраженной в процентах, составим следующую пропорцию число грамм эквивалентов ионов водорода в объеме V:

число грамм эквивалентов ионов водорода в объеме,
V в момент титрования:
составляет процент водородной ошибки (От [н])
Из пропорции
ОТ[н+] – процент водородной ошибки
N1 – нормальность титранта
V1 – объем титранта
V2 – объем титруемой смеси.
Расчет индикаторных ошибок позволяет правильно выбрать индикатор и свести к минимуму индикаторные ошибки. Пример, чему равна индикаторная ошибка титрования 0,1 н раствора НС 0,1 н р-ром NаОН с метилоранжем. Решение: Выясним, с какой индикаторной ошибкой в данном случае приходится считаться. Точка эквивалентности в данном случае достигается при рН=7, а заканчивается титрование см.о. при рН=4. Значит, раствор по окончания титрования будет содержать некоторое количество избытка кислоты. Поскольку кислота сильная, она вызывает водородную ошибку. Так как нормальность обоих растворов одинакова, на их реакцию затрачиваются равные объемы. Это значит, что объем раствора в колбе титрования удвоится к концу титрования V2 = 2V1.
Такая ошибка в пределах точности титриметрических методов, но при использовании индикатора с показателем титрования, более близким к точке эквивалентности, например, метиловым красным о рТ=5, ошибка уменьшается в 10 раз
Предположим, что титруют V мл N нормальной сильной щелочи сильной кислотой и объем раствора в конце титрования равен V2 = 2V1.
Взято для титрования N1V1/1000 грамм эквивалентов сильной щелочи, следовательно, [ОН]= N1V1/1000 грам ион. Титрование заканчивается при рН=рТ индикатора, т.е. при рОН=14 – рТ. Следовательно, по окончании тит-рования концентрация недотитрованных ионов гидроксила [ОН]= 10– (14 – рТ), а в грамм ионах [ОН] в объеме V2 будет равно
Таким образом, в начале число грамм эквивалентов гидроксила
В конце титрования число грамм эквивалентов гидроксила
Решая эту пропорцию, получим
Пример. Задача 2. Рассчитать ошибку титрования при титровании 0.1 н соляной кислоты с 0.1 н NаОН с индикатором фенолфталеин. Решение: рТфф=9, следовательно, к моменту конца титрования раствор будет перетитрован, ошибка гидроксильная
Ф. при данном титровании вполне пригоден.
Задача 3. Рассчитать ошибку титрования 0.01 н раствора соляной кислоты с 0,01 н NаОН при индикаторе метилоранж.
Ошибка очень большая для данного титрования, м. о. применить нельзя.
Напишем константу равновесия слабой кислоты НА Н+ + А-

Поскольку НА кислота слабая, величина НА=Ск, а [А]=Сс т.е. концентрация недодиссоциированных молекул практически равна общей концентрации свободной кислоты, а величина [А] равна концентрации соли, образованной вследствии титрования. Каждая грамм-молекула соли образуется в результате нейтрализации одной грамм-молекулы кислоты, следовательно, [НА] можно рассматривать как отношение концентрации неоттитрованной части кислоты к оттитрованной ее части н считать его мерой кислотной ошибки. Заметим далее, что [Н]=10-рТ, т.е. концентрация ионов водорода в момент изменения окраски определяется показателем титрования индикатора, а константу диссоциации слабой кислоты можно выразить как К= 10-рК.
Куксус = 1,8 • 10-5 = 10-4,75 lg Куксус = lg1,8+ lg10-5 = 0,25 – 5lg10, умножив обе части на –1: – lgК = 0,25 – 5 (–1)
Подставив в вышеуказанное выражение получим:
[недотитрованная кислота] 10-рТ
ОT = = или ОT ===== 10 рК-рТ
[оттитрованная кислота] 10-рК кислотная
Для того, чтобы индикаторная ошибка титрования не превышала 0,1%, т.е. чтобы оставшаяся неоттитрованная кислота [НА] составляла не более 0,01 части от количества оттитрованной кислоты, нужно, чтобы для этого рТ?рК+3, т.е. показатель титрования индикатора должен быть на 3 порядка больше, чем показатель константы диссоциации слабой кислоты. Таким образам, при возникновении кислотной ошибки индикатор пригоден только при условии, если величина показателя титрования индикатора рТ не менее, чем на три единицы превышает величину показателя константы диссоциации кислоты. Например, зная показатель константы диссоциации уксусной кислоты рК=4,73, можно утверждать, что для его точного титрования нужно выбрать индикатор, рТ которого рТ>4,73+3=7,73. Значит, ни метилоранж рТ=4, ни метил красный рТ=5,5, ни даже лакмус рТ=7 здесь не подходит. Наоборот, фенолфталеин с рТ-9 более пригоден. Пример 4. Вычислить ошибку титрования 0,1 н раствора СН СООН 0,1 н раствором щелочи при использовании индикатора метилоранжа
Решение: Для выяснения типа ошибки вычисляем рН раствора в точке эквивалентности. Образуется соль 

образуется 0,1 моль 
Поскольку титрование с метилоранжем заканчивается при рН=4 и в растворе по окончании титрования будет присутствовать слабая кислота, она вызывает кислотную ошибку
Следовательно, 
Знак (?) означает, что раствор неоттитрован на 84%. Вывод: титровать уксусную кислоту, используя метилоранж, нельзя. Такой же вывод следует из соотношения рТ> рК + 3 >4 + 3=7, т.е. рТ индикатора должен быть больше 7.
Основная ошибка титрования:

Титрование будет точным при условии
Например, при титровании NH4ОН (РК=4,75) можно применить индикаторы рТ?11-рК c рТ 6,25 рТ?11-4.75=6.25. Следовательно, ни фенолфталеин с рТ=9, ни лакумус рТ=7 не подойдут. Наоборот, метил красный рТ=5,5, метил оранж о.рТ=4, вполне пригодны. Пример 5. Вычислить ошибку титрования 0,1 и СН3СООН с 0,1 н NаОН при использовании метилоранжа

при индикаторе фенолфталеине. Решение: поскольку в точке эквивалентности 8,7 а рТ=9 фенолфталеина, то раствор будет немного перетитрован и ошибка гидроксильная
рН в точке эквивалентности 8,8 рН фенолфталеина = 9
Вывод: Индикатор фенолфталеин пригоден.
Пример 6. Чему равна индикаторная сшибка титрования 0,1 н NН4ОН с 0,1 н соляной кислотой а) При использовании фенолфталеина
б) При использовании метилоранжа
При использовании фенолфталеина титрование заканчивается при рН=9, тогда как в точке эквивалентности =5,13 и в растворе будет некоторый избыток слабого основания

Со + Сс = 0,56 + 1 = 1,56
Вывод: фенолфталеин в данном случае непригоден, аммиак недотитрован на 36%, такой же вывод следует из рТ
Основные погрешности титриметрического метода
Операции, выполняемые в ходе количественного определения, могут выступать источником погрешностей, влияющих на правильность результатов анализа.
Общая погрешность способа количественного определения лекарственных средств нормируется и приводится в нормативном документе как предел содержания действующего вещества в лекарственном средстве. Во избежание повышения допускаемой погрешности необходимо контролировать правильность выполнения отдельных операций, особенно связанных с измерениями.
Погрешности выполняемых измерений классифицируют на абсолютные и относительные. Абсолютные ошибки приводимых измерений обусловлены возможностями используемых средств измерения и носят объективный характер.
Ни одно количественное определение не обходится без измерения массы или объема. Уменьшить влияние допускаемых в ходе анализа погрешностей на стадиях измерения, как массы, так и объема можно за счет соблюдения требований метрологии, в соответствии с которыми относительный вклад допускаемых погрешностей в результаты анализа будет уменьшаться с увеличением измеряемых величин массы и объема.
Для измерения массы в фармацевтическом анализе используются аналитические весы, относительная погрешность взвешивания на которых в зависимости от марки используемых весов может составлять 0,001 – 0,01% при макронавеске около 0,5 г. Относительная погрешность будет возрастать при уменьшении навески. Во избежание превышения допускаемой погрешности на стадии измерения массы в методике приводится навеска анализируемого образца численно равная примерно 0,5 г и более. Лишь в некоторых случаях для ограниченно растворимых веществ или при необходимости обоснованной экономии анализируемого материала навеска уменьшается до 0,1 г.
Часто в ходе титриметрического анализа возникает ситуация, когда рассчитанная навеска оказывается микронавеской. Для обеспечения надлежащей точности при измерении массы микронавеску увеличивают до макронавески в соответствующее число раз с последующим разведением её в мерной посуде, калиброванной на вливание, т.е. с помощью пипеток, объем которых строго соответствует объему аликвоты.
Особую значимость при объемном титровании имеет измерение объема титранта, т.к. по количеству израсходованного титрованного раствора устанавливается количество определяемого вещества. В титриметрии для измерения объема титранта используют калиброванные на выливание макробюретки (25-100 мл), полумикробюретки (5-10 мл) и микробюретки (1-2 мл) с ценой деления 0,1 мл; 0,05 мл; 0,01 мл соответственно.
В зависимости от объема используемых бюреток и цены их деления максимальная погрешность, возникающая при этом, будет составлять примерно 0,5% при применении макро- и полумикробюреток и 1% в случае использования микробюреток.
Так как погрешность, возникающая на данной стадии, является значительной, то при выполнении анализа стремятся к тому, чтобы расход титранта был примерно равным объему используемой бюретки. Для соблюдения данного условия при составлении методики количественного определения задают расход титранта примерно равный 20 мл при анализе лекарственного вещества (макровариант объемного анализа, если бюретка на 25 мл) и 5-10 мл (полумикровариант объемного анализа, бюретка на 5-10мл).
В методике количественного определения, как правило, приводятся навеска анализируемого образца и концентрация титранта, а объем расходуемого на титрование титрованного раствора не указывается. Для правильного выбора бюретки для титрования необходимо предварительно провести расчеты по расходу титранта. В дальнейшем в ходе анализа используют макро-, полумикро- или микробюретки в соответствии с полученными при расчете данными.
В титриметрии навеску анализируемого образца рассчитывают с использованием титра по определяемому веществу и задаваемого расхода титранта (20 мл при анализе лекарственных веществ). Рассчитанную таким образом навеску оценивают с позиций метрологии и при необходимости используют прием разведения. [8,12,15]
Таким образом, общая погрешность титриметрии в макроварианте составляет примерно 0,5%. Именно такая погрешность в соответствии с существующим порядком допускается при количественном анализе лекарственных веществ.
Выводы по главе 1
Реакция титрования должна удовлетворять следующим требованиям:
— быть строго стехиометричной;
— должен существовать способ, фиксирующий момент окончания реакции.
Осадительное титрование – метод титриметрического анализа, основанный на применении титрантов, образующих с определяемым веществом малорастворимые соединения.
Методы осадительного титрования обычно классифицируют по природе активного реагента, взаимодействующего с определяемым веществом: аргентометрия (AgNO3), тиоцианатометрия (KNCS или NH4NCS), меркурометрия (Hg2(NO3)2), сульфатометрия (H2SO4), бариметрия (BaCl2).
Реакции, применяемые в осадительном титровании, должны отвечать следующим требованиям.
– Определяемое вещество должно хорошо растворяться в воде с образованием бесцветного раствора и содержать хотя бы один ион, вступающий в реакцию осаждения с титрантом.
– Реакция осаждения должна протекать строго стехиометрически.
Побочные реакции и процессы соосаждения титранта или определяемого вещества с образующимся осадком исключаются.
– Реакция должна протекать практически до конца.
ГЛАВА 2. ПРАКТИЧЕСКАЯ ЧАСТЬ
Цель исследования
Цель исследования – изучение метода осадительного титрования, использование его для контроля качества неорганических лекарственных веществ солей галогенводородных кислот.
В данной работе представлены результаты контроля качества количественного определения индивиуальных лекарсвенных веществ: натрия бромида, калия хлорида, калия бромида, калия йодида согласно методикам, изложенным в НТД.
Задачи исследования
Для достижения поставленной цели были разработаны следующие задачи:
1. Выбор метода аргентометрического титрования для лекарственных средств солей галогенводородных кислот.
2. Проведение фармакопейного количественного содержания солей в порошках лекарственных средств.
3. Определение доброкачественности порошков лекарственных средств с целью использования их в лабораторном практикуме.