дисметаболическая кардиомиопатия мкб 10 код у взрослых
Кардиомиопатия неуточненная (I42.9)
Версия: Справочник заболеваний MedElement
14-16 октября, Алматы, «Атакент»
150 участников из 10 стран. Новинки рынка стоматологии. Цены от производителей
Общая информация
Краткое описание
Автоматизация клиники: быстро и недорого!
— Подключено 300 клиник из 4 стран
Автоматизация клиники: быстро и недорого!
Мне интересно! Свяжитесь со мной
Классификация
Этиология и патогенез
В настоящее время этиология первичных кардиомиопатий не изучена до конца.
Вероятные причины развития кардиомиопатий:
— вирусные инфекции (вирус Коксаки, простого герпеса, гриппа и другие);
— наследственная предрасположенность (генетически наследуемый дефект, который приводит к неправильному формированию и функционированию мышечных волокон при гипертрофической кардиомиопатии);
— поражение кардиомиоцитов токсинами и аллергенами;
— перенесенные миокардиты;
— нарушения эндокринной регуляции (губительное воздействие на кардиомиоциты соматотропного гормона и катехоламинов);
— нарушения иммунной регуляции.
Патогенез гемодинамических нарушений различен для каждой формы кардиомиопатии.
При дилатационной кардиомиопатии наблюдается резкое уменьшение фракции выброса, вследствие чего возникают выраженное снижение ударного объема, увеличение конечного систолического и диастолического объемов левого желудочка и повышение в нем конечного диастолического давления. В результате развивается систолическая недостаточность сердца. В малом круге кровообращения формируется гипертензия.
Дилатация полостей сердца обусловливает появление относительной недостаточности клапанов сердца (в особенности митрального клапана), это способствует формированию обратного тока крови из левого желудочка в левое предсердие и в конечном счете усугубляет легочную гипертензию. Вследствие гипертензии в малом круге, повышается давление в правом желудочке, возникает его дилатация с развитием относительной недостаточности трехстворчатого клапана, а затем формируется застой в большом круге кровообращения.
При симметричной гипертрофической кардиомиопатии наблюдается недостаточное расслабление в диастолу левого желудочка, что вызывает развитие сердечной недостаточности и нарушений сердечного ритма и может приводить к летальному исходу.
При асимметричной гипертрофической кардиомиопатии происходит выпячивание гипертрофированной межжелудочковой перегородки и переднебоковой стенки левого желудочка в его полость. Формируется так называемый «двухкамерный желудочек» по типу песочных часов с клинической картиной субаортального стеноза.
Кардиомиопатия при метаболических нарушениях (I43.1*)
Версия: Справочник заболеваний MedElement
14-16 октября, Алматы, «Атакент»
150 участников из 10 стран. Новинки рынка стоматологии. Цены от производителей
Общая информация
Краткое описание
Автоматизация клиники: быстро и недорого!
— Подключено 300 клиник из 4 стран
Автоматизация клиники: быстро и недорого!
Мне интересно! Свяжитесь со мной
Классификация
AL-амилоидоз включает:
— первичный идиопатический амилоидоз;
— амилоидоз при множественной миеломе;
— амилоидоз при В-клеточных опухолях;
— амилоидоз при болезни Вальденстрема.
Предшественником AL-амилоидоза служат легкие цепи моноклонального Igλ и Х-типов.
Основные органы-мишени: желудочно-кишечный тракт (ЖКТ), сердце, почки.
ATTR-амилоидоз включает:
— семейную амилоидную полинейропатию;
— семейную амилоидную кардиопатию;
— старческий амилоидоз (у лиц, старше 70 лет).
Аβ2М-диализный амилоидоз является новой формой системного амилоидоза.
Аβ-амилоидоз развивается при болезни Альцгеймера, иногда регистрируются семейные случаи.
Варианты старческого амилоидоза сердца:
— диффузные интерстициальные фибриллярные отложения в миокарде;
— мультифокальный массивный амилоидоз миокарда;
— диффузный (интерстициальный, сетчатый, псевдогипертрофический) кардиальный амилоидоз коронарных артерий (мультинодулярный стенозирующий коронарный амилоидоз);
— амилоидоз аорты.
Этиология и патогенез
Амилоидная кардиопатия развивается при первичной (идиопатической) системной семейной кардиопатической и старческой формах амилоидоза.
При первичном амилоидозе амилоид наиболее часто откладывается вокруг коллагена в строме органа, вследствие этого миокард утолщается и уплотняется («резиновый» миокард), иногда не спадается на вскрытии. Эти свойства миокарда являются причиной резкого снижения его податливости. Кардиопатический амилоидоз является типичным вариантом рестриктивной кардиомиопатии.
При первичном амилоидозе увеличение массы миокарда в некоторых случаях бывает настолько выраженным, что на вскрытии сердце занимает большую часть грудной клетки. Отложения амилоида делают миокард ригидным, но полости желудочков не дилатированы, зато предсердия резко расширены, в результате чего сердце на рентгеновском снимке имеет форму «боксерской перчатки». В результате резкого утолщения стенок сердца, оно внешне несколько напоминает гипертрофическую кардиомиопатию.
У пациентов с кардиопатическими формами идиопатического или семейного амилоидоза, развивается хроническая сердечная недостаточность (при нерасширенных желудочках сердца) вследствие невозможности адекватного расслабления желудочков в диастолу.
У некоторых пациентов амилоид откладывается на клапанах сердца, что вызывает регургитацию потока крови, которая клинически проявляется систолическим шумом. Как результат в обоих желудочках возникают резкое повышение конечного дистолического давления, снижение сердечного выброса, а в дальнейшем и снижение сократимости левого желудочка.
Эпидемиология
Факторы и группы риска
— у пациентов с хронической сердечной недостаточностью, рефрактерной к стандартному медикаментозному лечению.
Клиническая картина
Cимптомы, течение
Диагностика
ЭхоКГ-признаки при амилоидозе сердца:
1. Дилатация верхней и нижней полых, печеночных и легочных вен. Инспираторный коллапс нижней полой вены, присутствующий в норме, может быть резко снижен или отсутствует.
2. Маленькие полости желудочков при большом размере предсердий.
3. Снижение скоростей потока в печеночных венах на вдохе и реверсия диастолического потока на вдохе.
4. Увеличение конечно-диастолической толщины межжелудочковой перегородки (МЖП) ≥ 12 мм при отсутствии каких-либо иных причин гипертрофии (артериальная гипертензия, аортальный стеноз).
5. Гомогенное утолщение атриовентрикулярных клапанов (часто сопровождается небольшой регургитацией).
6. Диффузное утолщение других стенок сердца, включая стенку правого желудочка и межпредсердную перегородку.
ЭКГ-изменения при амилоидозе сердца:
— низкий вольтаж без специфических изменений реполяризации или сочетание низкого вольтажа и эхокардиографических признаков большой массы миокарда;
— патологические зубцы Q, «симулирующие» инфаркт миокарда;
— аритмии и нарушения проводимости.
Радиоизотопная диагностика амилоидоза сердца показывает значительное повышение накопления изотопа в миокарде.
Лабораторная диагностика
При амилоидозе специфические лабораторные изменения отсутствуют.
Характерны значительно повышение СОЭ (50-70 мм/ч) и анемия (в ряде случаев отмечаются гиперфибриногенемия, тромбоцитоз).
Применяются специальные пробы на амилоид (с конгорот, метиленовой синью, которые в норме изменяют окраску мочи, но у больных амилоидозом они фиксируются амилоидом и выводятся с мочой в минимальных количествах) и электрофоретическое исследование белков мочи.
Дифференциальный диагноз
3. Идиопатическая рестриктивная кардиомиопатией (эндомиокардиальная болезнь). Дифференциация основана на типичных отличиях морфофункционального состояния левого желудочка по данным ЭхоКГ и характера нарушений его диастолического наполнения при радионуклидной вентрикулографии и катетеризации сердца. В обоих случаях важным диагностическим значением обладает выявление внесердечного амилоидоза.
Лечение
Затруднено лечение ХСН у больных АL-амилоидозом. Это связано с повышенной чувствительностью к сердечным гликозидам, усугублением ХСН на фоне приема ингибиторов кальциевых каналов и развитием угрожающих жизни нарушений проводимости при назначении бета-адреноблокаторов. По сути лечение сводится к назначению массивных доз мочегонных средств.
При синдроме слабости синусового узла малоперспективно применение искусственного водителя ритма, поскольку пациенты могут погибнуть от прочих нарушений ритма и проводимости.
В настоящее время для лечения амилоидной кардиомиопатии начинают применять трансплантацию сердца.
Метаболическая кардиомиопатия



Международные названия
Содержание
Определение
Метаболическая кардиомиопатия (ранее ее определяли как дистрофию миокарда, миокардиодистрофию) — невоспалительное поражение миокарда различной этиологии, в основе которого лежит нарушение обмена веществ, процесса образования энергии и/или нарушение ее превращения в механическую работу, приводящее к дистрофии миокарда и недостаточности сократительной и других функций сердца.
Этиология
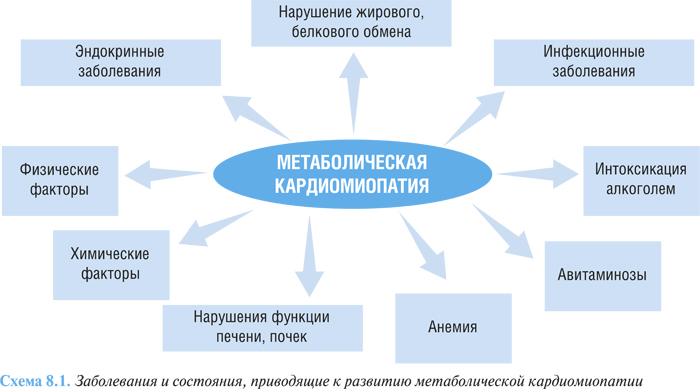
Метаболическая кардиомиопатия развивается в результате воздействия патогенных факторов при различных заболеваниях и состояниях (схема 8.1).
Среди физических факторов могут рассматриваться радиация, вибрация, перегревание, переохлаждение, гиперинсоляция.
К химическим факторам относятся лекарственные средства, токсическое воздействие бытовых и промышленных ядов.
Патогенез
В возникновении и развитии метаболических поражений миокарда при разных заболеваниях существенное значение имеет нарушение иннервации, транспорта и утилизации энергии в кардиомиоцитах, то есть их энергообеспечение.
Напряжение регулирующих систем, функции миокарда и метаболических процессов в кардиомиоцитах ограничивает резервные возможности сердца. Длительная гиперфункция сама по себе, а особенно в неблагоприятных условиях на фоне основного заболевания, может привести к возникновению энергетического дефицита и нарушению приспособительных изменений в миокарде.
Механизмы снижения продукции энергии в поврежденном сердце включают снижение плотности капилляров, увеличение межкапиллярного расстояния, а также больший диаметр гипертрофированных кардиомиоцитов, что ухудшает диффузию кислорода и обусловливает возникновение гипоксии миокарда. Один из механизмов связан также с нарушением функции митохондрий, которое вызвано редуцированным синтезом окислительных энзимов вследствие нарушения пролиферативной реакции, которая частично опосредована экспрессией рецепторов PPARα, играющих ключевую роль в биогенезе митохондрий. Эти рецепторы регулируют транскрипцию многих энзимов и переносчиков (транспортеров), которые участвуют в транспорте и окислении жирных кислот. Также снижается способность сердца восстанавливать запасы макроэргических фосфатов. Уменьшение окисления жирных кислот вызывает накопление липидов и вносит вклад в некроз поврежденных мембран, при этом высвобождение реактивных молекул (цитохромов, радикалов кислорода) приводит к апоптозу. Ускоренный гликолиз, вызванный нарушением окислительного фосфорилирования, приводит к ацидозу, который ингибирует многие процессы, включенные в процесс сокращения — расслабления. Из последних наиболее важным является повышение концентрации кальция в цитозоле, который инициирует множество порочных кругов, приводящих к некрозу миоцитов.
В прогрессировании метаболической кардиомиопатии ведущую роль играет усиление реакций свободнорадикального перекисного окисления липидов клеточных мембран. Повреждая мембраны, гидроперекиси и свободные радикалы снижают активность липидозависимых ферментативных реакций (к которым относятся основные жизненно важные ферменты ионного транспорта и дыхательной цепи митохондрий), изменяют мембранорецепторные системы клетки с развитием медиаторного дисбаланса, активируют протеолитические и лизосомальные ферменты.
Патологическая анатомия
Метаболические поражения миокарда охватывают все стадии нарушения обмена сердечной мышцы — от функциональных расстройств до грубых структурных изменений. Морфологические изменения происходят внутри клеток миокарда и не сопровождаются увеличением их количества. Наиболее чувствительны к патогенным воздействиям митохондрии и эндоплазматическая сеть. Для дегенеративных изменений миокарда характерно мозаичное нарушение структуры кардиомиоцитов: в одной и той же клетке среди набухших митохондрий с частично или полностью разрушенными внутренними перегородками могут быть митохондрии с нормальным строением.
Как правило, устранение патогенной причины приводит к постепенной нормализации ультраструктур кардиомиоцита, что обусловлено внутриклеточными регенераторными процессами. Поврежденные миофибриллы восстанавливаются в результате активной деятельности рибосом: постепенно устраняется внутриклеточный отек, появляются зерна гликогена, уменьшается количество жировых включений. При длительном и интенсивном воздействии повреждающих факторов на миокард дистрофические изменения могут приводить к глубоким морфологическим изменениям, заканчивающимся развитием миокардиофиброза.
Гибель части миокарда восполняется увеличением массы специфических структур в неповрежденных клетках, происходит гиперплазия митохондрий, саркоплазматического ретикулума, рибосом. В результате развивается гипертрофия миокарда, представляющая собой компенсаторную регенераторно-гиперпластическую реакцию, характерную для миокарда. Биохимические процессы чаще нарушаются в ЛЖ.
Клиническая картина
Клинические проявления многообразны и не являются специфичными. Начальные стадии могут протекать бессимптомно, со временем снижение сократительной способности миокарда может привести к тяжелой СН.
Нередко на фоне проявлений основного заболевания отмечают кардиалгию (чаще в области верхушки сердца (92%), реже за грудиной (15%)), расширение границ сердца, приглушенность тонов, небольшой систолический шум на верхушке сердца, нарушения ритма (в основном экстрасистолическую аритмию).
Диагностика
При формулировке диагноза следует прежде всего указать основное заболевание или этиологический фактор, характер течения кардиомиопатии и основные клинические проявления (наличие нарушений ритма и проводимости, стадию СН).
В дифференциальной диагностике метаболической кардиомиопатии могут иметь значение нагрузочные и медикаментозные пробы, в случае необходимости — проведение коронарографии.
Лечение
Независимо от повреждающего фактора принципиальными для метаболической кардиомиопатии могут быть следующие положения:
Помощь больным следует начинать с устранения причины развития дистрофии миокарда. Немаловажное значение имеет отказ от курения и злоупотребления алкоголем, исключение физического и психоэмоционального перенапряжения.
Наряду с лечением основного заболевания необходимо восстановление адекватного энергетического обмена. На первый план выступает применение комплекса лекарственных средств, направленных на улучшение транспорта кислорода в ткани и его утилизации.
На обмен веществ в клетке могут оказывать влияние две группы лекарственных средств: регуляторы экстрацеллюлярной природы (гормональные препараты, блокаторы и стимуляторы центральной и периферической нервной системы) и регуляторы метаболизма интрацеллюлярной природы (ферменты и антиферменты, витамины, кофакторы, разнообразные метаболиты), оказывающие действие на различные пути обмена веществ.
При нарушении процессов окислительного фосфорилирования применяют комплекс витаминов, включающий витамины В1, В2, пантотеновую и липоевую кислоты. Витамины группы В влияют на белковый, липидный, углеводно-энергетический обмен, синтез аминокислот, нуклеотидов.
Среди препаратов с антиоксидантными свойствами широко применяют токоферола ацетат, его сочетание с витамином РР (никотиновой кислотой) способствует улучшению энергетического обеспечения сократительной функции миокарда. Активным антиоксидантом, который участвует в окислительно-восстановительных процессах, является витамин С.
Большое значение для нормализации метаболизма миокарда имеет достаточное поступление в организм незаменимых аминокислот; в том числе метионина, лейцина, аланина, валина, лизина, трионина, триптофана, являющихся пластическим материалом для синтеза белка, ферментов, коферментов. Для улучшения их усвоения рекомендуется назначать их в комплексе с анаболическими стероидами (метандиенон, нандролон).
При прогрессировании дистрофического процесса показано применение внутрь калия хлорида, калия и магния аспарагината для устранения закономерного дефицита внутриклеточного калия, нарушения баланса кальция и магния, что приводит к восстановлению регуляции возбудимости и проводимости миокарда, его автоматизма и сократимости.
Для активации синтеза белков и нуклеиновых кислот применяют соли оротовой кислоты (оротат калия/магния).
Проводимая терапия должна быть направлена на повышение генерации энергии и повышение устойчивости миокарда к гипоксии. В последнее время большое внимание уделяют роли серотонинергической системы в регуляции стрессорной реакции. Специфической особенностью никотинамида является его способность стимулировать процессы аэробного окисления и обмен гликогена, тем самым повышая устойчивость кардиомиоцитов к гипоксии.
Прямое цито- и мембранопротекторное действие на кардиомиоциты в условиях гипоксических состояний оказывает триметазидин.
Продолжительность интенсивной метаболической терапии на ранних стадиях у больных с преимущественно функциональными нарушениями составляет 2–3 нед. При прогрессировании дистрофии миокарда и выявлении органического поражения сердца курс терапии следует повторять несколько раз в год.
ПОРАЖЕНИЯ СЕРДЕЧНО-СОСУДИСТОЙ СИСТЕМЫ ПРИ ЭНДОКРИННЫХ НАРУШЕНИЯХ
Сердечно-сосудистая система часто вовлекается в патологический процесс при заболеваниях желез внутренней секреции. Функциональные изменения сердца могут превалировать в клинической картине, и пациент с эндокринным заболеванием становится фактически «кардиальным» больным. Поражение сердца при эндокринных заболеваниях в основном обусловлено обменными нарушениями, вызванными недостатком или избытком того или иного гормона в организме.
ПОРАЖЕНИЕ СЕРДЦА ПРИ САХАРНОМ ДИАБЕТЕ
Термин «диабетическая кардиомиопатия» впервые предложен в 1954 г. для обозначения кардиальных изменений, предшествующих ИБС.
Патогенез
Патогенез метаболической кардиомиопатии при сахарном диабете многофакторный, поражение сердечно-сосудистой системы обусловлено сложными обменными нарушениями, возникающими в связи с абсолютной или относительной недостаточностью инсулина и нарушением толерантности к глюкозе.
Патогенез миокардиальных нарушений включает несколько основных механизмов: повреждение кардиомиоцитов, микроциркуляторные и нейровегетативные нарушения. Первый механизм связан с нарушением метаболизма кардиомиоцитов, снижением эффективности энергетических, пластических процессов и изменением ионного метаболизма, в результате чего снижаются компенсаторные возможности сердечно-сосудистой системы, нарушается сократительная функция миокарда, уменьшается толерантность к физическим нагрузкам. Второй механизм основывается на микроциркуляторных нарушениях в мелких артериях миокарда как локального проявления генерализованной микроангиопатии. Третий механизм включает поражение вегетативной нервной системы в результате формирования нейровегетодистрофии.
Кардиомиопатия, не обусловленная нарушением коронарного кровообращения, возникает у больных молодого возраста с ювенильным сахарным диабетом, для которых нехарактерно развитие выраженного атеросклероза, или у пациентов старшего возраста без сопутствующей ИБС.
Инсулин оказывает на сердце прямое действие, которое заключается в увеличении поступления и стимуляции окисления глюкозы и лактата, увеличении образования гликогена в миокарде. Непрямой эффект инсулина состоит в снижении содержания жирных кислот в плазме крови, уменьшении их поступления в сердце.
Дефицит инсулина вызывает нарушение утилизации тканями глюкозы и усиливает расщепление липидов и белков, также приводит к выраженным изменениям состава внутренней среды организма — гипергликемии, гиперкетонемии, гиперлипидемии с накоплением в крови жирных кислот, диспротеинемии, метаболическому ацидозу, оксидантный стресс вызывает апоптоз миоцитов. Эти нарушения являются определяющими факторами изменения структуры и функции миокарда.
Патогенез и морфогенез диабетического поражения сердца обусловлены не только влиянием гиперинсулинемии на эндотелий сосудов, энергетические и метаболические процессы в миокарде, но и непосредственно связаны с токсико-метаболическим повреждением кардиомиоцитов.
Есть мнение, что причиной разрушения структур кардиомиоцитов, нарушения структуры сарколеммы и ее дериватов, изменения ионного равновесия и снижения активности актомиозинового комплекса кардиомиоцитов является прямая глюкозотоксичность.
В патогенезе кардиомиопатии важную роль играет тканевая гипоксия. Большое значение в развитии гипоксии имеет нарушение транспорта кислорода кровью, функции дыхательных ферментов под влиянием выраженного ацидоза. При сахарном диабете потребность тканей, в том числе миокарда, в кислороде повышена.
Важным фактором развития миокардиодистрофии является нарушение нейроэндокринной регуляции сердца, связанное с преобладанием эффектов контринсулярных гормонов. Доказано, что у пациентов происходит повышение продукции адренокортикотропного и соматотропного гормонов, а также глюкокортикоидов, катехоламинов и глюкагона, это приводит к инициации целой группы метаболических и ультраструктурных процессов, вызывающих развитие метаболической кардиомиопатии.
Патогенез увеличения жесткости миокарда связан с нарушением транспорта кальция, электромеханическим дисбалансом, сопровождающимся асинхронностью расслабления и механическими факторами.
Патологическая анатомия
Характерен фиброз миокарда, связанный с нарушением внутриклеточного метаболизма оксида азота и кальция, а также с пролиферативными процессами, обусловленными действием инсулина и ИФР. Морфологической основой дистрофии миокарда при сахарном диабете является микроангиопатия, характеризующаяся инфильтрацией тучными клетками и фибриноидным набуханием стенок мелких сосудов. При морфологическом исследовании выявляют развитие апоптозной дегенерации, потерю синаптических пузырьков, появление больших вакуолей в цитоплазме клеток симпатических ганглиев. При гистохимическом исследовании в стенках сосудов определяются отложения гликопротеинов. На ультраструктурном уровне определяется утолщение базальной мембраны сосудистой стенки. Важное значение придают дезорганизации мышечных волокон гипертрофированного миокарда.
Клиническая картина и диагностика
Больные с ювенильным сахарным диабетом изредка отмечают колющую боль в области сердца. Возникновение тахикардии покоя связано с поражением блуждающего нерва и относительным преобладанием тонуса симпатического отдела вегетативной нервной системы. Тахикардия сопровождается неэффективными сокращениями миокарда, что приводит к истощению энергоресурсов и в конечном счете к снижению сократительной функции миокарда и развитию СН.
Размеры сердца в пределах нормы. Некоторое приглушение тонов сердца и систолический шум на верхушке чаще отмечают у болеющих сахарным диабетом более 5 лет. В дальнейшем гипергликемия и инсулинорезистентность ассоциируются с увеличением массы ЛЖ и появлением симптомов СН.
При эхоКГ-исследовании наиболее ранним признаком поражения миокарда при сахарном диабете является нарушение диастолической функции, которое отмечают у 27–69% бессимптомных больных.
При анализе крови уровень гликемии в плазме крови натощак >7,0 ммоль/л.
Лечение
Одной из основных задач лечения больных диабетической кардиомиопатией является профилактика дальнейшего прогрессирования поражения миокарда и развития СН. Важным является борьба с факторами риска: курением, ожирением, малоподвижным образом жизни, несбалансированным питанием. Рекомендации по оптимизации образа жизни должны содержать обоснование соответствующей низкокалорийной диеты для уменьшения массы тела, отказ от курения, регулярные физические нагрузки.
Важной задачей является нормализация обмена веществ, что включает достижение целевых уровней глюкозы, аглюкозурии, нормализации уровня гликированного гемоглобина. Регулярные физические нагрузки позволяют снизить резистентность к инсулину, повысить толерантность к глюкозе, способствуют утилизации глюкозы крови и свободных жирных кислот в мышцах, оказывают благоприятное влияние на функционирование сердечно-сосудистой системы.
Фармакотерапия сахарного диабета II типа направлена на усиление секреции инсулина, снижение инсулинорезистентности и представлена препаратами с различными механизмами действия: бигуаниды, производные сульфонилмочевины, глитазоны, глиниды, ингибиторы α-глюкозидазы, инсулин. Применение метформина позволяет улучшить контроль глюкозы крови у больных сахарным диабетом и способствует снижению общей смертности на 36%.
Для восстановления метаболических нарушений в миокарде назначают препараты α-липоевой кислоты, которая активирует ферменты митохондрий, увеличивает окисление глюкозы, замедляет глюконеогенез и кетогенез, как антиоксидант защищает клетки от повреждающего действия свободных радикалов. Также применяют препараты, способствующие коррекции нарушений обмена в миокарде: триметазидин, триметилгидразиния пропионат.
ТИРЕОТОКСИЧЕСКАЯ БОЛЕЗНЬ СЕРДЦА
Патогенез
Нарушение функции сердечно-сосудистой системы — появление «тиреотоксического сердца» является частым осложнением тиреотоксикоза. Изменения сердечно-сосудистой системы при тиреотоксикозе («тиреотоксическое сердце») обусловлены воздействием избыточного количества тиреоидных гормонов (L-тироксина и 3,5,3-трийод-L-тиронина) на обменные процессы в миокарде, гемодинамику и симпатическую нервную систему. Одним из важных эффектов тиреоидных гормонов является разобщение окислительного фосфорилирования, что приводит к снижению в сердечной мышце содержания АТФ и креатинфосфата. В результате происходит угнетение анаболических процессов: снижается синтез и усиливается распад гликогена и белка, снижается содержание калия в эритроцитах и других клетках. Потребление кислорода миокардом увеличивается, однако эффективность его утилизации в процессе биологического окисления снижается. При избытке тироксина нарушается проницаемость митохондриальных мембран.
Под влиянием тиреоидных гормонов происходит усиление сократительной функции миокарда, вероятно, вследствие активизации стимулирующего влияния на сердце и прямого действия тироксина на сердечную мышцу. Вследствие нарушений энергетических процессов и изменения калий-натриевого насоса происходит ускорение спонтанной деполяризации в клетках синусного узла, что обусловливает более частое образование в нем импульсов. Избыток тиреоидных гормонов изменяет симпатические и парасимпатические влияния на миокард. При высокой степени тиреотоксикоза в результате резкого снижения эффективности биологического окисления, преобладания распада белка над его синтезом снижается уровень энергетических ресурсов и пластических процессов, что приводит в конечном итоге к угнетению сократительной функции миокарда.
Гемодинамика
В основе гиперфункции сердца при тиреотоксикозе лежит повышение сократительной способности миокарда, что обусловлено как повышением активности симпатической нервной системы, так и непосредственным действием тиреоидных гормонов на миокард. При тиреотоксикозе происходят резкие изменения гемодинамики: увеличивается МОК (в основном за счет повышения ЧСС), скорость кровотока и ОЦК. Периферическое сосудистое сопротивление в большом круге кровообращения снижается, а в малом повышается. В результате повышается пульсовое давление. Сердце испытывает диастолическую перегрузку, а правые отделы сердца еще и систолическую перегрузку, увеличенная работа сердца происходит в крайне неблагоприятном для него режиме: вследствие изменений гемодинамики ЛЖ работает в условиях постоянной изотонической гиперфункции, а правый — в условиях смешанного типа гиперфункции (нагрузка объемом и сопротивлением), однако при этом отсутствуют условия для развития компенсаторной гипертрофии миокарда (усилен распад и снижен синтез белка, уменьшено количество АТФ и креатинфосфата). Все это достаточно быстро приводит к развитию СН.
Патологическая анатомия
Гистологические изменения миокарда при тиреотоксикозе характеризуются воспалением и дегенерацией вплоть до развития очагов некроза и фиброза. Гистологические изменения в миокарде непостоянны и неспецифичны. Факторы, обусловливающие поражение сердечно-сосудистой системы у больных с диффузным токсическим зобом, вначале вызывают дистрофические изменения, а в дальнейшем дегенеративно-склеротические. При тяжелом течении заболевания возникают дегенеративные изменения в митохондриях и их распад.
Клиническая картина и диагностика
Больные нередко жалуются на боль в области сердца, часто ноющего, колющего, нередко стенокардитического характера, а также на сердцебиение, которое возникает в состоянии покоя, но при физических нагрузках неадекватно усиливается. Больные отмечают повышенную возбудимость, потливость, мышечную слабость, тремор рук, похудение. Существенным симптомом является постоянная синусовая тахикардия, выраженность которой соответствует тяжести токсического зоба. У 10–20% больных диагностируется тахисистолическая форма фибрилляции предсердий. Характерно повышение САД, что обусловлено увеличением сердечного выброса. Одышка отмечается как при нагрузках, так и в покое. СН, в основном правожелудочковую, отмечают в 15–25% случаев. Признаки левожелудочковой недостаточности обычно выражены меньше, поскольку очень быстро возникает слабость ПЖ.
При осмотре отмечается прекардиальная пульсация и пульсация артерий. Аускультативно определяется повышение звучности сердечных тонов, особенно первого, почти всегда выслушивается систолический шум на верхушке сердца и ЛА.
При эхоКГ-исследовании на ранней стадии заболевания выявляют умеренную гипертрофию — утолщение задней стенки, межжелудочковой перегородки и увеличение сократительной функции ЛЖ. В дальнейшем развивается дилатация полостей сердца, увеличивается масса миокарда, уменьшается систолический и минутный объем крови, снижается сократительная функция миокарда.
В сыворотке крови определяется повышение уровней общего и свободного тироксина, трийодтиронина, снижение уровня тиреотропного гормона.
Лечение
Проводится по трем направлениям: нормализация функции щитовидной железы (достижение эутиреоидного состояния), устранение недостаточности кровообращения и восстановление синусового ритма (при фибрилляции предсердий).
Компенсация тиреотоксикоза достигается применением антитиреоидных препаратов или проведением хирургической операции или радиойодтерапии.
Для уменьшения синусовой тахикардии нецелесообразно применять сердечные гликозиды, широко назначают блокаторы β-адренорецепторов. При тахисистолической форме фибрилляции предсердий проводят комбинированное лечение антиаритмическими средствами (пропафенон) и блокаторами β-адренорецепторов, добиваясь восстановления синусового ритма или перевода фибрилляции предсердий в нормосистолическую форму.
Лечение СН не имеет специфических особенностей и обязательно должно проводиться на фоне антитиреоидной терапии. Следует учитывать, что чувствительность миокарда к гликозидам наперстянки может быть повышена.
КЛИМАКТЕРИЧЕСКАЯ (ДИСГОРМОНАЛЬНАЯ) КАРДИОМИОПАТИЯ
Эпидемиология
Изменение демографической структуры общества привело к увеличению в популяции доли женщин старшей возрастной группы (в настоящее время в мире около 500 млн женщин старше 50 лет, то есть в менопаузе).
О существовании связи между расстройством деятельности сердца и изменением функции женских половых органов известно давно. Заболевание может развиваться вследствие дефицита эстрогенов не только в климактерический период, но и у женщин молодого возраста с различными гинекологическими заболеваниями (миома матки, эндометриоз и др.), при посткастрационном и предменструальном синдромах. Климактерическая кардиомиопатия диагностируется иногда и у мужчин (климакс отмечают у 10–20% лиц мужского пола).
Патогенез
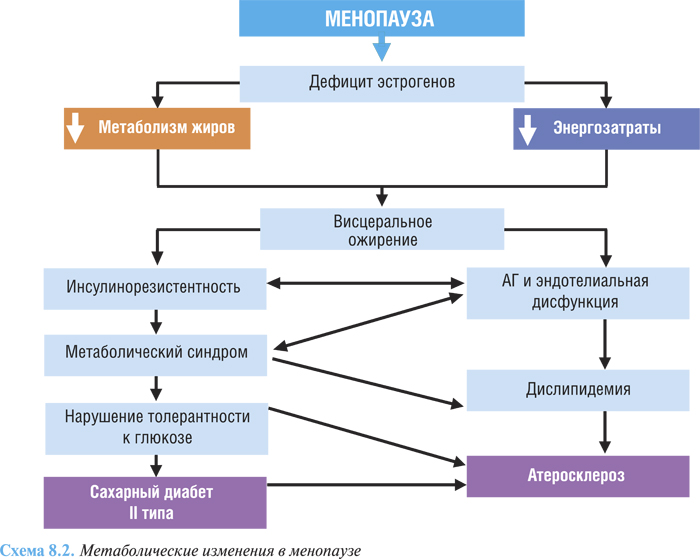
Менопауза, не являясь собственно заболеванием, приводит к нарушению эндокринного равновесия в организме и способствует развитию сердечно-сосудистых заболеваний.
В патогенезе обменных нарушений основное значение имеет нарушение активности эстрогенов, в норме благоприятно влияющих на белковый и электролитный обмен в миокарде и регулирующих симпатические влияния на сердце. При патологическом климаксе в миокарде происходят метаболические нарушения, приводящие к дистрофическим изменениям, в большинстве случаев носящим обратимый характер и лишь в некоторых случаях заканчивающимся развитием миокардиофиброза (кардиосклероза) (схема 8.2). Увеличение количества абдоминального жира и развитие абдоминального ожирения связано как с физиологическими изменениями, так и с изменениями образа жизни. Среди причин абдоминального ожирения после менопаузы можно выделить изменение баланса энергии — снижение скорости обменных процессов наряду с повышением аппетита и увеличением поступления энергии с пищей на фоне повышения тонуса симпатической нервной системы, усиления глюкокортикоидной стимуляции и падения уровня гормона роста. В основе патогенеза климактерической АГ лежит гипоэстрогения, которая сопровождается повышением возбудимости гипоталамо-гипофизарных структур, нарушением центральной и периферической регуляции сосудистого тонуса. Одним из механизмов является отсутствие в период менопаузы депрессорного эффекта фолликулярного гормона.
Клиническая картина
Наиболее распространенными являются жалобы на продолжительную, почти постоянную боль в области сердца разнообразного характера, локализующуюся слева от грудины, в области верхушки. Боль не провоцируется физическим напряжением. Кардиалгия не прекращается после приема нитроглицерина. Характерно сердцебиение при нормальном пульсе, не связанное с физической нагрузкой, нередко появляется в покое.
Больные часто жалуются на ощущение неудовлетворенности вдохом, невозможность вдохнуть полной грудью, которое не связано с физическими нагрузками и часто возникает в покое.
Типичны нарушения функции вегетативной нервной системы: гиперемия или побледнение кожи, потливость, приливы крови, сердцебиение, онемение конечностей, озноб, нарушение ритма дыхания, полиурия, головокружение, нарушение терморегуляции.
Большое количество жалоб обусловлено изменениями психического состояния: эмоциональная лабильность, раздражительность, плаксивость, повышенная возбудимость, нередко подавленное настроение, страхи, ухудшение памяти. Усугубление симптомов связано с нагрузками, особенно эмоциональными.
При патологическом климаксе нередко возникает симптоматическая АГ. Впоследствии, после исчезновения приливов крови и других проявлений климактерического синдрома, невротическое состояние может стать причиной развития гипертонической болезни.
У большинства мужчин с климактерической кардиомиопатией отмечают те или иные симптомы патологического климакса со стороны мочеполовой системы: отсутствие или снижение (редко повышение) либидо, снижение потенции. Больные часто жалуются на расстройства мочеиспускания, что обычно связано с доброкачественной гиперплазией предстательной железы.
Вазомоторный синдром проявляется в виде приливов крови, то есть внезапно возникающего ощущения жара в верхней половине туловища, коже лица, шеи, которое сменяется последовательно гиперемией и потоотделением. Наряду с приливами крови в отдельных областях тела пе риодически появляются парестезии: ощущение онемения, покалывания, ползания мурашек.
Климактерическая кардиомиопатия может возникнуть остро или развиваться постепенно. Характерно несоответствие между интенсивностью и длительностью болевого синдрома и удовлетворительным состоянием кровообращения.
При объективном обследовании характерно несоответствие между обилием жалоб и отсутствием клинических признаков коронарной или СН.
Диагностика
На ранних стадиях климактерическая кардиомиопатия протекает чаще изолированно и характеризуется типичной клинической картиной заболевания. В более поздние периоды клиническая картина зависит от присоединения ИБС, воспалительных процессов в миокарде и других болезней, что несомненно отягощает течение кардиомиопатии и ухудшает прогноз.
Лечение
Должно быть направлено на устранение всех симптомов заболевания. Важное значение имеет модификация образа жизни, включающая повышение физической активности и соблюдение диеты с ограничением потребления насыщенных жиров и увеличением в рационе доли моно- и полиненасыщенных жиров и грубой клетчатки. Для нормализации деятельности нервной системы обычно назначают седативные препараты, транквилизаторы, иногда антидепрессанты.
Для лечения АГ в постменопаузе наиболее целесообразно назначение ингибиторов АПФ и диуретиков, которые должны быть нейтральными в отношении показателей углеводного и липидного обмена. Женщинам в постменопаузе должны назначаться только высокоселективные блокаторы β-адренорецепторов новой генерации, не оказывающие негативного воздействия на липидный и углеводный обмен.
Назначение заместительной гормонотерапии является патогенетически обоснованным в лечении больных с климактерической кардиомиопатией. Применяют препараты, содержащие эстрогены и гестагены. Половые гормоны подавляют повышенную активность гипоталамо-гипофизарных структур мозга и опосредованно влияют на сердце, нормализуя влияние вегетативной нервной системы. Не исключено, что половые гормоны ослабляют повышенную активность САС и тем самым нормализуют метаболические процессы в миокарде. Эстрогены оказывают непосредственное сосудорасширяющее действие на коронарные сосуды, а также нормализуют электролитный и белковый обмен в миокарде. Дозы и общая продолжительность лечения зависят от исходного гормонального фона и уровня эстрогенов, лечение следует проводить под наблюдением эндокринолога. Необходимо отметить, что климактерическая кардиомиопатия является самоизлечивающимся заболеванием, при котором гормоны оказывают лишь вспомогательное заместительное действие, гормональную терапию следует назначать на длительный срок. Лечение гормонами устраняет тягостные проявления климактерического синдрома и после окончания возрастной перестройки эндокринной системы заболевание исчезает.
Прогноз
Как правило, благоприятный. Снижение трудоспособности в большинстве случаев носит временный характер. Полное выключение больных из привычной трудовой обстановки, как правило, играет отрицательную роль, приводит к излишней концентрации внимания на тягост ных ощущениях со стороны сердца.
ПОРАЖЕНИЯ СЕРДЦА ПРИ НАРУШЕНИИ ОБМЕНА ВЕЩЕСТВ
Нарушения обмена веществ в организме всегда отражаются на течении метаболических процессов в миокарде, нередко вызывая нарушение его функции и структуры. При различных заболеваниях первоначально могут нарушаться один или несколько путей метаболизма, что в дальнейшем обязательно отражается на энергообеспечении сердечной мышцы. При некоторых нарушениях обмена в межуточной ткани миокарда и в коронарных сосудах откладываются патологические продукты нарушенного метаболизма белков, углеводов, минералов или накапливаются избыточные компоненты нормального обмена. К таким заболеваниям относят амилоидоз, гликогеноз, гемохроматоз и др.
НАРУШЕНИЯ БЕЛКОВОГО ОБМЕНА. АМИЛОИДОЗ
Определение
Амилоидоз — системное заболевание неустановленной этиологии, характеризующееся внеклеточным отложением в органах и тканях (главным образом в медии артерий, периваскулярной соединительной и нервной ткани, в ретикулоэндотелиальной системе, а также миокарде, почках, печени, коже) особого белка β-фибриллярной структуры — амилоида.
Этиология и патогенез
Амилоидоз является следствием нарушения белкового обмена и может быть приобретенным или наследственным. Наследственный амилоидоз является аутосомным доминантным заболеванием. Ряд авторов связывают развитие заболевания с изменением свойств белков тканей вследствие аутоиммунных процессов под влиянием комплекса антиген — антитело. Диспротеинемия с накоплением в плазме крови грубодисперсных фракций белка и аномальных белков (парапротеинов) ведет к выходу последних из сосудов ткани с образованием амилоидных субстанций.
В последние годы стала возможной более точная биохимическая идентификация белков, входящих в состав амилоидных фибрилл, на основании чего выделены типы амилоида, определена связь отдельных типов с клиническими формами амилоидоза, изучены белки-предшественники, предположительно участвующие в синтезе белков.
Выделяют четыре типа амилоидоза: первичный (системный), вторичный, семейный (наследственный) и сенильный (старческий).
Наиболее распространен первичный тип (85%) с преимущественным поражением сердца, при котором амилоид образован легкими цепями молекул k и λ иммуноглобулина (AL-тип), часто ассоциирован с миеломной болезнью, бо лее часто отмечают у мужчин и редко в возрасте младше 30 лет.
Вторичный амилоидоз возникает в результате образования неиммуноглобулиновых белков, миофибриллы содержат амилоидный протеин А, не относящийся к иммуноглобулинам (АА-тип), что часто происходит при хронических воспалительных заболеваниях — ревматоидном артрите, туберкулезе, болезни Крона и при семейной средиземноморской лихорадке.
Семейный или наследственный амилоидоз чаще всего является следствием образования мутантного белка преальбумина (транстиретина). Установлен аутосомно-доминантный тип наследования. Выявлены гены, ответственные за синтез этих белков, и идентифицирован характер генных мутаций.
Сенильный кардиальный амилоидоз, также известный как амилоид SSA, возникает вследствие образования патологического транстиретина у лиц старшего возраста. Выделяют две формы связанного с возрастом амилоидоза — амилоидоз предсердий, который охватывает только предсердия, и старческий аортальный амилоидоз, ограниченный аортой.
Патологическая анатомия
Миокард при амилоидозе сердца очень плотный на ощупь, утолщенный, мало поддается растяжению. Объем полостей сердца существенно не изменен или незначительно увеличен. Амилоид откладывается в разных отделах сердца, преимущественно в миокарде предсердий и желудочков, эндокарде, в клапанах, перикарде, нередко в синусном и AV-узлах, а также в мелких артериальных и венозных сосудах, включая vasa vasorum коронарных артерий, суживая их просвет вплоть до полной обтурации. В результате мышечные волокна сердца оказываются «замурованными» в массах амилоида, что приводит к атрофии сократительного миокарда.
Клиническая картина
Амилоидное поражение сердца не имеет специфических симптомов, развивается постепенно и может длительное время протекать бессимптомно, даже при выявлении отложений амилоида в миокарде при биопсии. Следует обратить внимание, что во время появления симптомов существует весьма значительная инфильтрация сердца амилоидом. У некоторых пациентов возникает боль в области сердца, иногда носящая стенокардический характер как следствие накопления депозитов амилоида в коронарных артериях.
В 10–15% случаев отмечается ортостатическая гипотензия, иногда с симптомами синкопальных состояний.
При аускультации на фоне глухих тонов сердца можно выслушать систолический шум митральной регургитации, при развитии СН — протодиастолический ритм галопа.
Часто определяют различные нарушения ритма, которые нередко могут быть причиной внезапной смерти. У некоторых больных отмечается выраженная брадикардия.
СН выявляют у 45–56% больных. Вначале доминирует правожелудочковая СН с повышенным давлением в яремных венах, гепатомегалией, периферическими отеками, асцитом. Затем возникает систолическая дисфункция и застойная СН.
Диагностика
Изменения на ЭКГ неспецифичны, наиболее типично наличие брадикардии, снижение амплитуды зубцов. Иногда наличие патологического зубца Q и отсутствие зубца R в отведениях V1–3 симулируют ИМ. Накопление депозитов амилоида в проводящей системе могут обусловливать различные расстройства образования импульса и проведения — возможны различные нарушения проводимости, включая полную блокаду сердца: часто выявляются предсердные и желудочковые нарушения ритма (синдром слабости синусного узла, фибрилляция предсердий (у 30% больных), желудочковая экстрасистолическая аритмия).
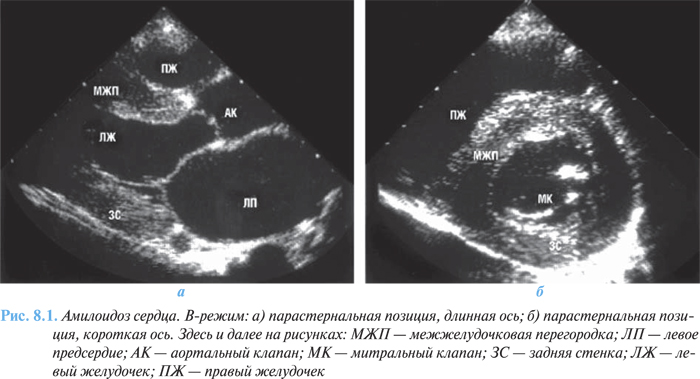
Двухмерная эхоКГ и допплерография являются основными методами неинвазивной диагностики. При обследовании выявляют нормальные или уменьшенные размеры полости ЛЖ со значительным утолщением миокарда и характерным нарушением его структуры с диффузным гранулярным блеском (рис. 8.1 а, б ). Отмечается также утолщение межпредсердной перегородки и створок клапанов, увеличение предсердий, наличие небольшого или умеренного перикардиального выпота. Нарушение диастолической функции ЛЖ и ПЖ происходит по рестриктивному типу нарушения их наполнения. В тяжелых случаях выявляются признаки различной степени нарушения систолической функции обоих желудочков.
При рентгеноскопии отмечают уменьшение пульсации контура сердца, размеры сердца увеличены (кардиомегалия) и обычно не соответствуют степени тяжести застойной СН.
К достижениям последних лет относится введение в клиническую практику метода сцинтиграфии с меченным 123 I сывороточным Р-компонентом (SАР) для оценки распределения амилоида в организме. Р-компонент содержится в небольшом количестве (5–10%) в амилоиде всех типов; радиоактивный SАР, введенный больному амилоидозом, специфически связывается с амилоидными депозитами и может быть визуализирован и количественно оценен на серии сцинтиграмм. Метод особенно полезен для контроля за динамикой тканевых отложений амилоида в процессе лечения.
Для диагностики также используют сцинтиграфию с изотопом технеция 99m Тс-пирофосфатом, способным связываться с амилоидом многих типов, однако эта проба оказывается положительной только при значительных отложениях амилоида в сердце, которые можно определить и с помощью эхоКГ.
МРТ используется для идентификации утолщения миокарда и небольшого размера полости ЛЖ при амилоидозе, что сопоставимо с данными эхоКГ.
Диагноз «амилоидоз» должен быть подтвержден эндомиокардиальной биопсией. При изучении биоптатов тканей важно не только выявить амилоид, но и провести иммуногистохимическое исследование для идентификации его типа.
Диагноз «амилоидоз сердца» чаще устанавливают при аутопсии, поскольку при жизни в ряде случаев не выявляют объективных причин, которыми можно было бы объяснить возникновение патологических признаков.
Лечение
Терапия при первичном амилоидозе включает клеточную антиплазменную терапию, которая останавливает продукцию легких цепей, а также применение алкилирующих средств (мелфалан) и преднизолона. Благоприятный эффект химиотерапии показан в двух рандомизированных испытаниях. Перспективна трансплантация стволовых клеток с органной ремиссией в 50% случаев. Другим подходом к лечению амилоидоза сердца может быть применение талидомида с дексаметазоном. Недавно показана эффективность леналидомида.
Для лечения пациентов с нарушениями ритма сердца назначают антиаритмические препараты. При явлениях полной поперечной блокады и слабости синусного узла эффективна имплантация искусственного водителя ритма. Кардиостимуляторы применяют для лечения пациентов с тяжелыми клинически выраженными нарушениями проводимости.
СН часто рефрактерна к медикаментозной терапии. Для уменьшения недостаточности кровообращения основными препаратами являются диуретики, которые применяют с осторожностью в низких дозах, и вазодилататоры — ингибиторы АПФ или блокаторы рецепторов ангиотензина II, хотя они плохо переносятся и могут вызвать значительную артериальную гипотензию или ортостатические симптомы, особенно у пациентов с амилоид-индуцированной дисфункцией автономной нервной системы. Не рекомендуется применять дигоксин из-за его токсичности и опасности развития аритмий, однако при тщательном ЭКГ-мониторировании его можно применять для контроля ритма у пациентов с фибрилляцией предсердий.
Блокаторы кальциевых каналов неэффективны в лечении при амилоидозе сердца. Больные могут быть гиперчувствительны к негативным инотропным эффектам блокаторов кальциевых каналов, их применение может привести к нарастанию симптомов декомпенсации.
Блокаторы β-адренорецепторов могут спровоцировать угрожающие жизни нарушения проводимости.
При резком снижении сократительной способности предсердий, свидетельствующем о массивной инфильтрации, даже при синусовом ритме показано применение антиагрегантов или антикоагулянтов, что обусловлено повышенным риском тромбообразования.
Трансплантация сердца обычно не проводится, поскольку возникают рецидивы амилоидоза в аллотрансплантате, а также неуклонное прогрессирование его в других органах, что сокращает продолжительность жизни больных.
Прогноз
НАРУШЕНИЯ ПРЕИМУЩЕСТВЕННО ЛИПИДНОГО ОБМЕНА
ГОЛОДАНИЕ И КАХЕКСИЯ
Патогенез
Патологическая анатомия
При голодании микроскопически отмечают вакуолизацию миофибрилл, особенно вокруг ядер, изменения хроматина ядер и митохондрий. В далеко зашедших случаях выявляют бурую атрофию и дистрофические изменения миокарда.
Клиническая картина и диагностика
Основными проявлениями нарушения функции сердечно-сосудистой системы при голодании являются синусовая брадикардия, уменьшение МОК, снижение венозного давления и АД (преимущественно систолического), что нередко сопровождается головокружением, а при быстром перемещении из горизонтального положения в вертикальное — обмороком. Часто возникают отеки, обусловленные гипопротеинемией и увеличением ОЦК (но не СН).
Лечение заключается в восстановлении полноценного питания.
ОЖИРЕНИЕ
Эпидемиология
Эпидемиологические исследования свидетельствуют, что ожирение связано с сердечно-сосудистыми заболеваниями и преждевременной смертностью. Ожирение само по себе приводит к комплексному и прогностически неблагоприятному поражению сердца. Вероятность развития ГЛЖ у лиц с нормальной массой тела составляет 5,5%, а у лиц с ожирением — 30%. По данным Фремингемского исследования установлено наличие высокодостоверной связи между ИМТ, полостными размерами и толщиной стенок ЛЖ.
По современным представлениям ожирение представляет собой независимый фактор риска развития СН, являясь ее причиной у 11% мужчин и 14% женщин в США. По данным Фремингемского исследования увеличение ИМТ на каждый 1 кг/м 2 повышает риск развития СН на 5% у мужчин и на 7% у женщин независимо от других факторов риска.
Этиология
Ожирение может быть самостоятельным заболеванием, возникающим вследствие избыточного потребления пищи с высокой калорийностью, или синдромом, сопровождающим различные заболевания, и развиваться вследствие ряда нейроэндокринных, социальных, поведенческих и генетических факторов. Генетические факторы играют важную роль в развитии ожирения. Результаты исследований свидетельствуют, что существует редко идентифицируемая группа генов, вызывающих значительное ожирение, однако чаще выявляют гены «восприимчивости», которые детерминируют склонность к ожирению и регулируют распределение жировой массы в организме, скорость обменных процессов и их реакцию на физическую активность и диету, контролируют пищевые привычки. Идентифицировано более 41 сайта в геноме, которые, возможно, связаны с развитием ожирения в популяции.
Патогенез
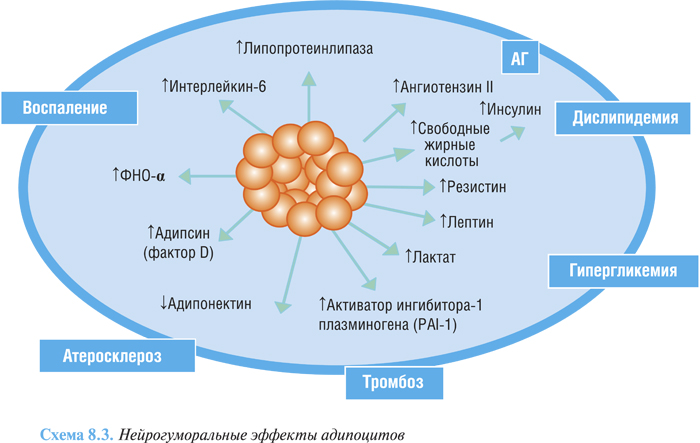
При ожирении происходит постепенное увеличение размеров клеток жировой ткани, ведущее к изменению их свойств. Гормонально-метаболические сдвиги, характерные для ожирения, могут напрямую воздействовать на структуру и массу миокарда. У пациентов с ожирением адипоциты жировой ткани высвобождают большое количество биологически активных субстанций, участвующих в регуляции сосудистого тонуса: ангиотензин II, интерлейкины, проста гландины, эстрогены, ИФР, ФНО-α, ингибитор активатора плазминогена-1, лептин и другие, что повышает риск развития сердечно-сосудистых осложнений, при этом снижается уровень адипонектина, специфического циркулирующего белка жировой ткани, который вовлечен в регулирование метаболизма липидов и глюкозы (схема 8.3). Синтезируемый в жировой ткани лептин, важный маркер энергетического баланса, стимулирует гиперсимпатикотонию, способствует повышению уровня АКТГ, кортизола и альдостерона.
Ведущее значение в развитии различных форм ожирения имеют изменения функционирования гипоталамо-гипофизарной системы. Эндоканнабиноидная система, представленная в мозге (гипоталамусе) и периферически в жировой ткани (адипоцитах), печени, скелетных мышцах и пищеварительном тракте, посредством каннабиноидных рецепторов 1-го типа (СВ1) участвует в центральной и периферической регуляции энергетического баланса, а также метаболизме глюкозы и липидов, играет роль в контроле потребления пищи и массы тела. Гиперактивация этой системы ассоциирована с мотивацией к увеличенному потреблению пищи и ожирением и приводит к нарушению механизмов обратной связи, которые поддерживают устойчивый гомеостаз.
Присоединение АГ при ожирении происходит примерно у 60% больных, механизмы ее формирования связывают с развитием гормонально-метаболических отклонений, вызванных накоплением жировой ткани. Ключевую роль среди них играет развитие инсулинорезистентности и компенсаторной гиперинсулинемии, которая, усиливая задержку натрия почками, способствует дальнейшему росту ОЦК. Гипертензивное действие может оказывать и лептин, стимулирующий симпатическую нервную систему. Ожирение, АГ, дислипидемию и гипергликемию, в основе которых лежит инсулинорезистентность, объединяют в понятие «метаболический синдром».
При высокой степени ожирения нельзя исключить определенную роль гипоксии в изменении нейроэндокринной регуляции кровообращения и в развитии дистрофии миокарда. Включение гипоксического фактора в патогенез дистрофических поражений сердца может стать существенным механизмом не только их возникновения, но и развития СН.
Гемодинамика
Сердце у больных ожирением испытывает перегрузку объемом. ОЦК и объем плазмы крови увеличиваются пропорционально степени увеличения массы тела, что приводит к увеличению наполнения ЛЖ и ударного объема, дилатации и росту массы ЛЖ. Считается, что нарастание сердечного выброса при ожирении физиологически связано с удовлетворением метаболических потребностей возросшей тканевой массы тела. Развитие сердечно-сосудистых осложнений при ожирении связано с истощением компенсаторных механизмов миокарда, обусловленным увеличением величины ОЦК, которая формируется пропорционально объему сосудистой сети периферических тканей. Нарастающее содержание жировой ткани в организме десинхронизирует физиологические взаимосвязи между сердцем и кровотоком периферических метаболически активных тканей.
Сердечный выброс в состоянии покоя у больных с тяжелой степенью ожирения достигает 10 л/мин, причем на обеспечение кровотока в жировой ткани используется от ⅓ до ½ этого объема. Увеличенный объем крови в свою очередь увеличивает венозный возврат в ПЖ и ЛЖ, вызывая их дилатацию, увеличивая напряжение стенки. Это приводит к ГЛЖ, которая сопровождается снижением диастолической податливости камеры, приводя к повышению давления наполнения ЛЖ и его расширению.
Увеличение толщины миокарда снижает чрезмерное напряжение его волокон, что позволяет сохранить нормальную сократительную способность ЛЖ, одновременно создает предпосылки для диастолической дисфункции, в основе которой лежит относительное уменьшение количества капилляров на единицу объема мышечной ткани и ухудшение условий диффузии кислорода в гипертрофированных мышечных волокнах. По мере прогрессирования дилатации ЛЖ увеличение напряжения стенки приводит к систолической дисфункции.
Патологическая анатомия
При ожирении отмечают увеличенное отложение жировой ткани под эпикардом обоих желудочков и в поверхностных слоях миокарда, что со временем приводит к атрофии мышечных волокон, замещению их жировой тканью (cor adiposum). Миокард на разрезе имеет желтоватый оттенок. Выявляют наличие диффузной мышечной гипертрофии, которая является наиболее характерным проявлением ожирения со стороны сердечно-сосудистой системы.
Клиническая картина
Жалобы на боль в сердце ноющего, колющего характера, сердцебиение и перебои в работе сердца при физических нагрузках. По мере накопления избыточной массы тела постепенно развивается прогрессирующая одышка при нагрузках, возникает ортопноэ и пароксизмальная ночная одышка, появляются отеки нижних конечностей, возможно увеличение живота в объеме.
Во многих проспективных исследованиях установлено, что увеличение массы тела приводит к повышению АД. У больных с ожирением высок риск присоединения ИБС, течение которой особенно агрессивно и тяжело.
Сердце принимает «поперечное» положение из-за высокого стояния диафрагмы, смещаясь влево и несколько кзади. Аускультативно определяется выраженная глухость тонов. Пульс имеет склонность к учащению.
При крайних степенях ожирения иногда отмечают клинический синдром, проявляющийся сочетанием сонливости, альвеолярной гиповентиляции и легочной гипертензии с гипертрофией ПЖ — синдром Пиквика.
Диагностика
При эхоКГ-исследовании выявляют гипертрофию и дилатацию ЛЖ, увеличение левого предсердия, диаметра восходящей аорты. С помощью допплеровской эхоКГ выявляют признаки диастолической дисфункции, может определяться аортальная регургитация. В последующем происходит нарушение и систолической функции. Возможно расслоение листков перикарда за счет отложения жира. Проведение эхоКГ-исследования часто затруднено из-за большой толщины грудной клетки, сужения межреберных промежутков, смещения сердца кзади.
При изучении гемодинамических показателей у всех пациентов выявлено увеличение ОЦК, что сопровождается нарастанием ригидности миокарда ЛЖ, ростом давления его наполнения и УОК. С увеличением степени ожирения повышается конечное диастолическое давление в ПЖ, среднее давление в ЛА, давление заклинивания в легочных капиллярах и конечное диастолическое давление в ЛЖ. Эти изменения вызывают расширение полостей левого предсердия, ПЖ и правого предсердия. Давление крови в ПЖ, как правило, также повышено.
Рентгенологическая картина всегда изменена вследствие высокого стояния диафрагмы и скопления жира в области верхушки сердца, что создает картину его кажущегося увеличения. Пульсация вялая, тонус сердца понижен.
Лечение
Начальные дистрофические изменения миокарда при ожирении являются в значительной мере обратимыми при нормализации массы тела. Первоочередным этапом лечения является коррекция пищевых привычек и повышение физической активности. Специфические рекомендации включают 30 мин физической активности по крайней мере 5 раз в неделю, уменьшение калорийности пищи в среднем до 1500 ккал/сут, снижение потребления жиров до 30–35% дневной энергетической ценности (с оговоркой 10% для мононенасыщенных жирных кислот, например оливковое масло), отказ от трансгенных жиров, увеличение потребления продуктов, содержащих волокна, до 30 г/сут и отказ от жидких моно-и дисахаридов.
Для уменьшения массы тела применяют медикаментозные и хирургические методы лечения ожирения. Назначают ингибиторы липаз (средства периферического действия) и анорексигенные средства (центрального действия).
Лечение сердечно-сосудистых расстройств у больных с ожирением зависит от характера поражения сердца. Для лечения АГ наиболее целесообразно назначение ингибиторов АПФ и диуретиков, которые должны быть нейтральными в отношении показателей углеводного и липидного обмена. Должны назначаться только высокоселективные блокаторы β-адренорецепторов новой генерации, не оказывающие негативного воздействия на липидный и углеводный обмен.
При наличии признаков СН лечение проводят в соответствии с современными рекомендациями.
АЛКОГОЛЬНАЯ КАРДИОМИОПАТИЯ
Эпидемиология
Одна из форм алкогольного поражения сердца, отмечается у 50% лиц, на протяжении длительного времени злоупотребляющих алкоголем.
Алкогольную кардиомиопатию выявляют приблизительно у ⅓ всех больных с неишемической кардиомиопатией, 40–50% больных умирают в течение 3–6 лет.
Этиология
Этиологическим фактором является этанол и/или его метаболиты. Развитие алкогольной кардиомиопатии могут обусловить стрессовые состояния, недостаточность питания (дефицит белков, витаминов), наследственная предрасположенность, вирусная инфекция на фоне снижения иммунитета, изменения исходного состояния миокарда. Не всегда отмечается отчетливый параллелизм между количеством употребляемого этанола, длительностью интоксикации и выраженностью поражения сердца.
Патогенез
Основной из метаболитов этанола, ацетальдегид, оказывает прямое повреждающее воздействие на клеточные и субклеточные мембраны кардиомиоцитов, связанное с их способностью растворять липиды и увеличивать текучесть биологических мембран. На определенном этапе интоксикации это может вызывать нарушение обмена веществ в миокарде и ингибирование основных путей утилизации энергии в клетках сердца, в результате угнетения функции дыхательной цепи митохондрий возникает гипоксия миокарда. Опосредованное воздействие происходит в результате влияния алкоголя на различные отделы нервной системы и функцию надпочечников.
Патологическая анатомия
Длительное употребление алкоголя вызывает жировую инфильтрацию миокарда, дегенеративные изменения в стенках коронарных артерий и нейронах, расположенных в сердце. При микроскопическом исследовании отмечают исчезновение поперечной исчерченности миофибрилл, пикноз ядер, интерстициальный отек, вакуольную и жировую дистрофию, иногда единичные или множественные очаги некроза, мелкие участки фиброза.
Клиническая картина
Как правило, больные упорно отрицают злоупотребление алкоголем.
Развернутую клиническую картину с явлениями СН, стойкими нарушениями ритма и проводимости, тромбоэмболическими осложнениями, кардиомегалией выявляют редко.
Первым клиническим проявлением наиболее часто бывают нарушения ритма без признаков застойной СН. Развитие заболевания имеет несколько стадий — от функциональных расстройств, нарушений ритма сердца преходящего характера до стойкой гипертрофии миокарда с последующим развитием СН.
К наиболее частым и типичным клиническим симптомам относят:
Начальными признаками заболевания принято считать сердцебиение и одышку при физической нагрузке. На более поздних стадиях заболевания состояние пациентов постепенно ухудшается.
Диагностика
О наличии алкогольной кардиомиопатии может свидетельствовать отсутствие определенной причины фибрилляции предсердий (тиреотоксикоз, ревматический порок сердца) у мужчин молодого возраста.
Диагностику затрудняет и отсутствие маркеров алкогольного поражения сердца.
Диагностировать алкогольную кардиомиопатию легче в том случае, если в анамнезе имеются указания на длительное употребление алкоголя и определяются клинические признаки кардиомегалии, аритмии или застойной СН при отсутствии других причин, способных привести к аналогичным нарушениям сердечной деятельности.
При эхоКГ-исследовании отмечается дилатация полости ЛЖ, снижение его сократительной способности, возможна диффузная гипоксия. При допплеровском исследовании могут выявляться признаки митральной регургитации.
Лечение
При лечении обязательно исключают употребление алкоголя. Полная абстиненция может остановить прогрессирование поражения сердца на ранних этапах (обычно в первые 2–6 мес).
На ранних стадиях без проявлений СН и при наличии кардиалгии, тахикардии, АГ и аритмии рекомендованы блокаторы β-адренорецепторов. При выраженной кардиомегалии следует назначать сердечные гликозиды, однако строго контролировать их прием в целях предупреждения кардиотоксического эффекта. В комплексное лечение включают мочегонные средства, витамины, анаболические гормоны, соли калия и магния.
Прогноз
При полном отказе от употребления спиртных напитков и под влиянием лечения размеры сердца у больных с алкогольной кардиомиопатией нередко уменьшаются. Восстановление основных функций миокарда и улучшение общего состояния наступают очень медленно, сроки относительного выздоровления исчисляются месяцами и годами.