что такое талий и где применяется
Таллий элемент. Свойства таллия. Применение таллия
Таллий – греческое имя, переводится как «зеленая ветвь». Почему так назвали химический элемент? Дело в цвете талия при сгорании. Пламя зеленое. Оно-то и помогло открыть металл. Это произошло в 1863-ем году. Английский ученый по фамилии Крукс завладел спектроскопом и отходами сернокислого завода немецкого города Тильперод.
Химические и физические свойства таллия
Таллий – металл голубовато-белого цвета. Элемент мягкий, не имеет вкуса, не пахнет. Это делает вещество особенно опасным, ведь талий ядовит. Коварны и проявления отравления. Симптомы близки к гриппу, бронхопневмонии и другим заболеваниям воспалительного характера.
При этом, исход нередко летальный. К смерти взрослого человека приводит всего 1 грамм таллия. Он впитывается не только в пищеварительном тракте, но и проникает через кожу, вдыхается вместе с воздухом.
Таллий – элемент, на 3-4-е сутки после принятия которого наступает эйфория. Это ложное ощущение здоровья и полноты жизни. Но, потом возвращаются тошнота, рвота, начинается понос, выпадение волос, трескаются углы рта. На этой стадии уже понятно, что имеешь дело не с гриппом, но, бывает уже поздно. Характерные симптомы проявляются через 1-2-е недели после отравления таллием.
Яд быстро окисляется, попадая в атмосферу. Поэтому, транспортируют элемент лишь в герметичных контейнерах. Содержание токсичного металла в воздухе не должно превышать 0,004 мг/м3. Для воды опасен показатель уже в 0,0001 мг/м3. В природе указанные уровни, как правило, не превышаются.
Таллий – редкий и рассеянный элемент. Повышенная концентрация наблюдается лишь в силезских марказитах и еще нескольких минералах. Силезия – область Германии. Но, таллий в ее недрах обнаружил в 1896-ом году русский химик и геолог Антипов.
Свойство таллия окисляться проявляется ярче при высоких температурах. Так, при 100-та градусах Цельсия металл покроется пленкой моментально. Поднимись температура еще втрое, вещество расплавится. Закипает таллий при 1460-ти градусах. Есть элементы, реакция с которыми проходит уже при комнатной температуре. В ней можно получить хлорид таллия, а так же, связать его с бромом и йодом.
В химических соединениях таллий бывает либо одна-, либо двухвалентный. Валентность – способность соединяться с атомами других веществ. Соответственно, 81-ый металл периодической системы образует связи по одному или трем направлениям.
Применение таллия
Об этом свойстве оксисульфида таллия впервые написали в журнале Physical Review в 1920-ом году. Сделанные через 5 лет фотоэлементы оказались особо чувствительны к лучам инфракрасного спектра.
Хорошо пропускают инфракрасный свет бромиды и йодиды редкого металла. Поэтому, во времена Второй Мировой таллий купить захотели военные. Смешанные кристаллы взращивали в платиновых тиглях, чтобы потом поместить в инфракрасные сигнализации. Соединения таллия пригождались и при вычислении вражеских снайперов.
Таллий, электронная формула которого KLMN5s 2 5p 6 5d 10 6s 2 6p 1 Eион(Me=>Me + +e)=6,12эВ, имеет отношение и к загару. Он является реакцией кожи на ультрафиолетовое излучение, начинается активная выработка меланина – природного пегмента-красителя.
Цена таллия известна не только физиотерапевтам, но и врачам общей практики, трихологам. Металл входит в смеси для удаления волос. Процедура бывает необходима при поражении стригущим лишаем. К облысению приводят соли таллия. Главное, подобрать терапевтическую дозу. Чуть переборщишь, получишь токсичный, а не лечебный эффект.
Гидроксид таллия и карбонат – добавки в стекло с повышенным светопреломлением, а чистый металл пригождается в металлургии. 81-ый элемент добавляют в некоторые сплавы, чтобы сделать их устойчивыми к кислотам, более прочными и износостойкими.
Сплавом является и амальгама таллия. Она твердеет лишь при 60-ти градусах Цельсия. Смесь нужна для производства термометров, используется в жидкостных затворах и переключателях. В контрольно-измерительной же аппаратуре пригождаются радиоизотопы таллия. Они служат чистым бето-излучателем.
Добыча таллия
Наиболее насыщенны таллием земли Европы, Канады и США. Но, в штатах с 1981-го года добыча ядовитого металла запрещена. Основным поставщиком элемента является Казахстан. Его поставщики предлагают рафинированный таллий. Его запасы связаны не только с рудами других металлов, но и с залегающими в земной коре пластами угля. В них сокрыты 630 тысяч тонн 81-го элемента.
Из минералов таллий содержат врбаит, лорандит, крукезит, гутчинсонит. Перечисленные камни встречаются редко. Зато, доля 81-го металла в них велика – от 16-ти до 80-ти процентов. За 90% зашкаливает содержание таллия в авиценните.
Это почти чистая окись трехвалентного металла открыта в 1956-ом году. Залежи камня нашли на территории Узбекской ССР. Ныне, она стала Казахстаном. Вот и объяснение, откуда страна берет сырье, чтобы снабжать таллием почти весь мировой рынок.
Цена таллия
За килограмм таллия просят почти 7 тысяч долларов. С 2003-го года цена выросла в 7 раз. Один Казахстан, хоть и производит много металла, но не может обеспечить им всех желающих. Канадский таллий дороже среднего. Выгодным предложением всегда были поставки из Китая.
Но, в Поднебесной решили устранить налоговые льготы при экспорте редкого элемента. Это способствовало уменьшению закупок. На мировом рынке начал ощущаться дефицит таллия, что и привело к росту цен на него.
Таллий: свойства и область применение самого токсичного металла
История открытия
Впервые таллий был открыт в 1861 году английским ученым Уильямом Круксом. В это же время параллельно существование металла обнаружил французский химик Огюст Ломи. Заподозрить о существовании элементов ученых подтолкнул необычный зеленый цвет пламени.
Tl был открыт при изучении свинцовых пород. В настоящее время его получают из сульфидных минералов тяжелых металлов. Изначально этот элемент считали щелочным металлом.
Свойства таллия
На воздухе Tl сильно окисляется, покрываясь темным налетом – оксидом таллия. Чтобы защитить этот металл от окисления, его обычно хранят в глицерине.
Чтобы очистить поверхность твердого куска Tl от окиси его нужно опустить в концентрированную азотную кислоту. В ней оксид таллия растворяется, образуя нитрат. Очищенный от оксида таллий выглядит как блестящий металл. Его поверхность имеет немного синеватый оттенок. Его довольно легко спутать с оловом или другим безобидным металлом. Однако делать этого нельзя, так как этот химический элемент очень токсичен.
Температура плавления Tl составляет всего 304˚С. Поэтому, его довольно легко можно расплавить. Но, попадая на воздух, расплавленный металл очень быстро окисляется. Это отличает его от всех вышестоящих металлов 13 группы таблицы химических элементов. Например, если прослеживать активность от алюминия к индию, то можно заметить уменьшение их активности. Индий вообще остается на воздухе блестящим, так как почти не окисляется. Но Tl имеет необычно высокую степень окисления.
По твердости таллий больше напоминает свинец. Он довольно мягкий, легко сминается.
Высокая токсичность
Соединения Tl считаются самыми токсичными среди всех металлов. Сульфат таллия до 1972 года широко использовали в качестве отравы для крыс. Но, впоследствии от него отказались из-за крайне высокой токсичности для человека. Соединения этого вещества безвкусны, поэтому определить их вкусовыми рецепторами невозможно.
Нитрат таллия представляет собой белые кристаллы. Они плохо растворяются в воде. Если к раствору нитрата Tl добавить йодид калия, то мы получим осадок красивого желтого цвета в виде йодида таллия. Это вещество также весьма токсично. Но, несмотря на это имеет несколько областей применения. Одна из них – это светотехника. Увидеть его эффект можно в лампах с зеленым свечением при разогреве. Цвет им дают ионы таллия. Йодид таллия смешивают с бромидом и изготавливают оптические кристаллы, хорошо пропускающие или преломляющие инфракрасное излучение.Хлориды таллия нерастворимы в воде. Эти соединения используются в оптике и лазерной технике.
Новые области применения
В медицине изотоп таллий 201 используют при диагностике внутренних органов. Он помогает увидеть в двухмерном изображении, например, сердце.
Если подвести итог, то можно сказать, что благодаря усовершенствованию технологий, вещества, которые еще недавно были ядами, сегодня успешно помогают лечить заболевания. А еще они освещают наши улицы, И, кто знает, сколько еще полезных свойств и применений получит оно через несколько лет или десятилетий.
Узнать, какими свойстваи обладает самый коварный элемент — теллур, можно здесь.
Отравление таллием
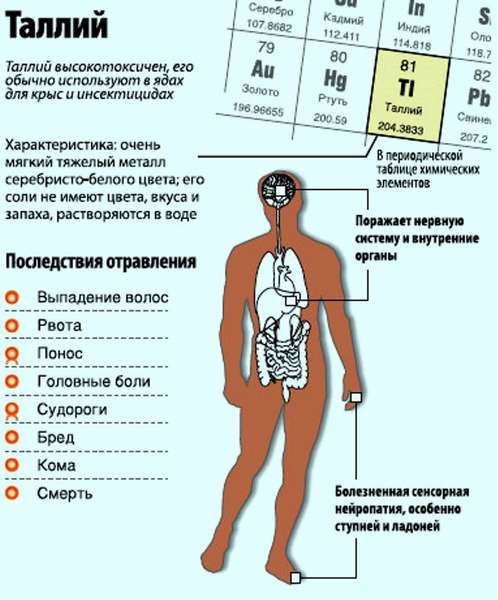
Таллий является редко встречающимся металлом на Земле. Но случаи отравления им не так уж и редки. Отравление таллием протекает тяжело, зачастую приводит к летальному исходу. Сравнить по токсичности можно со свинцом и мышьяком, опасен, как и кристаллический фенол. Более токсичен, чем ртуть, находящаяся перед таллием в таблице Менделеева. Следует познакомиться поближе с этим опасным металлом.
Каковы же его свойства и характеристики?
У вещества порошковая консистенция, бело-серебристой расцветки. Применяется обширно, особенно находясь в составе противоядий от грызунов. Для проведения радиологического обследования сердца используются соли таллия, а также сульфат таллия, как и в роли катализатора для фейерверков и в изготовлении оптических линз.
Этот химический элемент располагается в третьей группе таблицы Менделеева и имеет голубой оттенок. Бывает он одно- и трёхвалентным, более токсичным ядом считается одновалентный элемент. В природе он присутствует мало и не концентрированно, потому добывают его при обработке и добыче солей тяжёлых металлов (например, из свинца). В жирной и водной среде соединения таллия практически не растворяются.
Существует таллий в следующих состояниях:
Также этот элемент встречается в человеческом организме, роль его полноценно еще не изучена. Ученые предполагают, что в организм он попадает вместе с растительной пищей. Содержится он также в:
Оксид таллия, как и прочие его соединения, распределяется по организму равномерно. Меньше всего его в кишечнике, волосяном покрове и зубах, в большом объеме отмечается в жировых тканях, чуть больше в мышцах и жирах. Гидроксид таллия или в другой форме в организме должен быть в пределах 0,1 мг, норма повышается до 0,5 мг при большой мышечной массе.
Какова токсикогенетика этого вида отравления?
Острое отравление таллием может произойти из-за намеренного и случайного попадания в организм больших порций солей металла. Парами и пылью металлов можно получить повреждения дыхательной системы, поражение происходит и при контактах с кожным покровом.
Ядам легко впитываться в кровь, и большая часть оседает в сердечных мышцах, почках, слюнных железах и печени. Сравнительно малой являются отложения в мозге и жировых тканях. Выводится элемент в основном через желудок. Около месяца составляет срок полувыведения яда.
Как же происходит интоксикация?
Отравление солями таллия опасно тем, что он способен не только нарушать структуру клеток, но также и накапливаться в ней. Он способен изменять свойства молекул, так как способен взаимодействовать с различными энедогенными лигандами. Также он может образовывать связи с низкомолекулярными соединениями. Накапливаясь в клетках кожи, вещество поражает их.
Оксид таллия, находясь в организме, выбирает мишенью транспортные системы биомембран, работу ферментов, а также структурные белки. Повреждения происходит также и лизосом, эндоплазматического ретикулума. Механизмы работы биологически активных веществ нарушаются.
Каковы же симптомы?
Отравление таллием происходит при употреблении веществ с содержащимся таллием в количестве более 1 грамма. Летальный исход наступает при приёме дозы в 600 мг. Есть разница во временных рамках проявления симптоматики отравлений, как хронических, так и острых, но можно отследить и общие схожие проявления.
В течение первых 3-4 часов могут проявиться первые симптомы:
В течение следующих 7 суток поражается нервная система, проявляется это в следующих симптомах:
Гидроксид таллия и прочие соли также со временем вызывают нарушения в работе всех систем организма.
Если отравление в хронической стадии, то симптоматика весьма расплывчата, проявиться может на последних стадиях. В основном присутствуют нарушения функционирования желудочно-кишечного тракта. Такое состояние характеризуется следующей симптоматикой:
Как диагностировать?
Чтобы получить информацию о наличии таллия в организме, нет смысла использовать рентген, так как он в данном случае незаметен, используется для диагностирования рентгенограмма. При попадании в организм этого вещества в значительных дозах, его концентрация варьируется в пределах 300-2000 мкг/л, а экскреция за сутки превосходит 10-20 мкг. Оксид таллия в организме также можно заметить при помощи электроэнцефалограммы, заметные небольшие изменения, также в периферических нервах замедляется нервная проводимость.
Варианты лечения
В желудке и кишечнике таллий впитывать помогает прусский голубой, который в кристаллической решетке заменяет таллий калием, благодаря чему он не всасывается в кровь. Употребить нужно 250 мг/кг однократно. Для очищения желудка применяют цитрат магния или маннитол (в качестве слабительных препаратов).
Последствия отравления и профилактические меры
Оксид таллия в организме сверх нормы может привести к тяжелым последствиям, а также нарушить нормальное функционирование организма. Необходимо избегать прямых контактов с веществами, которые содержат в своем составе гидроксид таллия или другие его производные.
Интоксикация имеет не разовые последствия, а более серьезные, ведь таллий очень токсичен. Развиться может бесплодие, число врожденных пороков, импотенция, гормональные нарушения и нарушения психики, хроническими заболеваниями дыхательной системы и желудочно-кишечного тракта. Летальный исход возможен от инфаркта или же инсульта.
Если подвести итоги, то отравление таллием, как высокотоксичным элементом, очень опасно. Отравиться можно не только в производственных условиях, но и в бытовых. Все системы в организме разрушаются под его воздействием, особенно страдает нервная и мышечная системы.
Лечение необходимо начинать сразу же. В первую очередь необходимо ввести прусскую синь, эффективный антидот. Также следует всегда осуществлять профилактические меры и осторожность, особенно на производстве.
Видео
Насколько тяжелым может быть отравление таллием? Ответ на этот вопрос вы найдете, посмотрев видеосюжет.
Опасный металл таллий. Применение
Таллий (Tl) и его соединения очень ядовиты — смертельно 
Опасность представляет попадание металла или его производных на кожу, она начинает быстро разрушаться. Еще более опасно вдыхание паров, поэтому при работе с этим реактивом нужно пользоваться надежными и качественными средствами защиты.
В обычной ситуации человек практически никогда не сталкивается с соединениями таллия, но такая возможность существует на некоторых производствах, в лабораториях и в сельском хозяйстве. Элемент входит в состав многих пестицидов и средств борьбы с вредителями сельскохозяйственных культур.
 |  |
| Полнолицевая маска «ЗМ» серии 6900 | Костюм «Л-1» с хранением |
Все работники, контактирующие с таллием или его соединениями, обязательно проходят предварительный инструктаж по правилам безопасности и методам оказания первой помощи.
Для того, чтобы получить тяжелое отравление, требующее неотложного врачебного вмешательства, достаточно 1 грамма металла. Вдыхание паров может привести к смерти даже при своевременно оказанной помощи.
Острое отравление приводит к сильной боли в желудке, тошноте, рвоте, диарее, судорогам, сильной слабости, тахикардии. Через 6 часов после отравления человек начинает терять координацию движений, речь становится несвязной, парализуются глаза (пострадавший смотрит в одну точку), наблюдается спутанность сознания, потом потеря сознания и кома.
При регулярном воздействии небольших доз симптомы не выражены, человек чувствует лишь постоянное недомогание. Поэтому работники, имеющие дело с соединениями Tl, должны регулярно проходить медосмотр.
Первая помощь при отравлении таллием
Чтобы облегчить состояние пострадавшего и дать ему возможность дождаться врачебной помощи, следует:
• вывести пострадавшего на свежий воздух или в хорошо проветриваемое помещение;
• вызвать скорую помощь;
• дать выпить много теплой воды и вызвать рвоту, чтобы промыть желудок;
• дать выпить сорбенты для впитывания и удаления токсина, например, активированный уголь или Смекту.
Применение
• Чистый металл востребован в производстве стеклообразных полупроводников.
• Монокристаллы галогенидов таллия прозрачны для ИК-излучения; применяются в приборах инфракрасной оптики (линзы, призмы, кюветы, перископы, микроскопы, ИК-спектрометры и т.п.).
• Из галогенидов изготавливаются световоды для лазеров, в том числе для хирургических лазеров.
• Монокристаллы хлорида таллия или его сплава с бромидом востребованы в детекторах высокоэнергетических частиц. Сплавы Tl с цезием используются в детекторах, устанавливаемых в телескопах, химических лазерах.
• Оксид входит в состав сверхпроводящей высокотемпературной керамики. Сверхпроводники, содержащие таллий, отличаются стабильностью и стойкостью к магнитным полям. Пленки из таких материалов применяются в интегральных схемах.
• Входит в состав некоторых сплавов со свинцом, отличающихся высокой стойкостью к коррозии и кислотам. Tl добавляют в подшипниковые свинцовые сплавы.
• Соли элемента используются для выплавки оптических стекол с высоким коэффициентом преломления и дисперсией; для изготовления цветных стекол.
• Соли Tl применяются в косметологии (в лампах для солярия), в медицине (лечение стригущего лишая).
• Радиоактивные изотопы применяются как источник бета-излучения в контролерах толщины полотна бумаги или ткани, в дефектоскопах.
• Соединения с таллием используются в качестве тяжелых жидкостей для разделения минералов по плотности.
• Сульфат таллия — пестицид, применяемый в сельском хозяйстве.