ацетонемический синдром мкб 10 код у детей
Ацетонемический синдром
Весь контент iLive проверяется медицинскими экспертами, чтобы обеспечить максимально возможную точность и соответствие фактам.
У нас есть строгие правила по выбору источников информации и мы ссылаемся только на авторитетные сайты, академические исследовательские институты и, по возможности, доказанные медицинские исследования. Обратите внимание, что цифры в скобках ([1], [2] и т. д.) являются интерактивными ссылками на такие исследования.
Если вы считаете, что какой-либо из наших материалов является неточным, устаревшим или иным образом сомнительным, выберите его и нажмите Ctrl + Enter.
Ацетонемический синдром или АС – это комплекс симптомов, при котором в крови повышается содержание кетоновых тел (в частности, β-оксимасляной и ацетоуксусной кислоты, а также ацетона.
Они являются продуктами неполного окисления жирных кислот, и если их содержание повышается, то происходит сдвиг в обмене веществ.

Код по МКБ-10
Причины ацетонемического синдрома
Чаще всего ацетонемический синдром развивается у детей 12-13 лет. Он появляется из-за того, что в крови повышается количество ацетона и ацетоуксусной кислоты. Этот процесс приводит к развитию так называемого ацетонемического криза. Если подобные кризы происходят регулярно, то можно говорить о заболевании.
Как правило, ацетонемический синдром встречается у детей, которые болеют на нервно-артрический диатез, некоторые эндокринные заболевания (сахарный диабет, тиреотоксикоз), лейкемию, гемолитическую анемию, заболевания желудочно-кишечного тракта. Часто эта патология встречается после сотрясения мозга, аномальном развитии печени, при опухоли мозга, голодании.

Патогенез
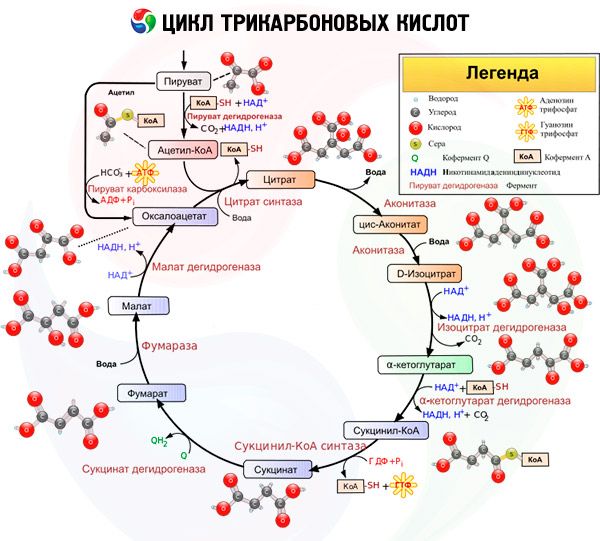
Пути катаболизма белков, углеводов и жиров в нормальных физиологических условиях пересекаются на определенных этапах в так называемом цикле Кребса. Это универсальный источник энергии, который позволяет организму правильно развиваться.
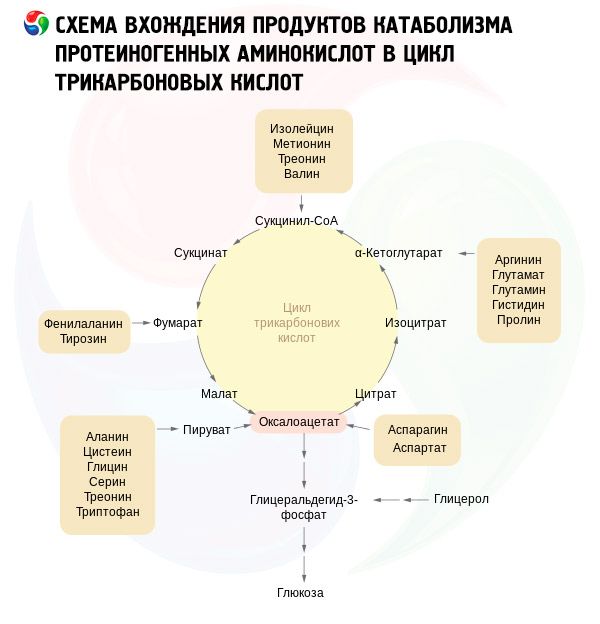
Так, углеводы, которые прошли гликолитический путь Эмбдена-Мейерхофа, превращаются в пируват (органическая кетокислота). Он сгорает в цикле Кребса. Белки, в свою очередь, расщепляются с помощью протеаз на аминокислоты (аланин, цистеин и серин также превращаются в пируват; тирозин, аспарагиновая кислота и фенилаланин являются источниками пирувата или оксалоацетата; тирозин, фенилаланин и лейцин превращаются в ацетил-Коэнзим А). Жиры с помощью липолиза также превращаются в ацетил-Коэнзим А.
При голодании или чрезмерном употреблении белковой и жирной пищи, постоянном стрессе развивается кетоз. Если организм, при этом, ощущает относительный или абсолютный дефицит углеводов, то стимулируется липолиз, который должен удовлетворить потребность в энергии.
При усиленном липолизе в печень поступает огромное количество свободных жирных кислот. Попадая туда, они начинают трансформироваться в ацетил-Коэнзим А. При этом, в цикл Кребса его поступление ограничено из-за уменьшением количества оксалоацетата (по причине недостаточности углеводов). Активность ферментов начинает снижаться, а это активирует процесс синтеза свободных жировых кислот и холестерина. Как результат, у организма остается только один выход – утилизировать ацетил-Коэнзим А через кетогенез (синтез кетоновых тел).
Кетоновые тела начинают либо окисляться в тканях до состояния воды и углекислого газа, либо выводится почками, ЖКТ и легкими. То есть, ацетонемический синдром начинает развиваться, если скорость утилизации кетоновых тел является ниже, чем скорость их синтеза.

Симптомы ацетонемического синдрома
Обычно дети, которые болеют на ацетонемический синдром, отличаются худощавым телосложением, они часто страдают из-за бессонницы и неврозов. Иногда они бывают сильно пугливыми, их нервная система быстро истощается. Несмотря на это, у таких детей лучше развивается речь, память, познавательные процессы, чем у других сверстников.
Ацетонемические кризисы считаются частым проявлением при данном синдроме. Подобные состояния обычно появляются после некоторых предвестников: сильной вялости, тошноты, мигренеподобных головных болей, плохого аппетита.
При типичном ацетонемическом синдроме частым симптомом является сильная тошнота с рвотой, после которых появляются признаки интоксикации или дегидратации. Обычно после двигательного беспокойства и возбудимости у ребенка наступает период сонливости и вялости. Если заболевание проходит в тяжелой форме, могут проявляться судороги, спазматические боли в животе, диарея или запор, повышенная температура тела.

Первые признаки
Как правило, первые признаки ацетонемического синдрома проявляются в раннем возрасте (два-три года). Участиться они могут в семь-восемь лет. Обычно, в двенадцатилетнем-тринадцатилетнем возрасте все симптомы исчезают бесследно.

Синдром ацетонемической рвоты
Синдром ацетонемической рвоты является сопутствующим синдромом при нервно-артрическом диатезе. Данное заболевание считается особенностью устройства детского организма. Она характеризируется тем, что изменяется минеральный и пуриновый обмен. Подобное состояние диагностируется у 3-5% детей. При чем, в последние годы количество больных постоянно увеличивается.
Основными симптомами синдрома ацетонемической рвоты являются:
Здесь очень важную роль играет наследственность. Если у родственников ребенка были диагностированы болезни, связанные с обменом веществ (подагра, желчекаменная и мочекаменная болезнь, атеросклероз, мигрени), то с большой вероятностью малыш будет болеть на этот синдром. Также не последнюю роль играет правильное питание.

Ацетонемический синдром у детей
Ацетонемический синдром у детей, как правило, имеет такую последовательность: сначала ребенок неправильно питается, что приводит к потере аппетита, частым рвотам. При этом изо рта малыша чувствуется явственный запах ацетона. Рвоты часто повторяются после приема пищи или воды. Иногда приводя к обезвоживанию. Как правило, к 10-11 годам ацетонемический синдром проходит самостоятельно.
Кроме того, что это заболевание характеризируется частыми кризами, также можно выделить:

Ацетонемический синдром у взрослых
У взрослых ацетонемический синдром может развиваться, когда нарушается пуриновый или белковый баланс. При этом в организме увеличивается концентрация кетоновых тел. Стоит понимать, что кетоны считаются нормальными составляющими нашего организма. Они являются главным источником энергии. Если в организм поступает достаточное количество углеводов, то это позволяет препятствовать избыточной выработке ацетона.
Взрослые часто забывают о правильном питании, что приводит к тому, что кетоновые соединения начинают накапливаться. Это становится причиной интоксикации, которая проявляется ацетонемической рвотой.
Кроме этого, причинами ацетонемического синдрома у взрослых может быть:
Сильно влияет на развитие болезни сахарный диабет 2 типа.
Симптомы наступления ацетонемического синдрома у взрослых:

Осложнения и последствия
Большое количество кетонов, которые и приводят к ацетонемическому синдрому, вызывает серьезные последствия. Самым тяжелым является метаболический ацидоз, когда внутренняя среда организма закисляется. Подобное может вызвать сбои в работе всех органов. У ребенка учащается дыхание, приток крови к легким усиливается, при этом уменьшаясь к другим органам. Кроме того, кетоны напрямую действуют на мозговую ткань, что может вызывать даже кому. Ребенок с ацетонемическим синдромом вялый и заторможенный.

Диагностика ацетонемического синдрома
Прежде всего, врач опирается на данные анамнеза, анализирует жалобы пациента, смотрит на клинические симптомы и проводит лабораторное исследование.
Какие критерии используются при диагностике?

Анализы
При клиническом анализе крови какие-нибудь изменения отсутствуют. Обычно по картине видна только та патология, которая привела к развитию синдрома.
Сдается также анализ мочи, в котором можно увидеть кетонурии (один плюс или четыре плюса). При этом наличие в мочи глюкозы каким-то особым симптомом не является.
Очень важными при постановлении диагноза являются данные, полученные от биохимического анализа крови. При этом чем больше длина периода ацетонемической рвоты, тем лучше видно дегидратацию. В плазме заметный высокий показатель гематокрита и белка. В крови также увеличивается количество мочевины из-за обезвоживания.

Инструментальная диагностика
Очень важным методом в постановлении диагноза является эхокардиоскопия. С ее помощью можно увидеть показатели центральной гемодинамики. Диастолический объем левого желудочка часто снижен, уменьшается венозное давление, фракция выброса также умеренно снижается. На фоне всего этого сердечный индекс увеличен из-за тахикардии.
Дифференциальная диагностика
Как правило, дифференциальную диагностику проводят с диабетическим кетоацидозом. Но при этом особенностями последнего являются: гипогликемия или значительная гипергликемия, классического «диабетического» анамнеза нет, состояние пациента заметно лучше.
К кому обратиться?
Лечение ацетонемического синдрома
Если вы заметили у своего ребенка первые признаки ацетонемического синдрома, необходимо сразу же дать ему любой сорбент (это может быть активированный уголь или энтеросгель). Для предотвращения обезвоживания необходимо постоянно давать пить минеральную воду (можно заменить на несладкий чай) в небольшом количестве, но довольно часто (каждые 5-7 минут). Это поможет снизить позывы к рвоте.
При лечении ацетонемического синдрома главными методами являются те, которые направлены на борьбу с кризами. Очень важно поддерживающее лечение, которое помогает снизить обострения.
Если ацетонемический криз уже развился, ребенка госпитализируют. Сразу же проводят так называемую диетическую коррекцию. Она основывается на употреблении легкоусвояемых углеводов, ограничении жирной пищи, обеспечении дробного питания и питья. Иногда ставят специальные очистительные клизмы с гидрокарбонатом натрия. Он помогает устранить некоторое количество кетоновых тел, которые уже попали в кишечник. Проводится оральная регидратация с помощью таких растворов как регидрон или орсоль.
Если обезвоживание сильно выражено, необходимо провести внутривенную инфузию 5% глюкозы и солевых растворов. Часто вводят спазмолитики, седативные препараты и противорвотные средства. При правильном лечении симптомы синдрома через 2-5 дней угасают.
Лекарства
Активированный уголь противопоказан при желудочных кровотечениях, язвах желудка.
Иногда прием Мотилиума может вызвать такие побочные эффекты: спазмы в кишечнике, расстройства кишечника, экстрапирамидный синдром, головная боль, сонливость, нервозность, уровень пролактина в плазме увеличивается.
Препарат не рекомендуется принимать при пролактиноме, желудочном кровотечении, механической непроходимости ЖКТ, массе тела до 35 кг, индивидуальной непереносимости компонентов.
Побочными действиями от приема препарата являются: диарея, запор, сухость во рту, головная боль, сонливость, депрессия, головокружение, агранулоцитоз, аллергическая реакция.
Нельзя принимать при кровотечениях в желудке, перфорации желудка, механической непроходимости, эпилепсии, феохромоцитоме, глаукоме, беременности, лактации.
Народное лечение
Ацетонемический синдром можно лечить и в домашних условиях. Но здесь стоит обратить внимание на то, что вы можете использовать только те средства, которые могут сбить ацетон. Если вы не видите улучшения в состоянии ребенка, нужно сразу же обращаться к врачу. Народное лечение в таком случае подходит только для того, чтобы устранить неприятный запах ацетона, уменьшить температуру или снять рвоту. К примеру, для устранения запаха отлично подойдет отвар из щавеля или специальный чай на основе шиповника.

Лечение травами
Обычно лечение травами проводится для прекращения рвоты. Для этого готовят такие отвары:
Питание и диета при ацетонемическом синдроме
Одной из главных причин появления ацетонемического синдрома является неполноценное питание. Для избежания рецидивов болезни в будущем, необходимо строго контролировать ежедневный рацион своего ребенка. Не стоит включать в него продукты с высоким содержанием консервантов, газированные напитки, чипсы. Не давайте малышу слишком жирную или жареную пищу.
Чтобы лечение ацетонемического синдрома прошло успешно, необходимо соблюдать диету две-три недели. В меню диеты обязательно входят: каши из риса, овощные супы, картофельное пюре. Если в течение недели симптомы не вернулись, можно постепенно добавлять диетическое мясо (не жареное), сухарики, зелень и овощи.
Диету можно всегда откорректировать, если снова вернуться признаки синдрома. При появлении неприятного запаха изо рта, нужно добавить много воды, которую необходимо пить маленькими порциями.
В первый день диеты нельзя ребенку давать ничего, кроме сухариков из ржаного хлеба.
На второй день вы можете добавить рисовый отвар или диетические печеные яблоки.
Если все делать правильно, то уже на третий день тошнота и понос пройдут.
Ни в коем случае не завершайте диету, если симптомы ушли. Врачи рекомендуют строго придерживать всех ее правил. На седьмой день вы можете добавить в рацион галетное печенье, рисовую кашу (без масла), суп из овощей.
Если температура тела не повышается, а запах ацетона пропал, то питание малыша можно делать более разнообразным. Можете добавить нежирную рыбу, овощное пюре, гречку, кисломолочные продукты.
Профилактика
После того как ваш ребенок выздоровел необходимо проводить профилактику заболевания. Если этого не делать, что ацетонемический синдром может стать хроническим. Первые дни обязательно соблюдайте специальную диету, откажитесь от жирной и острой пищи. После того как диета окончена, нужно постепенно и очень аккуратно вводить в ежедневный рацион другие продукты.
Очень важно употреблять здоровую пищу. Если вы включите в питание ребенка все необходимые продукты, то его здоровью ничего не будет угрожать. Также попытайтесь обеспечить ему активный образ жизни, избегайте стрессов, укрепите иммунитет и поддерживайте микрофлору.

Прогноз
Как правило, прогноз этого заболевания является благоприятным. Обычно в возрасте 11-12 лет ацетонемический синдром проходит самостоятельно, как и все его симптомы. Если вы своевременно обратитесь за квалифицированной помощью специалиста, то это поможет избежать многих осложнений и последствий.

Синдром гиперкетонемии у детей и подростков: патогенез, причины, диагностика
В статье представлены современные данные о физиологии энергетического обмена и роли в нем кетоновых тел. Рассмотрены основные причины избыточного образования кетонов, методы диагностики, подходы к лечению.
The article presents modern data on the physiology of energy metabolism and the role of ketone bodies in it. The main causes of excessive ketone formation, diagnostic methods, approaches to treatment are considered.
Часть 2. Начало статьи читайте в № 6, 2017 г.
Голодание
Голодание — это состояние организма, связанное с частичным или полным нарушением поступления пищи. В состоянии голодания резко снижаются источники энергии организма для важнейших структур организма. В условиях дефицита питательных веществ в организме образование энергии происходит за счет интенсификации глюкогенеза и синтеза кетоновых тел. Содержание глюкозы в крови уменьшается до нижних пределов нормы (3,5 ммоль/л) и на этом уровне поддерживается и в последующие периоды голодания. В печени при голодании глюкоза не в состоянии обеспечить должного количества оксалоацетата, поскольку ее просто нет в клетке. Поэтому при голодании жирные кислоты не «сгорают» в ЦТК, а превращаются в кетоновые тела.
Снижение запасов гликогена в печени сопровождается усиленным поступлением в нее свободных жирных кислот из адипоцитов. Концентрация жирных кислот в крови увеличивается в 3–4 раза по сравнению с постабсорбтивным состоянием. Уровень кетоновых тел в крови через неделю голодания повышается в 10–15 раз. В то же время дефицит углеводов тормозит окисление кетоновых тел, замедляя ресинтез их в высшие жирные кислоты [13].
Энергетические потребности мышц и большинства других органов удовлетворяются за счет жирных кислот и кетоновых тел. При низком уровне инсулина глюкоза в мышечные клетки не проникает, потребителями глюкозы являются инсулинонезависимые клетки и прежде всего клетки мозга, но и в этой ткани биоэнергетика частично обеспечивается кетоновыми телами. При такой концентрации ацетоуксусная кислота активно декарбоксилируется с образованием ацетона, который выводится с выдыхаемым воздухом и через кожу. Уже на 3–4 день изо рта и от кожи голодающего исходит запах ацетона.
Организм включает альтернативные способы выработки энергии — это глюконеогенез и синтез кетокислот, которые потребляются центральной нервной системой. При голодании повышается выброс глюкагона, который активирует липолиз в адипоцитах и окисление в печени. Количество оксалоацетата в митохондриях уменьшается, так как он, восстановившись до малата, выходит в цитозоль клетки, где опять превращается в оксалоацетат и используется в глюконеогенезе.
Глюконеогенез продолжается за счет распада тканевых белков. Аминокислоты образуются в результате распада мышечных белков и включаются в глюконеогенез при длительном голодании. Пируват образуется в печени из лактата и аланина. Аланин и глутамин являются наиболее важными глюкогенными аминокислотами при голодании. Пируват и метаболиты ЦТК способны образовывать оксалоацетат и включаться в глюконеогенез.
При голодании подавляется использование ацетил-КоА в ЦТК, и он используется исключительно для синтеза оксиметилглутарил-КоА, что приводит к увеличению образования кетоновых тел. В этих условиях кетоновые тела являются альтернативным (глюкозе) энергетическим материалом для мозга и других тканей. 75% потребности мозга в энергии удовлетворяется за счет ацетил-КоА [4].
Если голодание продолжается дни, недели — включаются другие гомеостатические механизмы, которые обеспечивают сохранение белковой структуры организма, замедляя глюконеогенез и переключая мозг на утилизацию кетоновых молекул. Сигналом для использования кетонов служит повышение их концентрации в артериальной крови. При длительном голодании наблюдаются крайне низкие концентрации инсулина в крови. В этом случае интенсивный кетогенез представляет собой компенсаторно приспособительную реакцию.
Интенсивность обмена веществ в целом снижена: через неделю голодания потребление кислорода уменьшается примерно на 40%, происходят торможение окислительных процессов в митохондриях и угнетение окислительного фосфорилирования с образованием АТФ, т. е. развивается гипоэнергетическое состояние.
Накапливаясь в крови, кетоновые тела подавляют секрецию и активность глюкокортикоидов, тем самым препятствуя разрушению структурных белков организма и угнетая секрецию глюкагона [2]. Если в это время голодающему вводить аланин или другие гликогенные аминокислоты, уровень глюкозы в крови повышается, а концентрация кетоновых тел снижается.
При голодании кетоз опасности не представляет, так как не достигает степени кетоацидоза. Последний развивается при сопутствующих факторах — дегидратации, алкогольной интоксикации и других состояниях.
Алкогольная интоксикация
Гиперпродукция кетокислот и кетоацидоз после чрезмерного употребления спиртного частое наблюдаемое состояние. Катаболизм этилового спирта осуществляется главным образом в митохондриях печени. Здесь окисляется от 75% до 98% введенного в организм этанола. Окисление алкоголя — сложный биохимический процесс. Основную роль в метаболизме этанола играет никотинамидадениндинуклеотид (NAD). Этот фермент превращает этанол в токсический метаболит — ацетальдегид и восстановленный NADH, а последний соответствует синтезу ацетоацетата и β-оксибутирата.
Алкогольдегидрогеназа катализирует обратимую реакцию, направление которой зависит от концентрации ацетальдегида и соотношения NADH/NAD + в клетке. Повышение концентрации ацетальдегида в клетке вызывает индукцию фермента альдегидоксидазы. В ходе реакции образуются уксусная кислота.
Полученная в ходе реакции уксусная кислота активируется под действием фермента ацетил-КоА-синтетазы. Реакция протекает с использованием кофермента А и молекулы АТФ. Образовавшийся ацетил-КоА, в зависимости от соотношения АТФ/АДФ и концентрации оксалоацетата в митохондриях гепатоцитов, может «сгорать» в ЦТК или использоваться на синтез жирных кислот или кетоновых тел.
На начальных стадиях алкоголизма ацетил-КоА в ЦТК — основной источник энергии для клетки. Избыток ацетил-КоА в составе цитрата выходит из митохондрий, и в цитоплазме начинается синтез жирных кислот.
В период острой алкогольной интоксикации, несмотря на наличие большого количества ацетил-КоА, недостаток оксалоацетата снижает скорость образования цитрата. В этих условиях избыток ацетил-КоА идет на синтез кетоновых тел. Увеличение концентрации NADH по сравнению с NAD + замедляет реакцию окисления лактата, увеличивается соотношение лактат/пируват. В крови возрастает концентрация лактата, это приводит к гиперлактацидемии и лактоацидозу. Повышение в крови содержания лактата, ацетоуксусной кислоты и β-гидроксибутирата служит причиной метаболического ацидоза при алкогольной интоксикации [14].
Способствует усиленному кетогенезу при алкогольной интоксикации гипогликемические состояния, связанные с рвотой и голоданием. Известно также, что у таких пациентов уровень инсулина в крови снижен, тогда как содержание кортизола, гормона роста, глюкагона и адреналина повышено. Этанол тормозит глюконеогенез. Дегидратация в этих случаях способствует кетогенезу.
Кетоз при нарушении гормональной регуляции
На уровень глюкозы в крови влияет широкий спектр гормонов, при этом только инсулин вызывает гипогликемический эффект. Контринсулярным действием с повышением уровня глюкозы крови обладают все гормоны: глюкагон, адреналин, глюкокортикоиды, адренокортикотропный (АКТГ), соматотропный (СТГ), тиреотропный (ТТГ), тиреоидные.
Эффекты инсулина и контринсулярных гормонов в норме регулируют стабильный уровень глюкозы в крови. При низкой концентрации инсулина усиливаются гипергликемические эффекты других гормонов, таких как глюкагон, адреналин, глюкокортикоиды и гормон роста. Это происходит даже в том случае, если концентрация этих гормонов в крови не увеличивается.
Патогенез кетоза при избытке тироксина, глюкокортикоидов, соматотропина или/и других гормонов, в сущности, аналогичен уже рассмотренным механизмам гиперпродукции кетокислот вследствие избытка контринсулярных гормонов [6]. Известно, что в период усиленного роста, а также при гипертиреозе наступает значительное похудание.
Стресс
При стрессе активируется симпатическая нервная система и выброс контринсулярных гормонов, происходит истощение углеводных резервов организма, нарушается способность печени синтезировать и откладывать гликоген. Происходит избыточное поступление в печень неэтерифицированных жирных кислот. В результате повышенной продукции глюкокортикоидов идет распад белков и усиленное образование кетоновых тел из кетогенных аминокислот.
Гиперкортицизм
Ацетонемический синдром может быть первым клиническим проявлением гиперкортицизма, когда характерные признаки заболевания еще не сформировались.
Глюкокортикоиды способствуют усилению мобилизации нейтральных жиров из жировой ткани и тормозят липогенез. Но это действие в организме может перекрываться другими эффектами данных гормонов: способностью вызывать гипергликемию и стимулировать секрецию инсулина, накопление гликогена в печени, что приводит к торможению мобилизации жира и его отложению в жировой ткани; способностью в больших дозах задерживать жиромобилизующее и стимулирующее окисление жиров соматотропином.
Этим можно объяснить накопление жира в жировых депо при гиперкортицизме (болезни и синдроме Иценко–Кушинга). Кроме того, при этом состоянии увеличено образование дигидрокортизона, который стимулирует пентозный цикл и превращение углеводов в жиры. Кортикотропин, стимулируя секрецию глюкокортикоидов, может влиять на жировой обмен в том же направлении, но, помимо этого, обладает еще и экстраадреналовым жиромобилизующим действием [6].
Тиреотоксикоз
Избыток тиреоидных гормонов в крови может быть следствием заболеваний, проявляющихся гиперфункцией щитовидной железы. Тяжелым осложнением основного заболевания, сопровождающегося гиперфункцией щитовидной железы, является тиреотоксический криз, который представляет собой резкое обострение всех симптомов тиреотоксикоза. Чрезмерное поступление в кровь тироидных гормонов вызывает тяжелое токсическое поражение сердечно-сосудистой системы, печени, нервной системы и надпочечников. В клинической картине характерны резкое возбуждение (вплоть до психоза с бредом и галлюцинациями), которое затем сменяется адинамией, сонливостью, мышечной слабостью, апатией. Усиливаются диспепсические расстройства: жажда, тошнота, рвота, жидкий стул. Возможно увеличение печени. На этом фоне резко усиливаются процессы кетогенеза, что может спровоцировать симптомы ацетонемии.
Тироксин обладает жиромобилизующим эффектом. При гипертиреозе усилен обмен углеводов. Увеличена утилизация глюкозы тканями. Активируется фосфорилаза печени и мышц, следствием чего является усиление гликогенолиза и обеднение этих тканей гликогеном. Увеличивается активность гексокиназы и всасывание глюкозы в кишечнике, что может сопровождаться алиментарной гипергликемией. Активируется инсулиназа печени, что вместе с гипергликемией вызывает напряженное функционирование инсулярного аппарата и в случае его функциональной неполноценности может привести к развитию сахарного диабета. Усиление пентозного пути обмена углеводов способствует образованию НАДФ-Н2. В надпочечниках это вызывает повышение стероидогенеза и большее образование кортикостероидов [4].
Дефицит гормонов
Гипогликемия всегда встречается при пангипопитуитаризме — заболевании, характеризующемся снижением и выпадением функции передней доли гипофиза (секреции адренокортикотропина, пролактина, соматотропина, фоллитропина, лютропина, тиреотропина). В результате резко снижается функция периферических эндокринных желез. Однако гипогликемия встречается и при первичном поражении эндокринных органов (врожденная дисфункция коры надпочечников, болезнь Аддисона, гипотиреоз, гипофункция мозгового слоя надпочечников, дефиците глюкагона). При дефиците контринсулярных гормонов снижается скорость глюконеогенеза в печени (влияние на синтез ключевых ферментов), повышается утилизация глюкозы на периферии, снижается образование аминокислот в мышцах — субстрата для глюконеогенеза.
Дефицит глюкокортикоидов
Первичная надпочечниковая недостаточность является следствием уменьшения секреции гормонов коры надпочечников. Под этим термином подразумевают различные по этиологии и патогенезу варианты гипокортицизма. Симптомы надпочечниковой недостаточности развиваются только после разрушения 90% объема ткани надпочечников.
Причины гипогликемии при надпочечниковой недостаточности схожи с причинами гипогликемии при гипопитуитаризме. Отличием является уровень возникновения блока — при гипопитуитаризме снижается секреция кортизола из-за дефицита АКТГ, а при надпочечниковой недостаточности из-за разрушения ткани самих надпочечников.
Гипогликемические состояния у больных с хронической надпочечниковой недостаточностью могут возникать как натощак, так и через 2–3 часа после приема пищи, богатой углеводами. Приступы сопровождаются слабостью, чувством голода, потливостью. Гипогликемия развивается в результате снижения секреции кортизола, уменьшения глюконеогенеза, запасов гликогена в печени.
Дефицит катехоламинов
Данное состояние может возникать при надпочечниковой недостаточности с поражением мозгового слоя надпочечников. Катехоламины, попадая в кровь, регулируют высвобождение и метаболизм инсулина, снижая его, а также увеличивают высвобождение глюкагона. При снижении секреции катехоламинов наблюдаются гипогликемические состояния, вызванные избыточной продукцией инсулина и пониженной активностью гликогенолиза.
Дефицит глюкагона
Глюкагон — гормон, являющийся физиологическим антагонистом инсулина. Он участвует в регуляции углеводного обмена, влияет на жировой обмен, активируя ферменты, расщепляющие жиры. Основное количество глюкагона синтезируется альфа-клетками островков поджелудочной железы. Однако установлено, что специальные клетки слизистой оболочки двенадцатиперстной кишки и слизистой оболочки желудка также синтезируют глюкагон. При поступлении в кровоток глюкагон вызывает повышение в крови концентрации глюкозы, вплоть до развития гипергликемии. В норме глюкагон предотвращает чрезмерное снижение концентрации глюкозы. Благодаря существованию глюкагона, препятствующего гипогликемическому действию инсулина, достигается тонкая регуляция обмена глюкозы в организме.
При дефиците вышеперечисленных гормонов содержание инсулина снижено, а экскреция кетоновых тел с мочой повышена [4].
Роль печени в нарушении энергетического обмена
Печень участвует в поддержании нормального уровня глюкозы в сыворотке крови путем гликогеногенеза, гликогенолиза и глюконеогенеза. В основе нарушений обмена углеводов при болезнях печени лежат повреждения митохондрий, которые ведут к снижению окислительного фосфорилирования. Вторично страдают функции печени. При тяжелом остром гепатите, как правило, отмечается гипогликемия, а при циррозах печени это наступает в конечной стадии — при печеночной недостаточности [15]. Гипогликемия объясняется снижением способности печени (из-за обширного поражения ее паренхимы) синтезировать гликоген и уменьшением выработки инсулиназы (фермента, разрушающего инсулин).
Дефицит углеводов приводит также к усилению анаэробного гликолиза, вследствие чего в клетках накапливаются кислые метаболиты, вызывающие снижение рН. При циррозе печени может повышаться и уровень лактата в сыворотке крови в связи со сниженной способностью печени утилизировать его для глюконеогенеза.
При заболеваниях печени увеличивается роль жиров в качестве источника энергии. В печени происходят синтез жирных кислот и их расщепление до ацетил-КоА, а также образование кетоновых тел, насыщение ненасыщенных жирных кислот и их включение в ресинтез нейтральных жиров и фосфолипидов. Катаболизм жирных кислот осуществляется путем β-окисления, основной реакцией которого является активирование жирной кислоты с участием кофермента ацетил-КоА и АТФ. Освобождающийся ацетил-КоА подвергается полному окислению в митохондриях, в результате чего клетки обеспечиваются энергией.
При ряде заболеваний печени снижается и синтез липопротеидов, что ведет к накоплению триацилглицеридов с последующей инфильтрацией и жировой дистрофией печени. Причинами возникновения этого состояния, в частности, является недостаток в пище липотропных веществ (холина — составной части лецитина, метионина). Увеличивается образование кетоновых тел [4].
Итак, клиническая картина вторичного ацетонемического синдрома включает в себя непосредственно явления кетоза, признаки основного заболевания, на фоне которого развился кетоз, а также проявления того состояния, которое запустило патологический процесс (стресс, чрезмерная физическая нагрузка, инфекция и т. д.).
Ацетонемическая циклическая рвота
В практике приходится сталкиваться с идиопатической ацетонемической рвотой, которая протекает с кетоацидозом (ацетонемическая рвота, недиабетический кетоацидоз). В англоязычной литературе она входит в синдром идиопатической циклической рвоты [16, 17].
Патогенез ацетонемической рвоты полностью не выяснен. Предполагается, что у детей после перенесенных инфекционных заболеваний, травм черепа, органических заболеваний центральной нервной системы в течение длительного времени в гипоталамо-диэнцефальной области остается доминантный очаг застойного возбуждения, индуцирующий нарушения жирового обмена (усиление кетогенеза, нарушение нормального использования кетоновых тел в связи с истощением углеводных запасов в организме). В патогенезе ацетонемической рвоты могут иметь значение аномалии конституции, относительная несостоятельность энзимных систем печени, нарушения эндокринной регуляции метаболизма.
Перспективными являются представления о синдроме циклической рвоты как о митохондриальной патологии [18, 19]. Поскольку митохондрии являются, образно выражаясь, энергетическими станциями клетки, при данном заболевании нарушается энергетический обмен. В условиях стресса и гипоксии энергетический обмен нарушается с преобладанием более быстрого анаэробного гликолиза, но при этом образуется только 2 молекулы АТФ, тогда как при аэробном — 38 [5]. Возникает дефицит энергии.
Такие нарушения тесно связаны с нарушениями пуринового обмена, поскольку энергия в организме хранится в виде нуклеотидов, среди которых аденин и гуанин являются пуриновыми, и они метаболизируются до мочевой кислоты, а тимин, цитозин и урацил являются пиримидиновыми и метаболизируются с образованием кетоновых тел, аммиака и β-изомасляной кислоты. Данные представления патогенетически сближают синдром циклической рвоты и синдром ацетонемической рвоты, а также объясняют необходимость и возможные пути метаболической коррекции.
Другие считают, что причиной резкого повышения кетоновых тел может быть недостаточное потребление детьми углеводов при избытке жиров и кетогенных аминокислот.
Кризы могут возникать внезапно с промежутками в несколько недель или месяцев. Провоцирующими факторами могут быть: нарушение диеты (жареные и печеные продукты), лихорадка, отказ от еды, физические и психические перегрузки.
Предвестниками синдрома циклической рвоты является анорексия, вялость или повышение возбудимости, тошнота, головные боли, абдоминальные боли, запах ацетона изо рта.
Затем появляется многократная или неукротимая рвота, которая может продолжаться от одного до пяти дней. Схваткообразные боли в животе усиливаются. Во время криза больной становится сонливым. В результате рвоты могут развиваться гемодинамические нарушения: тахикардия, мягкий пульс, приглушенность сердечных тонов, гипотония.
Печень умеренно увеличена. В некоторых случаях повышается температура. В выдыхаемом воздухе и рвотных массах ощущается запах прелых яблок. В моче высокая концентрация кетоновых тел. Приступы могут ликвидироваться спонтанно, без лечения.
Избыток кетоновых тел оказывает наркотическое действие на центральную нервную систему, что клинически проявляется вялостью, заторможенностью.
В биохимическом анализе крови обнаруживают нарушение липидного обмена (гиперхолестеринемию), тенденцию к гипогликемии, гиперкетонемию. В общем анализе крови: умеренный лейкоцитоз, нейтрофилез, ускоренная СОЭ.
В моче и выдыхаемом воздухе обнаруживается ацетон, в крови — повышенная концентрация кетоновых тел. На электроэнцефалограмме выявляются различные отклонения, не исчезающие полностью после прекращения приступа.
Этот синдром чаще встречается в дошкольном возрасте и сопровождается приступами многократной рвоты и кетонемии. У таких больных нередко выявляют повышенную возбудимость, мочекислую нефропатию, сахарный диабет, ожирение.
Кетоз при длительной рвоте, недоедании или голодании представляет классический компенсаторный процесс, призванный восполнить энергетический дефицит, точнее, недостаток углеводов, за счет альтернативных энергосубстратов кетокислот.
Диагноз синдрома ацетонемической рвоты можно подтвердить только после исключения других заболеваний, сопровождающихся рвотой: аппендицита и перитонита, энцефалитов, менингитов, начала отека головного мозга, отравления, токсикоза и инфекционных заболеваний и др. Но в первую очередь диабетического кетоацидоза.
Ацетонемические кризы у большинства детей прекращаются после 10–12 лет, но сохраняется большая вероятность развития таких патологических состояний, как подагрические кризы, вегетососудистые дистонии по гипертоническому типу, артериальная гипертензия.
Транзиторный кетоз у детей и подростков может выявляться при лихорадке, стрессах, инфекционных заболеваниях, голодании (во время болезни), употреблении богатой жирами пищи, напряженной физической активности. В этих случаях содержания кетоновых тел в моче не более 2+.
Лечение
Лечение и профилактика гиперкетонемии зависят от причины ее возникновения, но во всех случаях направлены на улучшение функции печени и нормализацию энергетического обмена. Это достигается ограничением содержания жира в пищевом рационе, назначением липотропных средств (метионина и др.), витаминов группы В, при необходимости — инсулина, кокарбоксилазы.
В период приступа синдрома циклической ацетонемической рвоты выраженная дегидратация, гиповолемия, метаболический ацидоз и электролитные нарушения — это основные факторы, которые определяют тяжесть состояния. Необходимо в первую очередь ликвидировать ацидоз: назначить промывание желудка и кишечника 1–2% раствором бикарбоната натрия. Антикетогенными свойствами обладает 5–10% раствор глюкозы, с добавлением необходимого количества инсулина, а также раствор Рингера [20].
Если питье не провоцирует рвоту, рекомендуется подслащенный чай, Регидрон, Оралит — частыми и небольшими объемами. После улучшения состояния и появления возможности приема жидкости назначается кормление ребенка. Диета должна содержать легкоусвояемые углеводы и ограниченное количество жиров (манная, овсяная, гречневая каши; картофельное пюре, печеные яблоки, сухари, сухое печенье).
Итак, выяснение механизмов развития кетонемического синдрома, выделение наиболее вероятных причин формирования кетоза дают возможность установить генез заболевания, а тем самым нормализовать состояние больного и предупреждать рецидивы кетонемии.
Литература
ФГБОУ ВО РНИМУ им. Н. И. Пирогова МЗ РФ, Москва